Cycle cellulaire
Enzymes mitotiques majeures
Aurora A
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

Aurora A est une kinase mitotique polaire qui organise la maturation centrosomale, la dynamique des microtubules et l’architecture du fuseau, sans intervenir dans la surveillance des attachements kinétochoriens.
Vue d'ensemble d'Aurora A
Aurora A est une kinase sérine/thréonine dont la fonction centrale consiste à structurer l’environnement mécanique et microtubulaire de la mitose en amont du point de contrôle du fuseau (SAC).
1. Son activité ne déclenche pas l’entrée en mitose, mais s’inscrit en aval du complexe cycline B/CDK1 (MPF), qu’elle traduit en une organisation spatiale cohérente du fuseau mitotique.
Elle se distingue ainsi fonctionnellement :
- d’Aurora B, dédiée à la régulation des attachements kinétochoriens et au contrôle du point de contrôle du fuseau (SAC).
- de Plk1,qui coordonne de manière globale les transitions mitotiques et l’enchaînement ordonné des événements mécaniques et enzymatiques.
2. Aurora A opère selon une logique polaire et architecturale, centrée sur les centrosomes, les microtubules polaires et leurs effecteurs structuraux.
(Figure : vetopsy.fr d'après Willems et coll)
3. Le tableau suivant, qui n’a pas vocation à être exhaustif, montre les principaux substrats phosphorylés par Aurora A au cours du cycle mitotique, classés selon la phase mitotique dominante, la localisation subcellulaire et la conséquence fonctionnelle principale, afin de mettre en évidence son rôle transversal.
| Substrat phosphorylé | Phase principale | Localisation | Conséquence fonctionnelle |
|---|---|---|---|
| Cdc25B | G2-prophase | Centrosomes |
|
| PLK1 (priming indirect) |
Centrosomes | Facilitation de l’activation de Plk1 via Bora |
|
| LATS2 | Prophase | Centrosomes | Maturation centrosomale et stabilité des pôles |
| PAK1 | Centrosomes |
|
|
| TPX2 | Prophase- métaphase |
Microtubules polaires |
Activation allostérique et stabilisation locale d’Aurora A |
| Nde1/Ndel1 | Centrosomes |
|
|
| Eg5/KIF11 | Fuseau mitotique |
Contribution indirecte à la bipolarité et à l’espacement des pôles |
|
| TACC1 | Microtubules | Contribution à la stabilité des microtubules polaires |
|
| TACC3 | Prophase- anaphase |
Microtubules polaires |
Stabilisation des faisceaux de microtubules en coordination avec XMAP215/ch-TOG |
| XMAP215 /ch-TOG |
Microtubules polaires |
Polymérisation contrôlée des microtubules du fuseau |
|
| HURP | Métaphase | Fuseau mitotique |
Stabilisation des microtubules proches des chromosomes |
| NuMA | Pôles du fuseau |
Focalisation et maintien de la cohésion des pôles |
|
| KIF2A | Métaphase- anaphase |
Centrosomes | Régulation de la dynamique microtubulaire aux pôles |
| TACC3 (activité résiduelle) |
Anaphase | Fuseau tardif |
Maintien transitoire de la stabilité polaire lors du remodelage |
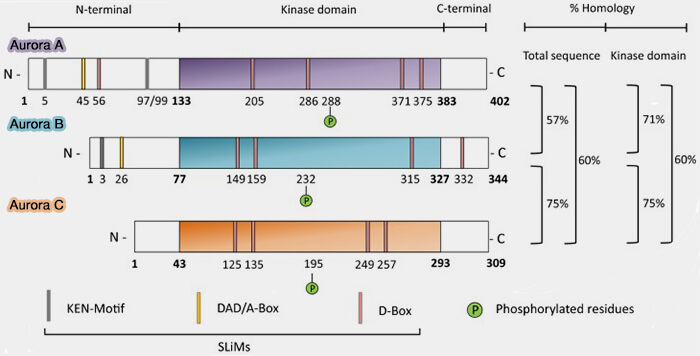
Structure et principes d’activation d’Aurora A
Aurora A est une kinase sérine/thréonine mitotique caractérisée par un domaine catalytique unique organisé selon l’architecture canonique des kinases eucaryotes (Structural Basis of Aurora-A Activation by TPX2 at the Mitotic Spindle 2003).
Aurora A appartient à la famille des kinases Aurora, qui comprend également Aurora B et Aurora C, partageant une organisation générale similaire mais des spécialisations fonctionnelles distinctes (The functional diversity of Aurora kinases: a comprehensive review 2018).
(Figure : vetopsy.fr d'après Bayliss et coll)
1. Son domaine kinase comprend :
- un lobule N-terminal, riche en feuillets β, impliqué dans la fixation de l’ATP et la flexibilité conformationnelle (
structure des kinases),
- un lobule C-terminal, majoritairement α-hélicoïdal, responsable de l’orientation du substrat et de l’activité catalytique,
- une boucle d’activation interlobulaire contenant le résidu clé Thr288, dont la phosphorylation est indispensable à l’activité catalytique.
2. À l’état basal, cette boucle est conformationalement instable et adopte une géométrie incompatible avec une catalyse efficace, ce qui limite fortement l’activité enzymatique d’Aurora A en l’absence de cofacteur en interphase.
3. Les kinases Aurora possèdent, en plus du domaine catalytique, des motifs courts appelés SLiMs (Short Linear Motifs) qui agissent comme degrons en contrôlant la stabilité et la dégradation de la kinase via le système ubiquitine-protéasome (UPS).
Parmi eux, la KEN-box, la D-box et la DAD/A-box sont des séquences fonctionnelles qui conditionnent l’interaction avec le complexe APC/C et influencent la durée de vie d’Aurora au cours du cycle cellulaire.
Activation et régulation d'Aurora A
La régulation d’Aurora A repose sur une combinaison étroite de mécanismes enzymatiques, allostériques et spatiaux, qui assurent une activation transitoire, localisée et strictement dépendante du contexte mitotique.
Régulation par phosphorylation
1. L’activité catalytique d’Aurora A dépend de la phosphorylation d’un résidu clé de sa boucle d’activation, Thr288.
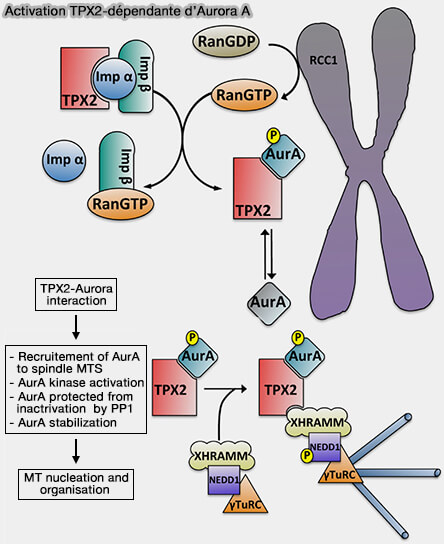
(Figure : vetopsy.fr d'après Garrido et Vernos)
a. Cette autophosphorylation est indispensable pour l’activité kinase, mais demeure instable et insuffisante en l’absence de mécanismes de stabilisation complémentaire.
En interphase, Thr288 est activement déphosphorylé par des phosphatases PP1 et PP2A en l’absence de TPX2, ce qui empêche l’accumulation d’Aurora A active (Non-centrosomal TPX2-Dependent Regulation of the Aurora A Kinase: Functional Implications for Healthy and Pathological Cell Division 2016).
1. L’autophosphorylation d’Aurora A sur Thr288 s’effectue majoritairement en trans.
Une molécule d’Aurora A phosphoryle la boucle d’activation d’une autre molécule d'Aurora A, rendue possible par leur rapprochement sur des plateformes mitotiques.
Cette phosphorylation initiale induit une activation enzymatique transitoire et instable, qui ne devient fonctionnelle et durable qu’après stabilisation allostérique de la boucle d’activation, notamment par la liaison de TPX2 (
2. L’activité du complexe cycline B/CDK1 (MPF) contribue indirectement à l’activation d’Aurora A en phosphorylant plusieurs partenaires structuraux ou fonctionnels impliqués dans l’organisation du PCM et des plateformes mitotiques, facilitant ainsi le rapprochement d’Aurora A et de ses cofacteurs.
En activant l’entrée en mitose, CDK1 provoque :
- la réorganisation du matériel péricentriolaire (PCM), notamment PCNT (péricentrine) et CEP192,
- l’augmentation de la concentration locale d’Aurora A et de ses cofacteurs comme TPX2,
- la formation de plateformes propices à leur rapprochement, notamment au niveau des centrosomes et des microtubules polaires.
Régulation allostérique par TPX2
1. Aurora A est une kinase puissante dont l’activité doit être strictement canalisée.
Si elle pouvait être activée simultanément par plusieurs cofacteurs, dans plusieurs compartiments, et sur des ensembles de substrats distincts, son activité deviendrait :
- spatialement diffuse,
- fonctionnellement ambiguë,
- potentiellement délétère, en raison de phosphorylations hors contexte.
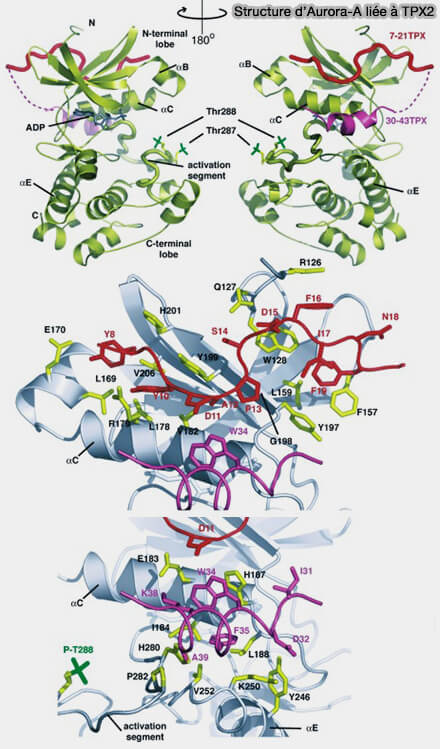
1. L’activation physiologique d’Aurora A repose sur l’interaction avec TPX2, cofacteur central d’Aurora A en mitose (Non-centrosomal TPX2-Dependent Regulation of the Aurora A Kinase: Functional Implications for Healthy and Pathological Cell Division 2016).
a. Son interface directe avec le domaine kinase induit plusieurs réarrangements architecturaux majeurs qui :
- stabilisent la boucle d’activation dans une conformation catalytiquement compétente,
- repositionnent l’hélice αC, élément clé du réseau de communication allostérique des kinases,
- verrouillent le site actif dans un état fermé, augmentant l’efficacité de transfert du phosphate.
b. En parallèle, l’interface Aurora A-TPX2 masque physiquement le résidu Thr288 phosphorylé, réduisant l’accessibilité aux phosphatases et prolongeant l’état actif.
2. Cette interaction transforme Aurora A d’une kinase faiblement active en interphase en une kinase fortement active, mais uniquement dans les compartiments où TPX2 est présent, imposant une restriction spatiale stricte et dépendante des microtubules de l’activité kinase.
Régulation spatiale de l’activité
L’activité d’Aurora A est strictement régulée dans l’espace et le temps afin d’éviter toute phosphorylation ectopique et de garantir une spécialisation fonctionnelle adaptée à l’organisation du fuseau mitotique (Aurora kinases: Generators of spatial control during mitosis 2023).
Cette régulation repose sur l’existence de régimes d’activation distincts, associés à des plateformes protéiques polaires spécifiques.
1. Au niveau des pôles du fuseau, Aurora A est recrutée et activée au sein du matériel péricentriolaire (PCM), qui constitue une plateforme d’ancrage et d’amplification locale de son activité.
a. CEP192 et PCNT (péricentrine) assurent le recrutement préférentiel d’Aurora A aux centrosomes et aux régions proximales des pôles du fuseau (CEP192 localises mitotic Aurora-A activity by priming its interaction with TPX2 2024).
Cette organisation favorise une augmentation locale de la concentration d’Aurora A et participe à l’amplification de son activité kinase.
b. En parallèle, CEP192 et PCNT organisent l’assemblage des complexes de nucléation microtubulaire, notamment via NEDD1 (GCP-WD) et les complexes γ-TuRC, contribuant ainsi à la mise en place et au renforcement du réseau microtubulaire polaire.
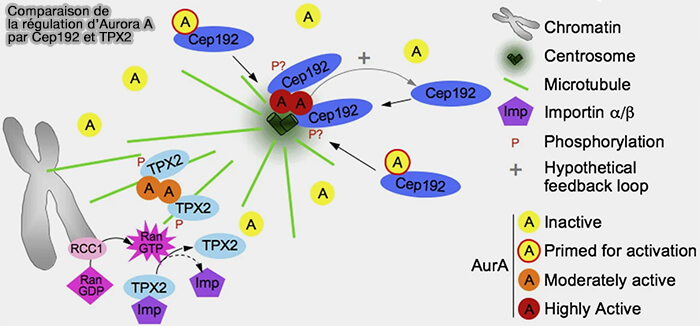
(Figure : vetopsy.fr d'après Joukov et coll)
2. En aval du régime centrosomal, Aurora A adopte un second régime fonctionnel centré sur les microtubules polaires du fuseau (Centrosomal protein of 192 kDa (Cep192) promotes centrosome-driven spindle assembly by engaging in organelle-specific Aurora A activation 2010).
- Ce régime repose sur l’interaction avec TPX2, adaptateur majeur du ciblage microtubulaire d’Aurora A, qui dirige Aurora A vers les microtubules polaires, stabilise sa conformation active et contraint spatialement son activité enzymatique.
- Dans ce contexte, Aurora A agit en amont d’effecteurs spécialisés de la dynamique microtubulaire, en particulier le complexe TACC3-XMAP215/ch-TOG, qui traduisent l’activité d’Aurora A en processus de stabilisation, de croissance persistante et d'organisation mécanique des microtubules polaires (Constrained TACC3 peptidomimetics for a non-canonical protein-protein interface elucidate allosteric communication in Aurora-A kinase 2025).
3. La coexistence de ces deux régimes fonctionnels, spatialement et conformationnellement distincts, confère à Aurora A plusieurs propriétés clés :
- une activité élevée mais strictement localisée,
- une spécialisation pour l’architecture des pôles et des microtubules polaires,
- l’absence d’implication directe dans les mécanismes décisionnels du cycle cellulaire car elle phosphoryle préférentiellement des substrats déjà positionnés dans son voisinage immédiat.
Aurora A et cycle cellulaire
Aurora A et interphase
1. En interphase, Aurora A agit comme un facteur de préparation centrosomale à faible activité, assurant la compétence des pôles en vue de son activation brutale lors de l’entrée en mitose.
Cela la distingue clairement de Plk1, déjà actif en G2.
2. Aurora A est présente aux centrosomes dès la phase G2, mais maintenue dans un état peu actif par l’absence de cofacteurs mitotiques (TPX2 notamment) et par des mécanismes inhibiteurs.
Elle participe à la préparation de l’entrée en mitose en contribuant à :
- la maturation progressive du matériel péricentriolaire (PCM),
- l’accumulation et l’organisation de composants centrosomaux clés, i.e. CEP192, PCNT (péricentrine) et NEDD1 (GCP-WD),
- la mise en place d’un centrosome compétent pour une activation rapide en prophase.
Aurora A et prophase
En prophase, Aurora A est activée de manière brutale par TPX2 et agit comme une kinase organisatrice du fuseau mitotique naissant, localisée préférentiellement aux centrosomes et aux microtubules polaires.
1. À ce titre, coordonne les événements structuraux précoces de la prophase en agissant sur plusieurs niveaux :
- l’organisation et la maturation des pôles du fuseau, par la phosphorylation de protéines centrosomales clés, notamment CEP192, NEDD1 (GCP-WD) et PCNT (péricentrine), ce qui stabilise les pôles du fuseau et favorise le recrutement efficace des complexes γ-TuRC, augmentant la capacité de nucléation microtubulaire,
- la dynamique du fuseau mitotique naissant, par la phosphorylation de protéines associées aux microtubules et aux pôles, telles que TACC3, TPX2 et la kinésine Eg5/KIF11, contribuant à l’allongement, au parallélisme et au remodelage rapide des microtubules polaires du fuseau naissant,
- la coordination spatiale des forces cytosquelettiques, en modulant les complexes microtubule-moteur et les régulateurs de la stabilité des pôles, assurant un environnement cytoplasmique mécaniquement cohérent favorable à la rupture de l’enveloppe nucléaire et à l’établissement du fuseau bipolaire.
2. Par cette action, Aurora A organise le cadre mécanique initial du fuseau en assurant une coordination spatiale efficace des forces mécaniques qui seront mobilisées lors des étapes ultérieures de la mitose, notamment pour la capture des chromosomes.
Aurora A et prométaphase
En prométaphase, Aurora A agit principalement au niveau des centrosomes et des microtubules polaires, où elle contribue à l’organisation et à la stabilité fonctionnelle du fuseau mitotique en cours de maturation.
1. Sur le plan structural, Aurora A favorise la dynamique des microtubules polaires et la cohésion des pôles centrosomaux, notamment par la phosphorylation de protéines associées au fuseau telles que TPX2, TACC3 et la kinésine Eg5/KIF11, principalement impliquées dans la dynamique et l’architecture des microtubules polaires.
Cette activité favorise l’allongement, le parallélisme et le remodelage rapide des microtubules, tout en maintenant une nucléation et une organisation polaires efficaces.
2. En renforçant la densité et la persistance des microtubules polaires, Aurora A optimise l’exploration spatiale du cytoplasme et crée un cadre mécanique favorable à l’établissement des premiers attachements chromosome-fuseau, en particulier des attachements kinétochoriens latéraux initiaux avec les microtubules.
Elle contribue ainsi à la synchronisation structurale du fuseau en prométaphase, en amont de l’alignement métaphasique, sans intervenir directement dans la correction des attachements kinétochoriens end-on stables, qui est le rôle d'Aurora B.
Aurora A et métaphase
1. En métaphase, Aurora A est principalement active aux pôles du fuseau, où elle intervient dans le maintien de la géométrie bipolaire et de la robustesse mécanique du fuseau.
- Aurora A stabilise les pôles mitotiques et régule la dynamique des microtubules polaires par la phosphorylation de MAP associées aux pôles, notamment TPX2, TACC3, XMAP215/ch-TOG, maintenant une croissance et une organisation des microtubules compatibles avec la symétrie et la stabilité du fuseau métaphasique, malgré une dynamique intrinsèquement élevée des microtubules.
- Cette activité maintient une nucléation, une croissance et une organisation des microtubules compatibles avec la symétrie bipolaire et la stabilité du fuseau métaphasique, malgré la forte dynamique microtubulaire.
2. TACC3 est un effecteur structural direct d’Aurora A et agit comme facteur de renforcement mécanique des microtubules polaires déjà formés.
a. Aurora A phosphoryle TACC3 au niveau des pôles et le long des microtubules du fuseau.
b. Cette phosphorylation permet à TACC3 de former un complexe fonctionnel avec XMAP215/ch-TOG qui :
- stabilise les microtubules polaires,
- favorise leur croissance persistante,
- limite les catastrophes précoces dans le fuseau métaphasique.
3. Aurora A assure ainsi un support structural et enzymatique global, indispensable au maintien de l’état métaphasique, sans intervenir directement dans la surveillance des attachements kinétochoriens ni dans la signalisation du point de contrôle du fuseau (SAC).
Aurora A en anaphase et télophase
En anaphase et en télophase, l’activité d’Aurora A décroît progressivement, mais une activité résiduelle persiste aux pôles du fuseau, où elle contribue à la stabilité transitoire du fuseau en cours de remodelage et de désassemblage, sans participer directement aux mécanismes moteurs de séparation.
1. Aurora A phosphoryle principalement des protéines associées aux microtubules polaires et aux centrosomes, notamment :
- TACC3, maintenant la cohésion et l’alignement des faisceaux de microtubules polaires en coordination avec XMAP215/ch-TOG, dans un contexte de désassemblage progressif du fuseau,
- XMAP215/ch-TOG, contribuant à une polymérisation contrôlée des microtubules polaires résiduels,
- TPX2, assurant la stabilisation locale d’Aurora A et la cohérence fonctionnelle des pôles tant que le fuseau n’est pas complètement démantelé.
2. Cette activité résiduelle :
- limite les instabilités prématurées du fuseau pendant l’anaphase B,
- accompagne une séparation régulière des pôles, sans en être le moteur principal, celui-ci reposant principalement sur l’activité de la kinésine-5 (Eg5/KIF11), soutenue par KIF15, via le glissement des microtubules antiparallèles ou interpolaires et la dynéine corticale, via la traction sur les microtubules astraux.
- s’éteint progressivement lors de la sortie de mitose, parallèlement à la chute de l’activité du complexe cycline B/CDK1 (MPF) à la dégradation de ses cofacteurs mitotiques et à l’action des phosphatases PP1 et PP2A.
L’extinction progressive de l’activité d'Aurora A ne constitue pas un mécanisme autonome, mais s’inscrit dans la bascule globale kinases-phosphatases qui gouverne la sortie de mitose, conduisant au démantèlement du fuseau tardif, à la transition vers la cytokinèse et à la réinitialisation des centrosomes vers un état interphasique.
Retour aux enzymes mitotiques
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


