Constituants cellulaires
Cytosquelette : microtubules
MAP : protéines associées aux microtubules
MAP stabilisatrices : principales protéines et mécanismes
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les MAP stabilisatrices regroupent des protéines aux mécanismes distincts, agissant par interactions externes, intraluminales ou dynamiques pour contrôler la stabilité microtubulaire.
Famille tau/MAP2/MAP4
La famille tau/MAP2/MAP4 regroupe des MAP stabilisatrices partageant une organisation modulaire flexible, qui sont adaptées à une interaction étendue avec la surface externe du microtubule, sans imposer de contrainte géométrique rigide au polymère (Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules’ physical properties and neurite morphology 2023).
Structure de MAP2/MAP4/Tau
Ces MAP présentent une architecture intrinsèquement désordonnée, dépourvue de domaines globulaires compacts, leur conférant une grande plasticité conformationnelle en solution et au contact des microtubules.
1. Elles possèdent des domaines de liaison aux microtubules (MTBD) C-terminaux divisés en trois sous-domaines.
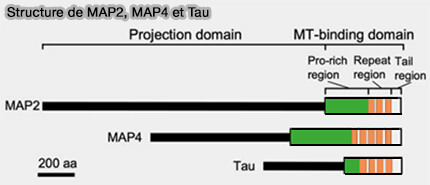
(Figure : vetopsy.fr d'après Nishida et coll)
a. La région riche en proline, située en amont du cœur de liaison, adopte une conformation flexible qui confère une grande plasticité conformationnelle au MTBD et facilite l’adaptation spatiale de la protéine à la surface externe du microtubule, sans qu'elle établsse à elle seule de contacts stables avec la tubuline.
b. La région de répétitions, constituant le noyau fonctionnel du MTBD, est formée de motifs conservés répétés en tandem, contenant la séquence promouvant l’assemblage, capable d’interagir directement avec les dimères d'αβ-tubuline.
- Ces répétitions, majoritairement basiques, interagissent préférentiellement avec la surface externe des dimères α/β-tubuline en reconnaissant des patches acides, principalement portés par la tubuline β, au niveau des crêtes protofilamentaires et des interfaces latérales du lattice.
- Chaque répétition établit des contacts faibles mais spécifiques avec la surface externe du lattice, et l’addition de plusieurs répétitions permet une interaction multipoint coopérative avec des dimères adjacents, le long d’un protofilament et entre protofilaments voisins.
- Parmi les répétitions du domaine de liaison aux microtubules, R4 se distingue par une propension structurale plus élevée à adopter des conformations ordonnées et à établir des interactions répétition-répétition, i.e. fibrilles, traduisant une hétérogénéité intrinsèque des modules du MTBD (Mechanisms of secretion and spreading of pathological tau protein 2019).
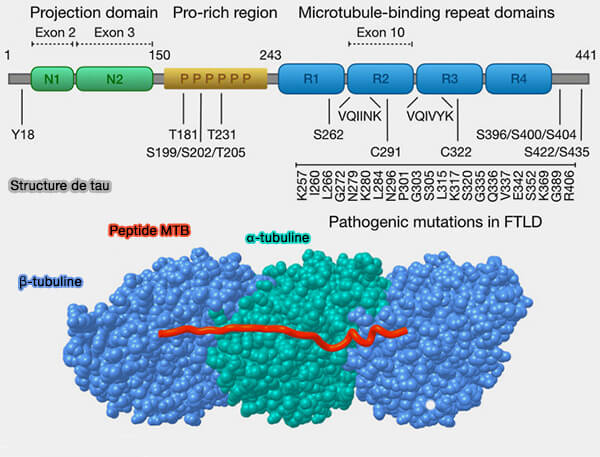
(Figure : vetopsy.fr d'après Brunello et coll)
c. La queue C-terminale, flexible, contribue à la stabilisation de l’association protéine/microtubule en augmentant la liberté conformationnelle du domaine de liaison, ce qui facilite l’orientation et le positionnement simultané de plusieurs répétitions du MTBD sur le lattice, renforçant ainsi leur engagement coopératif avec les dimères de tubuline.
Remarque : des données cryo-EM récentes sur MAP4 montrent que les motifs répétés du domaine de liaison aux microtubules s’associent à la surface externe du lattice le long des protofilaments, consolidant ainsi les contacts longitudinaux sans intervenir dans les contacts internes du microtubule (Structural insight into microtubule stabilization and kinesin inhibition by Tau family MAPs 2024).
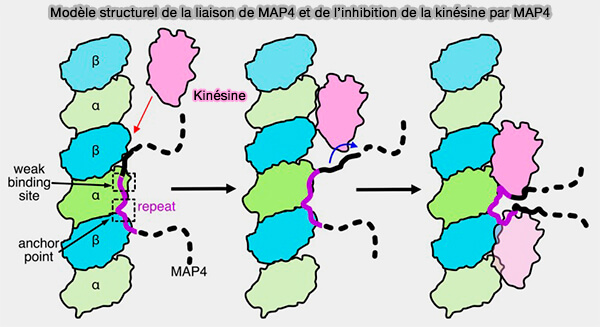
(Figure : vetopsy.fr d'après Shigematsu et coll)
2. La région N-terminale, située en amont du domaine de liaison aux microtubules, ne présente pas de structure tridimensionnelle stable identifiée à ce jour.
- Elle est majoritairement intrinsèquement désordonnée et n’interagit pas directement avec les dimères α/β-tubuline.
- Cette région agit comme un bras flexible qui espace le MTBD du reste de la molécule, augmente le volume d’exploration conformationnelle et contribue indirectement à l’accessibilité du domaine de liaison au lattice.
Implications sur la stabilité des microtubules
Chaque molécule de Tau, MAP2 ou MAP4 établit simultanément plusieurs contacts faibles mais coopératifs avec des dimères d'αβ-tubuline adjacents, soit le long d’un même protofilament, soit entre protofilaments voisins.
Cette organisation multipoint favorise une occupation continue de la surface externe du microtubule et renforce la cohésion latérale entre protofilaments adjacents, sans interférer avec l’architecture interne du polymère.
1. En pratique, ces MAP limitent les fluctuations angulaires relatives entre protofilaments.
- Les interfaces latérales α/β-tubuline sont maintenues dans une configuration compatible avec l’état polymérisé, ce qui réduit l’ouverture locale du lattice, la formation de défauts latéraux et la dissociation de dimères.
- En renforçant les contacts latéraux et en amortissant les fluctuations structurales associées aux transitions conformationnelles de la tubuline, Tau, MAP2 et MAP4 diminuent la probabilité de catastrophes et prolongent la durée de vie des microtubules, en particulier pour des polymères longs et faiblement contraints.
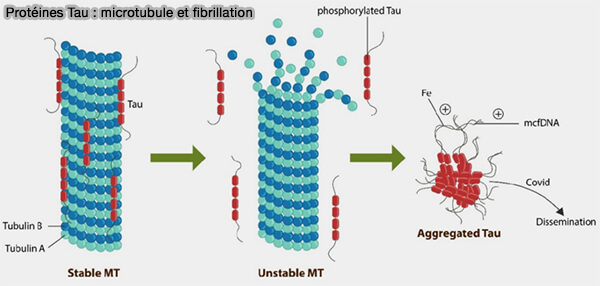
(Figure : vetopsy.fr d'après Sfera et coll)
2. À la différence de MAP2 et MAP4, Tau possède en outre une propension intrinsèque à l’auto-association fibrillaire, au détriment de l’engagement avec le lattice, liée à l’exposition accrue de la répétition R4, illustrant une spécialisation structurale propre à ce membre de la famille (
Spécialisation cellulaire des membres de la famille
Malgré des spécialisations d’expression et de localisation cellulaire distinctes, les membres de la famille Tau/MAP2/MAP4 partagent un mécanisme commun de stabilisation reposant sur un renforcement externe et flexible du lattice microtubulaire.
1. MAP4 est exprimée de manière ubiquitaire et assure une fonction stabilisatrice générale des microtubules dans les cellules non neuronales.
2. Tau est majoritairement exprimée dans les neurones où elle stabilise les microtubules axonaux (Structural exposure of different microtubule binding domains determines the propagation and toxicity of pathogenic tau conformers in Alzheimer’s disease 2025).
3. MAP2 est enrichie dans les dendrites et contribue à l’organisation du cytosquelette dendritique (More than a marker: potential pathogenic functions of MAP2 2022)
MAP1
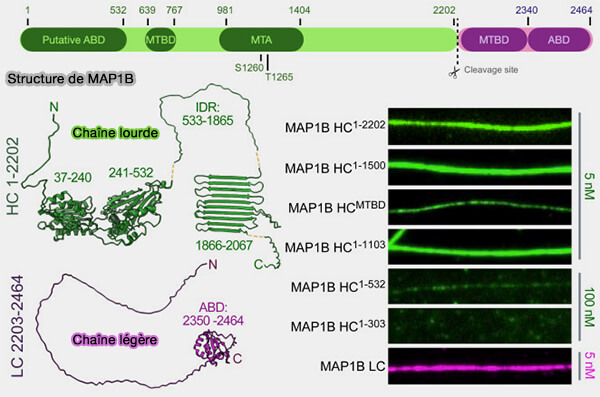
MAP1 désigne une famille de protéines associées aux microtubules, principalement représentée par MAP1A et MAP1B, qui jouent un rôle majeur dans la stabilisation du cytosquelette microtubulaire neuronal (The MAP1 family of microtubule-associated proteins 2006).
(Figure : vetopsy.fr d'après Sfera et coll)
1. MAP1A et MAP1B, largement désordonnées, sont synthétisées sous la forme d’un précurseur clivé en chaînes distinctes (Microtubule-associated protein, MAP1B, encodes functionally distinct polypeptides 2024).
a. La chaîne lourde, responsable de l’association principale aux microtubules, possède de larges régions flexibles permettant une interaction étendue avec la surface externe du lattice microtubulaire.
Elle ne comporte pas de répétitions MTBD homologues à celles de tau ou MAP2, traduisant une architecture moléculaire propre à la famille MAP1.
b. Une ou plusieurs chaînes légères, s’associent de manière non covalente à la chaîne lourde, et modulent l’interaction et l’organisation du complexe.
Remarque : malgré une analogie terminologique avec les moteurs moléculaires, ce complexe est dépourvu d’activité enzymatique et remplit une fonction exclusivement structurale.
2. MAP1 s’associe aux microtubules par une liaison externe distribuée, sans rigidifier localement la conformation des dimères, principalement le long des protofilaments, caractérisée par :
- une association longitudinale continue avec des dimères α/β-tubuline successifs, qui limite les interruptions structurales le long des microtubules,
- l’absence de contrainte mécanique intraluminale, qui réduit la progression des dépolymérisations lentes,
- une stabilisation qui n’implique pas la formation de domaines dynamiques distincts sur le lattice et favorise la persistance de microtubules continus sur de grandes distances.
3. MAP1 est principalement exprimée dans les neurones et s’associe aux microtubules axonaux et dendritiques, où elle contribue à la stabilisation longitudinale des faisceaux microtubulaires (The MAP1B Case: An Old MAP That is New Again 2014).
- MAP1 est principalement exprimée dans les neurones et s’associe aux microtubules axonaux et dendritiques, où elle contribue à la stabilisation longitudinale des faisceaux microtubulaires.
- Contrairement à tau, dont l’association est compatible avec des domaines plus dynamiques, MAP1 est préférentiellement associée à des segments microtubulaires durables, participant au maintien de l’architecture neuronale sans imposer de contrainte mécanique interne au polymère.
MAP6 (STOP)
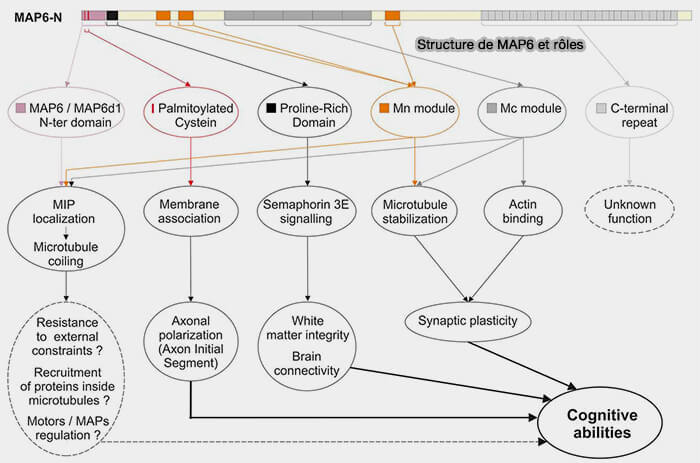
MAP6, également appelée STOP (Stable Tubule Only Polypeptide), est une MAP stabilisatrice atypique qui confère aux microtubules une résistance exceptionnelle aux dépolymérisations induites par le froid, à la dilution de tubuline libre ou à certains agents dépolymérisants.
(Figure : vetopsy.fr d'après Cuveiller et coll)
1. Contrairement aux MAP stabilisatrices canoniques qui se fixent majoritairement à la surface externe du lattice, MAP6 interagit préférentiellement avec la face luminale du microtubule (MAP6 is an intraluminal protein that induces neuronal microtubules to coil 2020).
- L’organisation modulaire de MAP6 repose sur des modules Mn et Mc aux propriétés stabilisatrices distinctes dont l’action coopérative lors de la polymérisation permet l’intégration de MAP6 au sein du microtubule, sans qu’un module unique puisse être tenu pour seul responsable de l’architecture intraluminale observée.
- Cette intégration s’appuie sur des régions de MAP6 riches en séquences basiques et répétées, capables de reconnaître la géométrie concave de la cavité luminale formée par l’assemblage hélicoïdal des protofilaments α/β-tubuline, et de s’y organiser lors de la croissance du polymère.
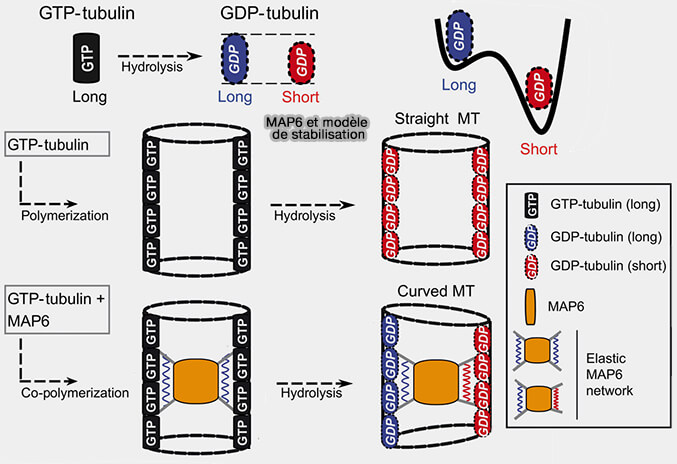
2. La figure propose un modèle mécanique expliquant comment l’incorporation luminale de MAP6 modifie l’état structural du microtubule après hydrolyse du GTP (MAP6 is an intraluminal protein that induces neuronal microtubules to coil 2021).
Après hydrolyse du GTP, la tubuline-GDP peut adopter deux états conformationnels proches mais distincts, un état dit " long " et un état dit " court ", ce dernier étant énergétiquement favorisé.
(Figure : vetopsy.fr d'après Cuveiller et coll)
a. En absence de MAP6, la transition vers l’état " court " se produit de manière globalement homogène autour du cylindre microtubulaire.
- Le lattice se contracte de façon symétrique, ce qui préserve la rectitude du microtubule malgré le changement conformationnel.
- Cette rectitude géométrique ne traduit pas une rigidité accrue, mais au contraire un état mécaniquement relâché du lattice, dans lequel les déformations locales restent peu coûteuses énergétiquement.
b. En présence de MAP6, un réseau intraluminal se met en place lors de la polymérisation et contraint localement la tubuline à conserver l’état " long ".
Après hydrolyse du GTP, la coexistence forcée d’états " long " et " court " impose une contrainte interne persistante au lattice qui augmente le coût énergétique de toute déformation supplémentaire, qu’il s’agisse d’une flexion locale, d’un glissement inter-protofilamentaire ou d’une ouverture latérale du polymère.
2. L’ancrage luminal de MAP6 au coeur du microtubule :
- rigidifie la structure cylindrique du microtubule en augmentant la cohésion mécanique entre protofilaments adjacents et en limitant leurs variations angulaires relatives,
- limite les déformations locales du lattice,
- réduit la propagation des défauts structuraux le long du polymère.
3. MAP6 se distingue fonctionnellement des +TIPs et des MAP organisatrices.
Elle n’intervient ni dans la reconnaissance de l’extrémité (+) qui correspond à la coiffe GTP, ni dans la capture corticale, ni dans la nucléation.

L'action de MAP6 est post-assemblage et stabilise les segments déjà polymérisés, prolongeant leur durée de vie lorsque la stabilité à long terme est requise.
4. MAP6 joue un rôle majeur dans les cellules neuronales.
(Figure : vetopsy.fr d'après Sun et coll)
a. Dans les neurones, MAP6 participe au maintien de faisceaux microtubulaires stables au sein des axones et des dendrites, en contribuant à :
- la polarité neuronale,
- l’intégrité des prolongements,
- la résistance du cytosquelette aux contraintes mécaniques prolongées.
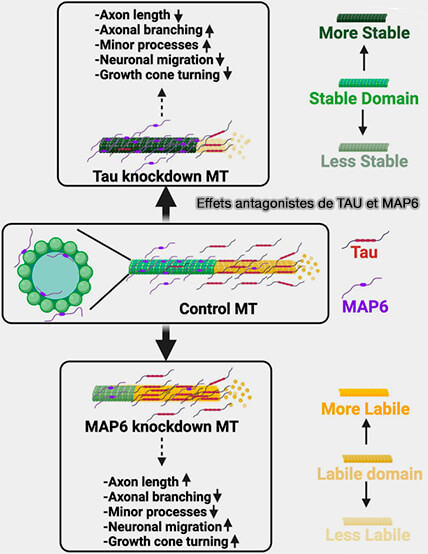
b. À l’échelle du microtubule, cette fonction s’exerce de manière antagoniste à celle de tau (Antagonistic roles of tau and MAP6 in regulating neuronal development 2024 et Tau and MAP6 establish labile and stable domains on microtubules 2025).
- MAP6 s’associe préférentiellement à des segments microtubulaires stables, où elle impose une contrainte structurale durable, tandis que tau occupe des domaines distincts plus dynamiques du lattice.
- Cette ségrégation fonctionnelle permet la coexistence, au sein d’un même neurone, de microtubules rigidifiés par MAP6 et de microtubules plus labiles associés à tau, assurant simultanément stabilité architecturale et plasticité du réseau axonal et dendritique.
HURP
HURP stabilise sélectivement les microtubules situés à proximité immédiate des chromosomes, dans une zone contrôlée par le gradient Ran-GTP.
1. Son action consolide les fibres impliquées dans la capture et l’alignement chromosomiques.
a. La stabilisation régionale des microtubules périchromosomiques augmente leur persistance, ce qui :
- améliore l’efficacité des interactions avec les kinétochores,
- renforce la correction et le maintien des attachements appropriés lors de l’alignement métaphasique.
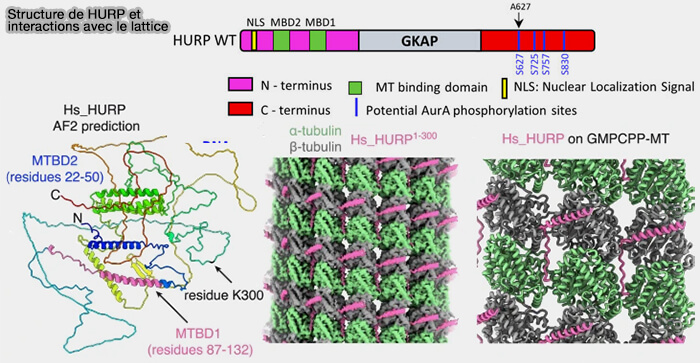
(Figure modifiée : vetopsy.fr d'après Valdez et coll et Didascalou)
b. À l’échelle moléculaire, HURP possède deux modules de liaison au microtubule (MTBD1 et MTBD2).
- Le MTBD1, résolu par cryo-EM, adopte une organisation bipartite comprenant une hélice qui s’ancre à la surface externe de la β-tubuline et une boucle s’insérant entre deux protofilaments, établissant des contacts simultanés avec plusieurs sous-unités de tubuline.
- Le MTBD2, plus distal et probablement plus flexible, contribue à l’affinité globale et à la stabilisation complète du lattice.
Ce mode de liaison multipoint renforce les interactions latérales du lattice, réduisant la fréquence des catastrophes et favorisant les événements de sauvetage.
2. Cette stabilisation locale module finement la dynamique des extrémités microtubulaires.
En agissant à proximité des chromosomes, HURP réduit les catastrophes locales et favorise les événements de sauvetage, sans abolir la dynamique, permettant un ajustement progressif des fibres en réponse aux contraintes du fuseau mitotique.
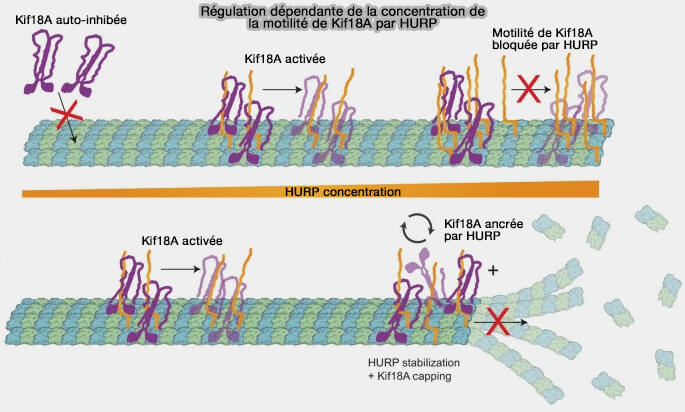
(Figure : vetopsy.fr d'après Perez-Bertoldi et coll)
3. HURP participe également à cette régulation en coordonnant l’activité de la kinésine-8 Kif18A sur les microtubules kinétochoriens (HURP regulates Kif18A recruitment and activity to synergistically control microtubule dynamics 2024).
a. KIF18A est une kinésine-8 spécialisée dans le contrôle fin de la longueur et de la dynamique des microtubules kinétochoriens, avec un rôle central en métaphase (Microtubule end tethering of a processive kinesin-8 motor Kif18b is required for spindle positioning 2018).
- Sur le plan fonctionnel, KIF18A se déplace préférentiellement vers les extrémités (+) des microtubules kinétochoriens où elle réduit la dynamique résiduelle, en limitant la polymérisation excessive et en favorisant un état de longueur stable.
- Cette activité ne provoque pas une dépolymérisation massive, mais amortit les fluctuations des extrémités (+), ce qui est essentiel pour maintenir les chromosomes alignés de manière précise sur la plaque équatoriale.
b. En fonction de sa densité sur le lattice périchromosomique, HURP peut :
- favoriser le recrutement et la motilité de KIF18A le long des microtubules,
- ou au contraire en restreindre l’activité par compétition locale sur le lattice.
c. Cette coordination HURP-KIF18A permet un contrôle adaptatif de la longueur des fibres kinétochoriennes, compatible avec le maintien des attachements end-on sous tension et avec la stabilité métaphasique, sans rigidifier le fuseau ni perturber sa capacité d’ajustement.

Cette régulation spatialisée contribue à une dynamique ordonnée du cytosquelette mitotique, compatible avec les exigences temporelles du cycle cellulaire.
TACC3
TACC3 (Transforming Acidic Coiled-Coil protein 3) est une MAP mitotique associée aux microtubules du fuseau, principalement au niveau des microtubules polaires.
1. Elle ne présente pas une affinité élevée pour les microtubules à l’état basal et n’exerce une activité fonctionnelle qu’après phosphorylation par Aurora A.
Cette phosphorylation permet le recrutement et la stabilisation du complexe XMAP215/ch-TOG sur les microtubules, favorisant leur croissance et leur robustesse mécanique au sein du fuseau mitotique.
2. TACC3 agit ainsi comme une MAP stabilisatrice contextuelle, dont la fonction dépend du signal mitotique local et de l’activation d’Aurora A, plutôt que comme une MAP constitutive du réseau microtubulaire.
Retour aux MAP
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


