Constituants cellulaires
Cytosquelette : microtubules
Dynamique : catastrophe, sauvetage et régulation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les transitions catastrophe et sauvetage reflètent la perte ou la restauration de la coiffe GTP, modulées par les MAP et les contraintes cellulaires.
Les microtubules présentent un comportement appelé " instabilité dynamique ", caractérisé par des transitions brusques.
Catastrophes
La catastrophe correspond au passage brutal d’un microtubule en phase de dépolymérisation rapide et correspond à plusieurs facteurs (Microtubule instability driven by longitudinal and lateral strain propagation (2020).
La catastrophe est donc un événement mécaniquement auto-amplifié, très sensible à la taille instantanée de la coiffe, quasi inévitable dès que les protofilaments GDP sont exposés (
1. Le déclencheur principal est la disparition de la coiffe (
- Le polymère encaisse des micro-déformations jusqu’au moment où la coiffe est trop courte et la tension longitudinale ne suffit plus.
- Le protofilament expose immédiatement des dimères GDP courbés, une interface latérale affaiblie, une tendance naturelle à l’ouverture des protofilaments.
- Il suffit qu’un protofilament commence à s’ouvrir pour que les voisins perdent aussi leurs contacts latéraux, l’ouverture se propage comme une fermeture éclair inversée, la dépolymérisation devienne auto-entretenue.
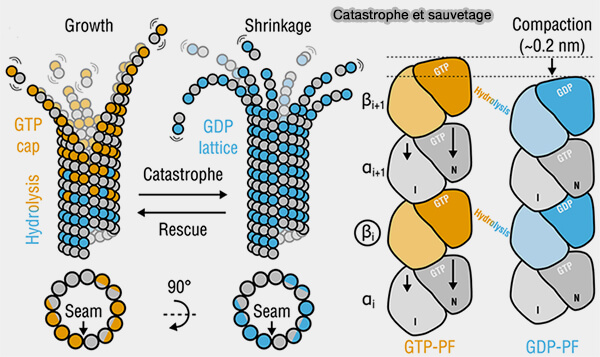
(Figure : vetopsy.fr d'après Igaev et coll)
2. Des facteurs intrinsèques augmentent la probabilité de catastrophe.
a. Toute force qui plie, comprime ou tord le microtubule facilite la rupture des contacts latéraux comme :
- les interactions cortex-microtubules, par traction dynéine-dépendante au cortex,
- les chocs moléculaires, lors de collisions avec des microtubules voisins ou des complexes protéiques,
- les contraintes du fuseau mitotique, sous l’effet des forces opposées exercées par les kinétochores et les pôles.
b. Si le pool de tubuline-GTP diminue, la croissance ralentit, la coiffe rétrécit et la catastrophe est facilitée.
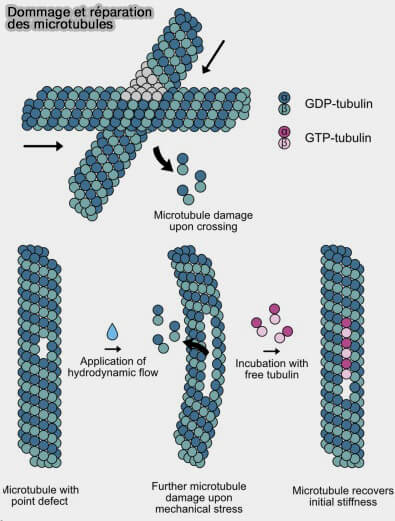
c. Des défauts dans le lattice, i.e. sites réparés, hétérogénéité d’isoformes, zones détyrosinées… peuvent créer des points faibles favorisant l’ouverture.
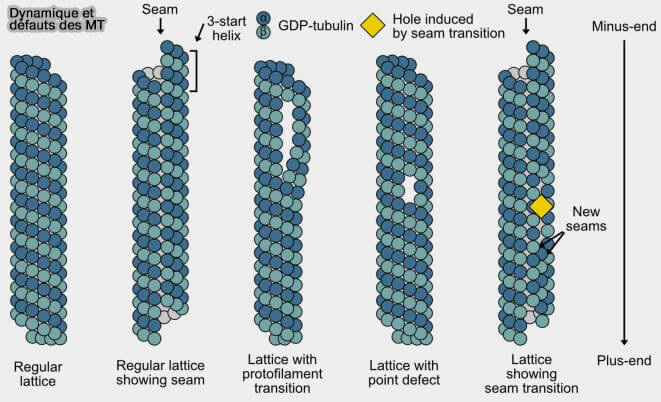
(Figure : vetopsy.fr d'après Motta et coll)
3. Certaines MAP dites déstabilisatrices augmentent la probabilité de catastrophe pour remodeler rapidement le réseau, particulièrement dans le fuseau mitotique.
a. Une instabilité élevée permet de balayer rapidement l’espace pour capturer les kinétochores (Beyond uniformity: Exploring the heterogeneous and dynamic nature of the microtubule lattice 2023).
- MCAK (kinésine-13) courbe et arrache les protofilaments, entraînant une dépolymérisation immédiate (Microtubule-regulating kinesins 2013).
- La stathmine séquestre la tubuline libre, réduit la taille de la coiffe et facilite l’entrée en catastrophe.
b. En complément des MAP déstabilisatrices directes comme les kinésines-13, certains moteurs orientés vers l’extrémité (-), tels que les kinésines-14, participent à la régulation de la dynamique des microtubules.
En s’associant transitoirement aux complexes +TIPs au niveau de l’extrémité (+), ces moteurs exercent une force antagoniste dirigée vers l'extrémité (-), ce qui perturbe l’organisation du TIP, augmente la probabilité de catastrophe et limite la longueur des microtubules (Kinesin-14 motors participate in a force balance at microtubule plus-ends to regulate dynamic instability 2022).

(Figure : vetopsy.fr d'après Ogren et coll)
Sauvetage
Le sauvetage correspond au passage soudain d’un microtubule en dépolymérisation rapide vers une nouvelle phase de croissance.
Le sauvetage n'est pas un simple ralentissement : c’est une réinversion complète du cycle mécanique du protofilament qui est déclenchée lorsqu’un segment du microtubule rencontre une zone plus stable, capable de réimposer la géométrie rectiligne.
Le sauvetage correspond à un retour spontané à la croissance, favorisé par :
- l'acétylation des tubulines par αTAT1 sur K40,
- des îlots GTP (GTP islands) au sein du lattice,
- l’action des MAP stabilisatrices,
- des facteurs +TIP qui rétablissent une zone GTP-like.
1. αTAT1 pénètre dans la lumière du microtubule par les extrémités et ouvertures du réseau microtubulaire et favorise l’acétylation des microtubules au site K40 de l'α-tubuline (Beyond uniformity: Exploring the heterogeneous and dynamic nature of the microtubule lattice 2023).
Cette acétylation permet aux protofilaments microtubulaires de glisser les uns contre les autres, rendant le microtubule plus flexible et plus résistant aux contraintes mécaniques.
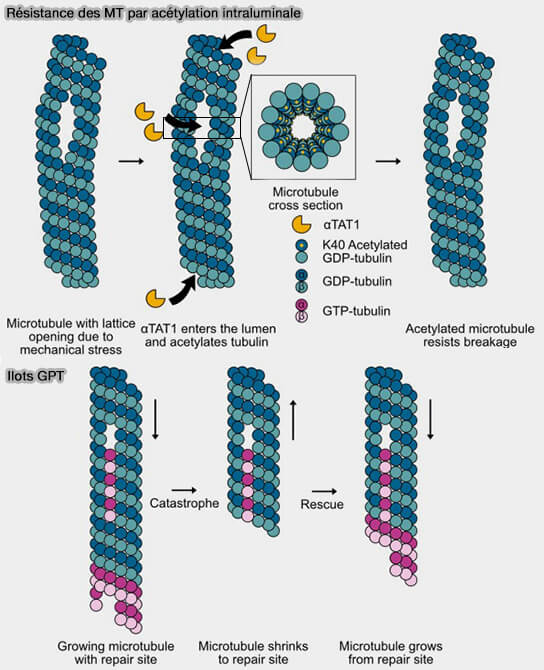
(Figure : vetopsy.fr d'après Motta et coll)
2. Les GTP islands, îles GTP sont des patchs résiduels de lattice contenant de la tubuline-GTP ou GTP-like non hydrolysée.
a. Elles apparaissent :
- soit parce qu’une fraction de tubuline-GTP n’a pas été hydrolysée,
- soit par réparation du lattice.
Ce mécanisme incorpore localement des tubulines-GTP dans une zone endommagée, ce qui sécurise le réseau dans les régions soumises à forte contrainte (cortex cellulaire, axones) et augmente la fréquence des sauvetages.
b. Leur rôle est de recréer localement une géométrie droite, de rétablir des contacts latéraux forts et de stopper la dégradation en cascade.
(Figure : vetopsy.fr d'après Motta et coll)
2. Certaines MAP renforcent l’extrémité ou les segments du microtubule.
- CLASP1/2, principales MAP de sauvetage se positionnent sur les zones de lattice déformé, restaurent la géométrie latérale, bloquent la propagation des protofilaments ouverts, créent des " sites de sauvetage " (rescue sites).
- EB1/EB3 soutiennent l’extrémité lors des ralentissements et coopèrent avec CLASP.
- MAP6 augmente la probabilité de sauvetage dans les axones soumis à forte contrainte.
3. Certains facteurs biophysiques favorisent le sauvetage comme :
- une concentration locale élevée en tubuline-GTP,
- la traction longitudinale qui redresse le protofilament,
- la présence de microtubules adjacents servant de support géométrique (effet lattices couplés).
4. Ce mécanisme intervient dans plusieurs contextes cellulaires où la reprise de croissance conditionne la stabilité et l’organisation du réseau microtubulaire.
- Dans le fuseau mitotique, les sauvetages stabilisent les microtubules kinétochoriens.
- Au cortex cellulaire des cellules migratoires, ils renforcent les protrusions frontales (
migrations)
- Dans les axones, ils compensent la fragilité mécanique des microtubules longs.
Modulation par les protéines associées
La dynamique des microtubules est ajustée en permanence par des MAP qui modulent la cohésion latérale, la géométrie des extrémités et la propagation des protofilaments courbés.
- Les MAP stabilisatrices, i.e. tau, MAP2, MAP4, CLASP prolongent la durée de vie du polymère.
- Les MAP déstabilisatrices telles que MCAK ou la stathmine augmentent la probabilité de catastrophe.
- Les +TIPs, notamment EB1/EB3, CLIP-170, CLASP et XMAP215/ch-TOG, guident la croissance et coordonnent capture, orientation et sauvetage.
- Les enzymes de coupure AAA+, i.e. fidgetine, spastine et katanine, génèrent des coupures contrôlées permettant le remodelage spatial du réseau.
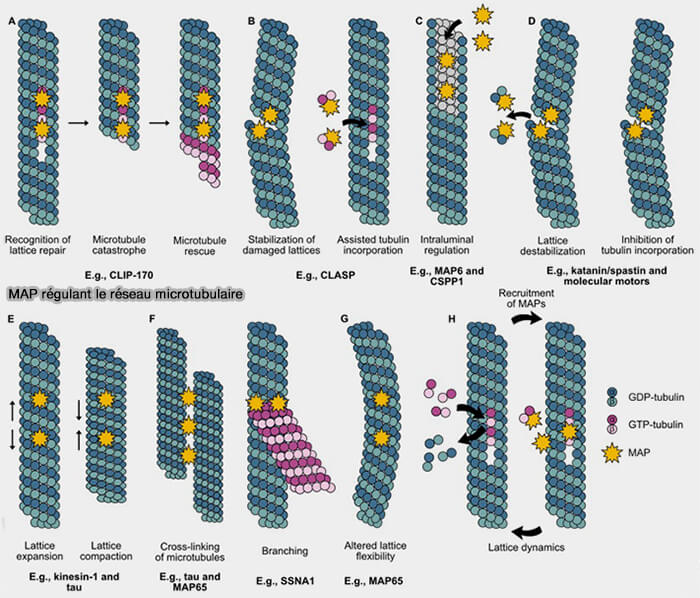
(Figure : vetopsy.fr d'après Motta et coll)
Dynamiques selon le contexte cellulaire
La dynamique microtubulaire varie fortement selon le contexte cellulaire, en fonction des contraintes mécaniques et des besoins fonctionnels propres à chaque compartiment.
Cycle cellulaire
Lors du cycle cellulaire, la dynamique microtubulaire varie fortement selon la phase (Spatial and Temporal Scaling of Microtubules and Mitotic Spindles 2022).
1. En interphase, le réseau radial présente une croissance modérée stabilisée par les MAP stabilisatrices comme MAP4, et les catastrophes y restent rares afin de maintenir un réseau persistant dédié au transport intracellulaire.
2. À l’entrée en mitose, la dynamique s’accélère de manière marquée (KLP10A and KLP59C: The dynamic duo of microtubule depolymerization 2005).
3. En métaphase, le turnover rapide des dimères d'αβ-tubuline permet la capture, l’alignement et la ségrégation des chromosomes, sous l’action combinée des MAP déstabilisatrices telles que MCAK et des facteurs d’élongation comme XMAP215/ch-TOG.
La nucléation est alors dominée par :
- la voie de ramification non centrosomale assurée par l'augmine,
- l’activité de TPX2 guidée par Ran-GTP autour des chromosomes, garantissant un renouvellement rapide du fuseau.
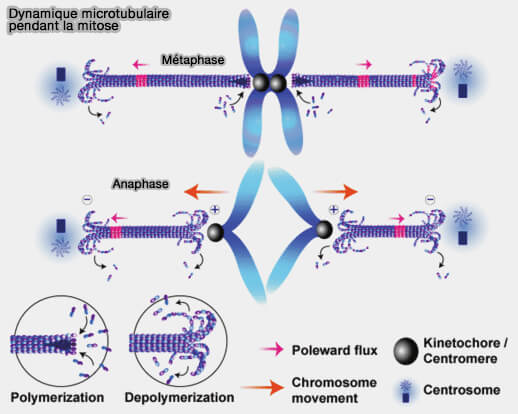
(Figure : vetopsy.fr d'après Sharp et coll)
4. En anaphase, la dynamique des microtubules est profondément réorganisée.
a. Les microtubules interpolaires s’allongent pour étirer le fuseau, tandis que les microtubules kinétochoriens se raccourcissent pour séparer les chromatides.
b. Cette transition repose sur un changement coordonné des régimes de croissance et de dépolymérisation, contrôlé par :
- les forces motrices orchestrées par les moteurs, glissement antiparallèle par la kinésine-5 (Eg5/KIF11) et traction par la dynéine,
- les MAP mitotiques, i.e. MCAK (kinésine-13), stathmine, PRC1 (faisceautage des microtubules interpolaires), CLASP (régulation locale des plus-ends), EB1/EB3 et partenaires associés au contrôle fin des extrémités (+), i.e. +TIPs.
- l’activité coordonnée de l’APC/C, qui coordonne la transition métaphase-anaphase en déclenchant la dégradation de la cycline B et de la sécurine, ce qui reprogramme l’activité des moteurs et des MAP du fuseau.
Cellules spécialisées
Dans les cellules spécialisées, les microtubules adoptent des comportements adaptés aux contraintes mécaniques et fonctionnelles propres à chaque tissu.
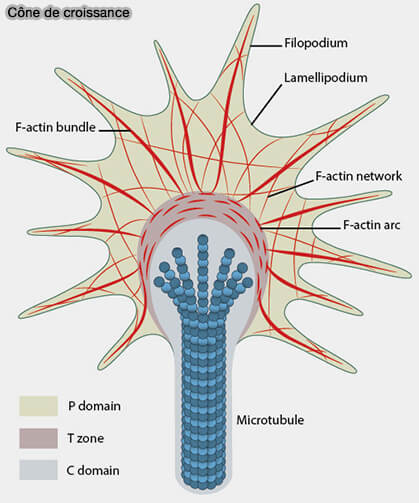
(Figure : vetopsy.fr d'après Cytokeleton dynamics)
1. Dans les neurones :
- les axones abritent des microtubules particulièrement stables, enrichis en modifications post-traductionnelles (acétylation, détyrosination),
- les cônes de croissance présentent une dynamique élevée, une fréquence accrue de sauvetages et une forte dépendance à MAP6, EB1 et XMAP215/ch-TOG.
- la fragmentation par katanine génère des fragments matrice favorisant l’allongement axonal.
2. Au cortex cellulaire des cellules en migration, les catastrophes sont souvent induites par la traction corticale exercée par la dynéine, alors que les extrémités (-) sont stabilisées par CAMSAP/patronine, structurant des réseaux non radiaux capables de répondre rapidement aux signaux de polarité et aux forces directionnelles.
Ces organisations spécialisées permettent au réseau microtubulaire de concilier stabilité architecturale et réactivité locale, ajustant en permanence croissance, catastrophe et sauvetage selon l’état cellulaire et les exigences mécaniques du microenvironnement.
Intégration des signaux cellulaires
La dynamique microtubulaire intègre simultanément des signaux chimiques et mécaniques.
- Les kinases mitotiques, i.e. Plk1, Aurora A et CDK1 (MPF), modulent l’activité des MAP lors des transitions G2/M, tandis que le gradient Ran-GTP assure une nucléation locale autour des chromosomes.
- Les forces mécaniques, i.e. traction, compression, tension corticale, influencent directement les transitions croissance-catastrophe.
- Les voies de stress, telles que l’oxydation ou la déformation du cytosquelette, modifient la cohésion du lattice et la capacité de sauvetage.
Cette coordination multisignaux permet au réseau microtubulaire d’ajuster finement sa dynamique selon l’état cellulaire et les contraintes du microenvironnement.
Retour aux microtubules
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


