Constituants cellulaires
Cytosquelette : microtubules
Fission : fidgetin et katanine
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Fidgetin et la katanine sont des ATPAses AAA+ complémentaires qui fragmentent sélectivement les microtubules selon leur état de modification pour remodeler le réseau et ajuster sa plasticité.
Fidgetin et la katanine sont complémentaires car elles ciblent des microtubules différents et interviennent à des moments distincts du remodelage.
a. Fidgetin agit en maintenance interne précoce, en préparant le terrain en quelque sorte.
En amont, elle agit sur des microtubules peu modifiés, internes et jeunes, qu’elle fragmente pour éliminer les segments faibles, compacter le réseau et organiser les faisceaux naissants.
b. La katanine exerce un remodelage puissant et plus tardif .
En aval, elle agit sur des microtubules très polyglutamylés, stabilisés ou sous tension, qu’elle libère et renouvelle pour restructurer les grandes architectures.
Ensemble, elles couvrent l’ensemble du spectre, des microtubules immatures aux fibres matures et fortement modifiées, et assurent le renouvellement, la plasticité et la réorganisation du réseau, du centrosome aux faisceaux axonaux.
(Figure : vetopsy.fr d'après Smart et Sharp)
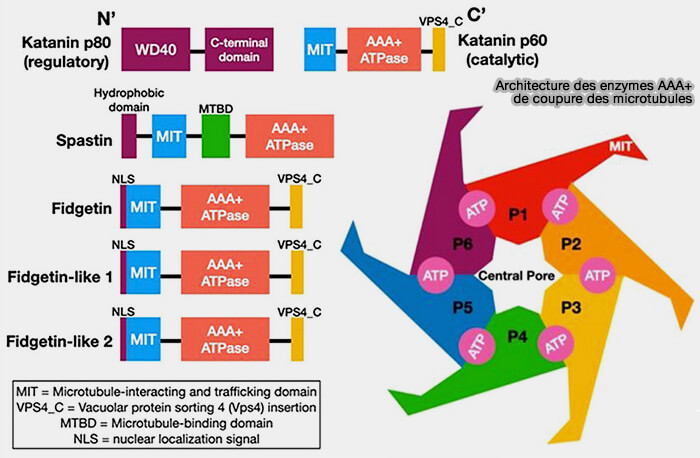
Fidgetin
Structure
Fidgetin est une ATPAse AAA+ apparentée à la katanine et à la spastine, mais dotée d’un profil de ciblage distinct, composée de plusieurs domaines (The fidgetin family: Shaking things up among the microtubule-severing enzymes 2024).
1. Le domaine N-terminal de fidgetin assure un ciblage subcellulaire interne, notamment vers les zones corticales, axonales ou centrosomales, mais il ne contient pas :
- d'hairpin hydrophobe, contrairement à la spastine M1,
- de motif MTBD classique,
- de véritable domaine MIT fonctionnel.
Remarquvée : fidgetin est décrit comme portant un domaine MIT en N-terminal, ce qui suggère un potentiel de liaison protéique analogue à Vps4.
- Toutefois, à ce jour, aucune donnée structurale ou biochimique solide n’a confirmé que ce MIT joue un rôle effectif de liaison au lattice microtubulaire.
- L’interaction de fidgetin semble reposer plutôt sur des affinités faibles vis-à-vis de la tubuline tyrosinée ou sur des cofacteurs, et non sur un MTBD clairement identifié. »
2. Le domaine central contient des modules régulateurs encore mal caractérisés mais fonctionnellement importants qui agissent comme un filtre sélectif, lui permettant d'intervenir là où le réseau doit être ajusté avec finesse.
Il module l’affinité de fidgetin pour des lattices spécifiques, en particulier les microtubules tyrosinés et labiles des régions internes ou corticales.
3. Le domaine AAA+ C-terminal est responsable de la fission, avec une activité généralement plus faible car il n'est pas conçu pour une coupure massive.
a. L’AAA+ de fidgetin est décrit comme modéré car son hexamère est moins rigide, son ancrage au microtubule est plus faible, et ses substrats sont des microtubules labiles et peu modifiés.
Son activité est donc optimisée pour un remodelage fin plutôt que pour une coupure massive comme la katanine ou la spastine.
b. Son activité de coupure modérée est très ciblée, adaptée aux régions nécessitant un compactage ou un rééquilibrage :
- centrosome,
- intérieur des axones,
- zones internes du fuseau mitotique,
- cortex cellulaire des cellules migratoires.
Rôles de fidgetin
Fidgetin cible préférentiellement les microtubules faiblement polyglutamylés, lui conférant une niche fonctionnelle complémentaire de celle de katanine.
(Figure : vetopsy.fr d'après Zhang et coll)
1. Dans les régions internes du réseau, notamment dans les axones et les fuseaux mitotiques, fidgetin agit comme un régulateur de la compaction interne et de la plasticité du réseau (Human Fidgetin is a microtubule severing the enzyme and minus-end depolymerase that regulates mitosis 2012) :
- en évitant l’accumulation de faisceaux trop rigides,
- en facilitant les microdéformations nécessaires au repositionnement du réseau.
Remarque : dans les neurones en croissance, cette étape est cruciale pour (Fidgetin-like 2 is a novel negative regulator of axonal growth and can be targeted to promote functional nerve regeneration after injury 2020) :
- organiser le segment initial,
- guider l’allongement axonal,
- structurer les faisceaux internes avant leur stabilisation.
2. Elle génère de nouvelles extrémités de croissance par les fragments produits qui servent de matrices pour (Knockdown of Fidgetin Improves Regeneration of Injured Axons by a Microtubule-Based Mechanism 2019) :
- réamorcer la polymérisation,
- densifier le réseau,
- renouveler les microtubules indépendamment du centrosome.
(Figure : vetopsy.fr d'après Hu et coll)
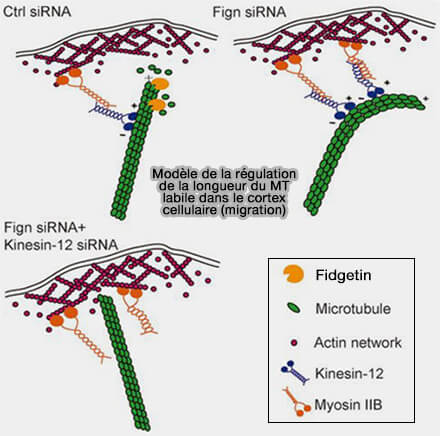
3. Fidgetin contribue à la migration en remodelant les microtubules labiles de la région du cortex cellulaire, en particulier ceux riches en tubuline tyrosinée (Fidgetin regulates cultured astrocyte migration by severing tyrosinated microtubules at the leading edge 2017).
a. Elle fragmente ces microtubules jeunes pour maintenir des fibres courtes, rectilignes et perpendiculaires à la membrane.
Cette condition est indispensable aux cycles protrusion-rétraction et à l’ajustement mécanique du cortex et au guidage polarisé indispensables au déplacement cellulaire.
b. Ce renouvellement rapide évite l’accumulation de microtubules trop longs qui rigidifieraient le cortex et empêcheraient son remodelage.
- En absence de fidgetin, les microtubules labiles s’allongent et se courbent parallèlement à la membrane sous l’action de la kinésine-12 : la protrusion se bloque, la polarité se perd et la migration chute fortement.
- Lorsque la kinésine-12 est codéplétée avec fidgetin, la contrainte de glissement (kinésine-12 + myosine-IIB) disparaît et la migration est partiellement restaurée, confirmant le rôle mécanique local de fidgetin.
3. Elle élimine les segments mal intégrés ou peu modifiés, prévenant :
- l’accumulation de faisceaux désordonnés,
- le durcissement interne du réseau.
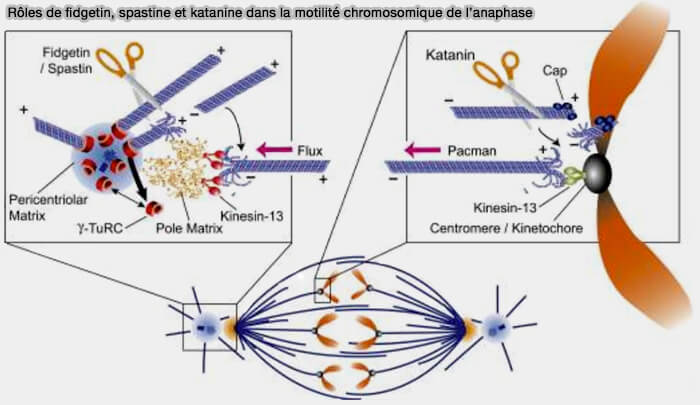
4. Au centrosome, fidgetin intervient sur des microtubules moins modifiés laissés " intacts " par la katanine, dont elle complète l'action en assurant (Three microtubule severing enzymes contribute to the “Pacman-flux” machinery that moves chromosomes 2007) :
- la redistribution des microtubules matures,
- le dégagement de segments pour le renouvellement,
- l’ajustement de la densité autour du matériel péricentriolaire.
Katanine
Structure
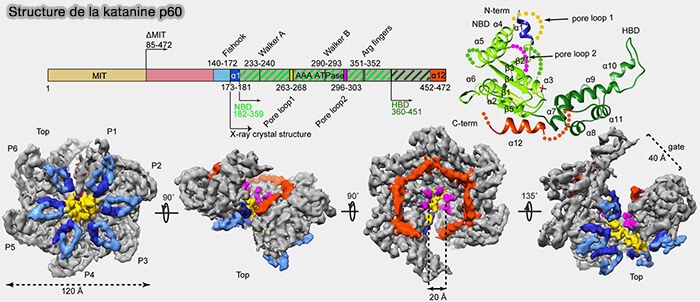
La katanine est un hétérodimère constitué par deux sous-unités (Structural basis of katanin p60:p80 complex formation 2017).
(Figure : vetopsy.fr d'après Zehr et coll)
1. p60 (KATNA1) est la sous-unité catalytique qui comprend plusieurs domaines.
a. Le domaine N-terminal (WD-repeat-like) est impliqué dans :
- le ciblage de certains compartiments,
- la reconnaissance de microtubules modifiés, par exemple par .
b. Les domaines centraux de régulation sont responsables de :
- l’interaction avec p80,
- la modulation de l’activité en fonction du contexte cellulaire.
c. Le domaine AAA+ C-terminal est le moteur catalytique assurant l’extraction mécanique des dimères d'αβ-tubuline.
2. p80 (KATNB1) est la sous-unité régulatrice.

(Figure : vetopsy.fr d'après Beaumale et coll)
a. Le domaine WD-repeat est une large plateforme de reconnaissance permettant le recrutement de katanine à des sites précis tels que le centrosome, les axones et les régions de tension.
- Chez C. elegans, MEI-2/p80 contiendrait deux MTBD, patchs basiques, pour la reconnaissance des microtubules (Microtubule-binding domains in Katanin p80 subunit are essential for severing activity in C. elegans 2024).
- Chez l'homme et d'autres animaux, plusieurs études indiquent que la liaison aux microtubules ne dépend pas de la seule sous-unité p60 (catalytique), mais de l’association p60-p80 (Structural and Molecular Basis for Katanin-Mediated Severing of Glutamylated Microtubules 2019).
b. P80 sert d’adaptateur qui :
- la stabilisation structurale de p60, indispensable à la formation d’un hexamère actif,
- le ciblage spatial du complexe, via son domaine WD porteur des MTBD,
- la modulation de l’activité de coupure, en fonction du contexte cellulaire, de la mécanique locale ou de l’état du cycle.
Rôles de la katanine
La katanine cible préférentiellement les microtubules fortement polyglutamylés ou soumis à tension mécanique, jouant un rôle majeur dans les remaniements rapides.
1. Elle détache les microtubules nouvellement nucléés (" severing-release ") du matériel péricentriolaire, ce qui :
- renouvelle le réseau radial,
- permet leur dispersion dans le cytoplasme en interphase et en entrée de mitose (transition G2/M).
2. Elle remodèle le fuseau mitotique pour assurer son architecture et son rééquilibrage mécanique permanent en :
- raccourcissant les microtubules interpolaires,
- réglant finement la tension entre pôles et kinétochores,
- éliminant localement de segments trop rigides.
3. Dans les neurones, elle a un rôle clé dans la mise en place et le remodelage rapide des réseaux dendritiques en :
- générant des extrémités utiles au renouvellement interne,
- évitant l’encombrement de faisceaux trop rigides,
- soutenant la croissance et la plasticité axonale.
Retour à la fission des microtubules
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


