Constituants cellulaires
Cytosquelette : microtubules
Fission : spastine
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La spastine est une ATPase AAA+ qui fragmente les microtubules et coordonne leur remodelage avec la dynamique des membranes endosomales et du réticulum endoplasmique.
La spastine occupe une position singulière parmi les AATPAse AAA+ en combinant fission microtubulaire et remodelage membranaire.
Sa capacité à agir aux interfaces réticulum-endosomes-lysosomes, aux gouttelettes lipidiques (LD) et dans les faisceaux internes lui confère un rôle central dans l’organisation dynamique du cytosquelette.
(Figure : vetopsy.fr d'après Smart et Sharp)
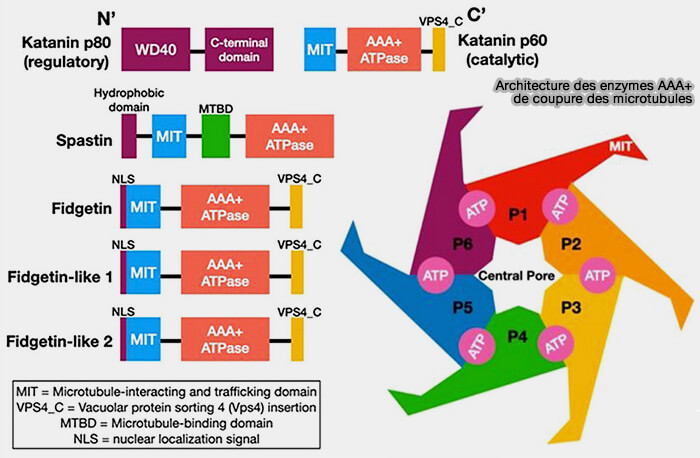
Structure de la spastine
La spastine (616 aa) appartient à la superfamille des AAA+ ATPases et forme, comme les autres enzymes de fission, des hexamères actifs capables de sectionner les microtubules.
(Figure : vetopsy.fr d'après Jardin)
Son rôle canonique est la fragmentation du lattice microtubulaire, mais l'isoforme longue M1 possède un motif hydrophobe N-terminal qui cible spécifiquement les gouttelettes lipidiques (
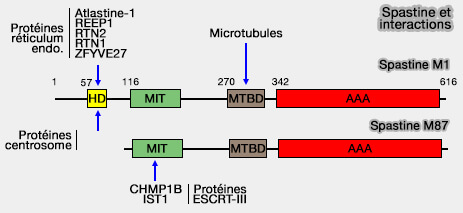
La spastine est composée de plusieurs domaines (Rôle de la spastine dans le développement des circuits moteurs et leur dégénérescence dans les paraplégies spastiques héréditaires 2016).
1. Le domaine transmembranaire (HD ou Hairpin Domain), i.e. résidu 57-79, est très hydrophobe.
- Il adopte une conformation en épingle à cheveux permettant l’insertion dans la membrane du réticulum endoplasmique (RE).
- Il interagit avec l'atlastine-1 ou REEP1, contribuant au façonnage du RE et à la localisation membranaire de l’isoforme M1.
(Figure : vetopsy.fr d'après Huxley et Yang)
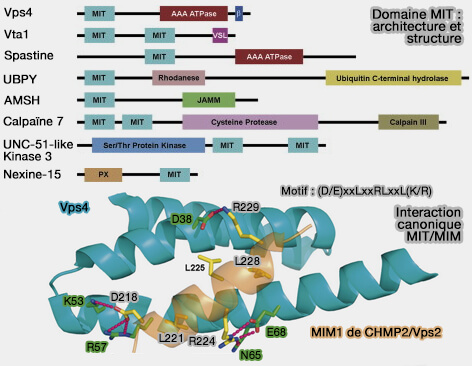
2. Le domaine MIT (Microtubule Interacting and Traficking protein), i.e. résidus 116-194, permet l'interaction avec le complexe ESCRT-III (Endosomal Sorting Complex Required for Transport) dans la scission des membranes endosomales pour réguler la tubulation endosomale et vésiculaire (MIT Domainia 2008).
- Le domaine MIT est retrouvé dans d'autres protéines comme la nexine 15 (SNX15) ou Vps4 impliquées dans la morphogénèse des endosomes et le trafic membranaire dans les endosomes précoces et tardifs.
- Les domaines MIT se composent d’un faisceau de trois hélices qui interagissent avec de nombreux partenaires protéiques via plusieurs interfaces, i.e. en particulier avec les protéines à domaine MIM ou Mit Interaction Motif (
interactions MIT/MIM des CHMP de ESCRT-III).
3. Le domaine MTBD (MicroTubule Binding Domain), i.e. résidus 270 à 328, est nécessaire et suffisant à sa liaison avec les microtubules et ce, indépendamment de l'ATP.
4. Le domaine AAA+ C-terminal (résidus 342-599) est un domaine AAA+ canonique, responsable de l’activité de dépliage et d’extraction mécanique des dimères d'αβ-tubuline (
Rôles de la spastine
La spastine sectionne efficacement les microtubules et intervient à l’interface cytosquelette-membranes grâce à ses domaines HD et MIT.
Elle se distingue par sa capacité à coordonner fission microtubulaire et remodelage endosomal.
1. Elle participe au remodelage aux interfaces membranaires.
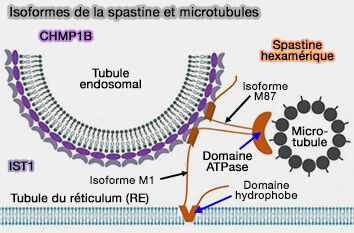
(Figure : vetopsy.fr d'après Allison et coll)
a. Son isoforme M1 cible :
- les gouttelettes lipidiques (LD),
- le réticulum endoplasmique (RE),
- les contacts RE-endosomes-lysosomes en particulier dans des zones périnucléaires riches en trafic membranaire.
b. Dans ces zones, elle :
- fragmente les microtubules ancrés ou apposés aux membranes,
- adapte la tension et l’espacement locaux,
- facilite le repositionnement d'organites par l’accès des moteurs moléculaires.
2. Elle contribue aux dynamiques endosomales via ESCRT-III grâce à son domaine MIT, en :
- interagissant avec les sous-unités CHMP,
- en synchronisant la fission microtubulaire avec la scission des tubules endosomaux,
- en influençant la morphologie des endosomes précoces et tardifs pour influencer le tri et le trafic (
fission des endosomes).
3. Elle réorganise le cytosquelette lors de forte dynamique.
a. La spastine est particulièrement active dans des régions nécessitant un remodelage rapide, i.e. zone juxtanucléaire, routes de trafic endosomal, intersections de faisceaux microtubulaires en :
- élimine des segments encombrants ou mal orientés,
- crée des extrémités de croissance pour réinjecter de la dynamique,
- facilite la redistribution d’organites (appareil de Golgi, endosomes, peroxysomes).
b. Son action est plus " polyvalente " et moins dépendante des modifications post-traductionnelles (PTM) de la tubuline que celle de katanine.
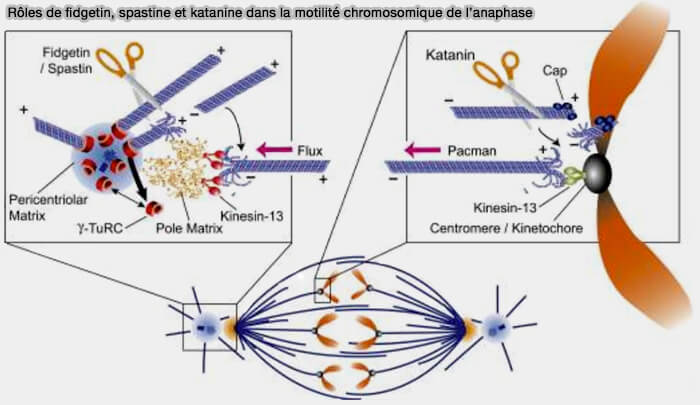
(Figure : vetopsy.fr d'après Zhang et coll)
4. Elle ajuste et renouvelle des faisceaux microtubulaires dans les cellules postmitotiques, agtssant donc comme un mécanisme d’entretien structurel, assurant la fluidité du réseau, en particulier dans les neurones, en :
- régénère des zones centrales trop rigides,
- fragmente des microtubules vieillissants ou encombrants,
- facilite la perméabilité du faisceau pour les organites,
- participe à la reconstruction des voies internes de transport.
Retour à la fission des microtubules
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


