Constituants cellulaires
Cytosquelette : microtubules
Tubuline : isoformes et modifications post-traductionnelles (PTM)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les isoformes de tubuline et leurs modifications post-traductionnelles ajustent finement la dynamique, la stabilité et la reconnaissance des microtubules par les MAP et les moteurs.
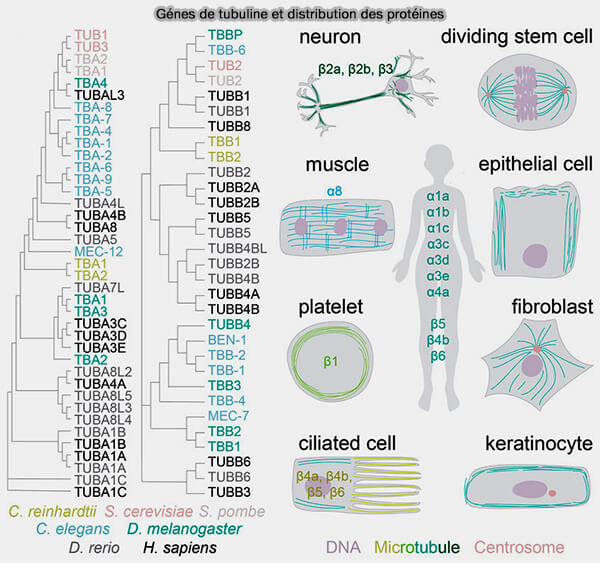
Variants et isoformes de la tubuline
La diversité des tubulines reflète des spécialisations structurales et fonctionnelles adaptées aux différents contextes cellulaires, notamment la dynamique des microtubules, leur nucléation et l’architecture des centrioles et des centrosomes.

Vous pouvez lire : The Isotypes of a, ß and ? Tubulin: From Evolutionary Origins to Roles in Metazoan Development and Ligand Binding Differences (2023) qui comprend 13 aricles diffrénts.
1. Les tubulines α et β existent chacune en plusieurs isoformes, i.e. gènes 9 TUBA et 9 TUBB exprimées chez l'homme, différant par quelques substitutions d’acides aminés, notamment dans les régions exposées et les extrémités C-terminales (Cryo-EM of α-tubulin isotype-containing microtubules revealed a contracted structure of α4A/β2A microtubules 2023).
a. Ces différentes isoformes modulent :
- la vitesse d’assemblage et de désassemblage, en modifiant l’affinité longitudinale ou la fréquence des transitions catastrophe/sauvetage, comme la tubuline β2B, dont la cinétique de polymérisation est plus rapide dans les neurones en croissance,
- la stabilité du lattice, en favorisant un lattice plus droit (GTP-like) ou au contraire plus contracté (GDP-like), comme la tubuline α1A, associée à des microtubules plus rigides dans les cellules épithéliales,
- la sensibilité aux MAP et aux modifications post-traductionnelles, notamment aux protéines EB, tau, MAP2 ou MAP4, via des différences d’accessibilité des boucles latérales, comme la tubuline β3, dont la queue C-terminale favorise un recrutement préférentiel de MAP neuronales,
- la réponse mécanique des protofilaments, en modulant la propension à la courbure ou à la déformation sous charge, comme la tubuline β5, plus flexible et favorisant une réponse dynamique lors des réarrangements rapides du fuseau mitotique.
(Figure : vetopsy.fr d'après Gasic)
b. Certaines isoformes sont enrichies dans des contextes tissulaires spécifiquse.
- Les tubulines β2, β3 sont enrichies dans les neurones, où elles soutiennent la croissance axonale et la stabilité à long terme.
- D’autres isoformes sont caractéristiques des cellules épithéliales, où elles influencent l’organisation apico-basale et la polarité, comme la tubuline α1A, fortement exprimée dans les microtubules corticaux.
- Des isoformes de tubuline α1 et β5 sont associées aux cellules à division rapide, soutenant un fuseau plus dynamique., comme dans les progéniteurs hématopoïétiques ou les cellules tumorales prolifératives.
2. La γ-tubuline forme l’anneau γ-TuSC qui constitue l’unité minimale contenant la γ-tubuline, mais ce n’est qu’une fois assemblé avec les GCP4/5/6 pour former l'anneau γ-TuRC que le complexe acquiert sa structure annulaire complète et son efficacité de nucléation (
3. Les tubulines δ et ε, absentes des es microtubules cytoplasmiques classiques, sont localisées au centriole, où elles interviennent dans :
- l’organisation de la paroi triplet du centriole, en particulier à la formation et à la stabilisation des tubules B et C incomplets.
- la stabilisation des microtubules A-, B- et C-triplets,
- la mise en place de la géométrie radiale à neuf triplets du centriole,
- la coordination avec les mécanismes de duplication centriolaire.
Remarque : elles ne remplacent pas l'α/β-tubuline qui constitue majoritairemen les ttubule A/B/C.
Le tableau regroupe les isoformes réellement étudiées et pertinentes pour la dynamique microtubulaire. Les isoformes avec rôle peu clair (TUBA3E…), ou peu exprimées, ont été exclues pour garder la lisibilité.
| Gène / Isoforme | Distribution dominante | Caractéristiques fonctionnelles clés |
|---|---|---|
| TUBA1A (α1A) |
Ubiquitaire, enrichie épithéliums |
|
| TUBA1B (α1B) |
Ubiquitaire |
|
| TUBA1C (α1C) |
Système nerveux |
|
| TUBA3C/3D | Tissus variés |
|
| TUBA4A | Neurones moteurs |
|
| TUBA8 |
|
|
| TUBB2A/2B | Neurones en développement |
|
| TUBB3 (β3) |
|
|
| TUBB4A |
|
|
| TUBB4B |
|
|
| TUBB5 | Tissus en division rapide |
|
| TUBB6 |
|
|
| TUBB1 |
|
|
Modifications post-traductionnelles (PTM) de la tubuline
Les queues C-terminales de la tubuline, riches en résidus acides et particulièrement exposées à la surface du microtubule, constituent un support central de modifications post-traductionnelles (PTM).
Ces PTM ajustent sélectivement l’interaction avec les moteurs moléculaires, les MAP et les enzymes de remodelage du cytosquelette, donnant naissance au concept de code des tubulines (The Tubulin Code in Microtubule Dynamics and Information Encoding 2021).
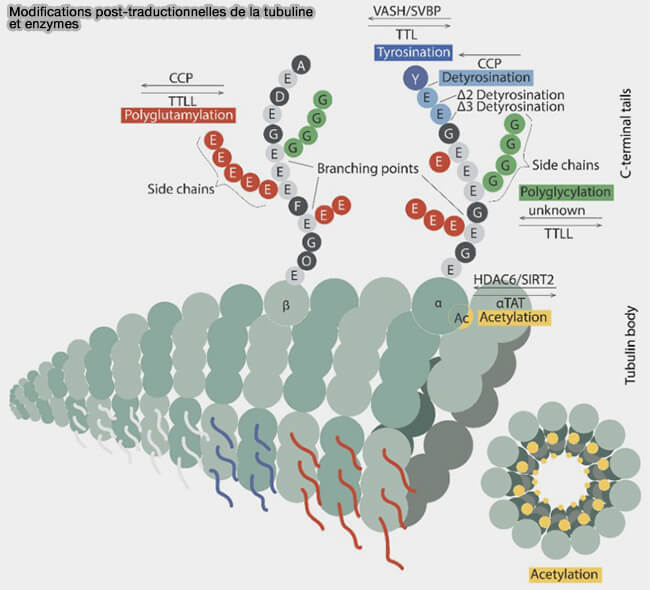
(Figure : vetopsy.fr d'après Bieniussa et coll)
Tyrosination/détyrosination
La tyrosination/détyrosination constitue un cycle dynamique qui module l’affinité des moteurs (Microtubule and auditory function - an underestimated connection 2023)
1. Ce cycle module l’affinité des moteurs moléculaires, car la présence ou l’absence de la tyrosine modifie la charge et la conformation locale des E-hooks, régions essentielles pour l’interaction initiale des kinésines et de la dynéine avec le lattice.
- Les microtubules tyrosinés favorisent le recrutement de moteurs impliqués dans le transport rapide, comme la dynéine, kinésine-3 et la kinésine-1.
- Les microtubules détyrosinés sont mieux reconnus par des complexes moteurs spécialisés dans les déplacements prolongés ou dans l’ancrage cortical comme la dynéine corticale, la kinésine-12 dans le fuseau mitotique et les moteurs ciliaires.
2. Il influence le trafic axonal et les réponses mécaniques, en orientant chaque type de moteur vers des domaines précis.
- Les segments tyrosinés sont privilégiés pour le transport directionnel dynamique, i.e. microtubules jeunes.
- Les segments detyrosinés, caractéristiques de microtubules plus âgés et durables, soutiennent des interactions prolongées avec les moteurs, notamment la dynéine corticale, permettant des déplacements persistants ou la génération de forces stabilisatrices au cortex cellulaire.
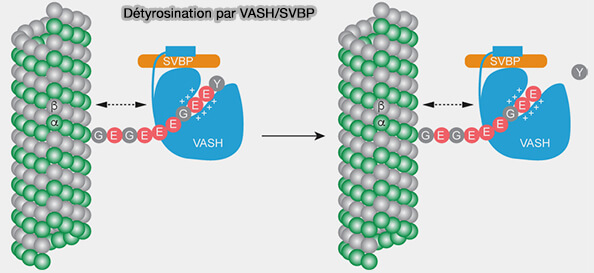
(Figure : vetopsy.fr d'après Li et coll)
3. Les microtubules tyrosinés par la TTL (Tubulin Tyrosine Ligase) sont généralement plus dynamiques, tandis que les microtubules détyrosinés, TCP/Vasohibins + SVBP, marquent des domaines plus stables.
- La tyrosination est effectuéee la TTL (Tubulin Tyrosine Ligase), EC 6.3.2.25 (Tubulin-Tyrosine Ligase 2025).
- La détyrosinaytion est le fait de VASH1/VASH2 (Vasohibin-1/Vasohibin-2), complexés à SVBP (Small Vasohibin Binding Protein) qui stabilise et active VASH1/2 (VASH1-SVBP and VASH2-SVBP generate different detyrosination profiles on microtubules 2022 et Structural basis of tubulin detyrosination by vasohibins 2019).
Remarque : MATCAP (Microtubule-Associated Tubulin Carboxypeptidase) détaches la tyrosine terminale dans certains types cellulaires comme les tissus épithéliaux (intestin, épiderme), les macrophages, les cellules sensibles aux remodelages rapides du cytosquelette comme certaines lignées tumorales (Posttranslational modification of microtubules by the MATCAP detyrosinase 2022 et MATCAP1 preferentially binds an expanded tubulin conformation to generate detyrosinated and ΔC2 α-tubulin 2025)
Acétylation
L'acétylation, ajoue d'un groupe acétyle (-C(=O)-CH3), favorise la flexibilité des microtubules stables (The α-tubulin acetyltransferase ATAT1: structure, cellular functions, and its emerging role in human diseases 2024).
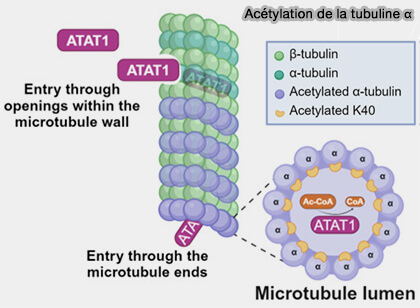
(Figure : vetopsy.fr d'après Iuzzolino et coll)
1. La lysine 40 de l’α-tubuline, acétylée par par αTAT1 (α-Tubulin Acétyltransférase 1), EC 23.1.108, profondément enfouie dans la lumière du microtubule :
- augmente la résilience mécanique du polymère,
- favorise la flexibilité contrôlée des microtubules durables comme les axones ou les cils,
- stabilise les fibres confrontées à des contraintes répétées.
2. L'acétylation est fortement associée aux microtubules longue durée.
Dans certains cas, elle permet le sauvatage des MT.
Remarque : les décacétylases retirent le groupement acétyle de la lysine 40 de l’α-tubuline, modulant ainsi la stabilité et la longévité des microtubules.
- HDAC6 (Histone DeACetylase 6) est la désacétylase cytosolique majeure, favorisant le renouvellement du réseau.
- SIRT2 (Sirtuine-2) est une désacétylase NAD+-dépendante agissant surtout en mitose.
Polyglutamylation et polyglycylation
La polyglutamylation et polyglycylation influençant l’activité des enzymes de coupure AAA+ (Structural basis for α-tubulin-specific and modification state-dependent glutamylation 2024).
1. Ces modifications étendent les chaînes latérales des E-hooks et :
- modulent la reconnaissance par les enzymes de coupure AAA+,
- ajustent la sensibilité du lattice à la fragmentation,
- influencent la distribution et l’activité des MAP spécialisées, comme les protéines ciliaires.
2. Une polyglutamylation excessive renforce l’activité des AAA+, favorisant un renouvellement rapide du réseau.
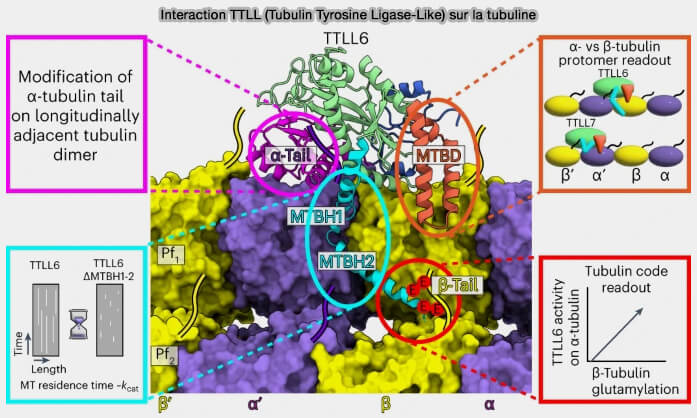
(Figure : vetopsy.fr d'après Mahalingan et coll)
3. Les TTLL (Tubulin Tyrosine Ligase-Like), ajoutent :
- des chaînes glutamate sur les E-hooks, i.e. TTLL4, TTLL5, TTLL6 et TTL7, cette dernière peut allonger fortement les chaînes (Multivalent Microtubule Recognition by Tubulin Tyrosine Ligase-like Family Glutamylases 2015),
- des résidus glycine, particulièrement dans les cils et flagelles, comme TTLL3, et TTLL8 (Crystal structure of tubulin tyrosine ligase-like 3 reveals essential architectural elements unique to tubulin monoglycylases 2017)
4. Les CCP (Cytosolic Carboxypeptidases 1-6) raccourcissent ou retirent les chaînes glutamylées et glycylées (The cytosolic carboxypeptidases CCP2 and CCP3 catalyze posttranslational removal of acidic amino acids 2014 et Comparison of the Enzymatic and Functional Properties of Three Cytosolic Carboxypeptidase Family Members 2015).
Retour vers les microtubules
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


