Constituants cellulaires
Cytosquelette : microtubules
Centrioles : duplication et rôles
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La duplication contrôlée du centriole garantit ses rôles essentiels dans l’organisation du fuseau, la nucléation microtubulaire et la ciliogenèse, dont la perturbation conduit à diverses pathologies.
Le centriole joue un rôle déterminant dans (
- l’organisation du fuseau mitotique,
- la dynamique microtubulaire,
- la formation du cil primaire.
Sa duplication s’effectue une fois par cycle selon une séquence hiérarchisée garantissant le contrôle strict du nombre de centrioles.
Toute perturbation de ce processus peut entraîner des anomalies de division, des défauts de ciliogenèse ou diverses pathologies humaines (
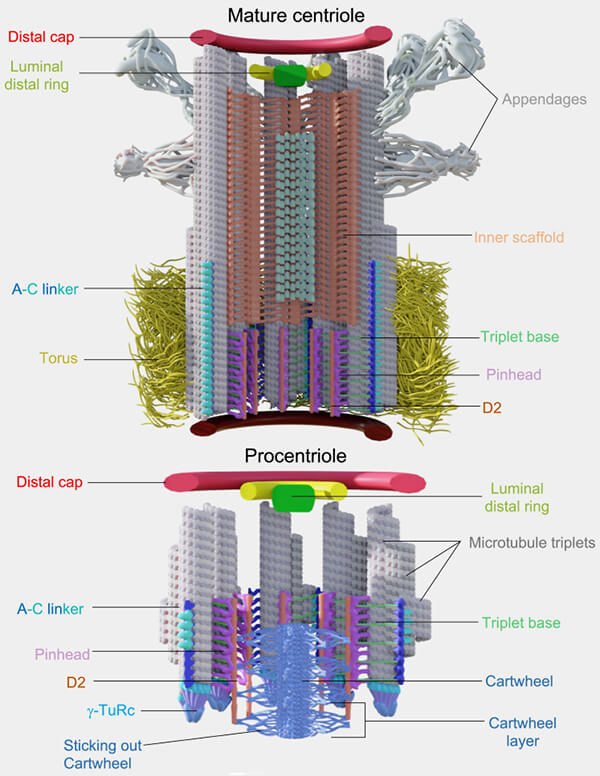
Duplication du centriole : centrioles mère/fille

Vous pouvez lire : With Age Comes Maturity: Biochemical and Structural Transformation of a Human Centriole in the Making (2020) et Time-series reconstruction of the molecular architecture of human centriole assembly (2021).
Duplication du centriole
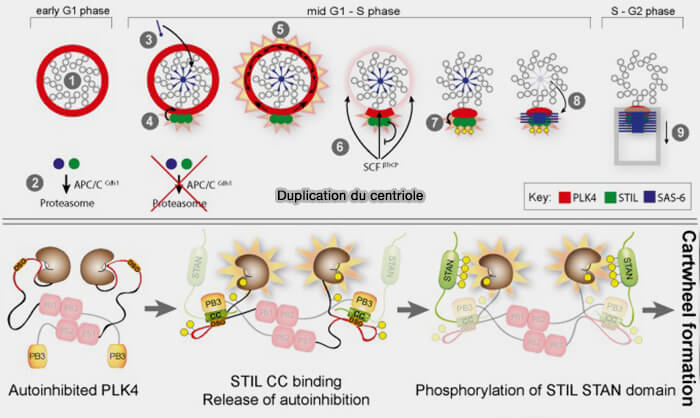
La duplication du centriole est strictement limitée à une seule occurrence par cycle cellulaire.
En fin de G1, chaque centriole existant est licencié pour initier la formation d’un unique procentriole durant la phase S, garantissant une duplication contrôlée et empêchant les excès de nombre.
(Figure : vetopsy.fr d'après Laporte et coll)
1. L’entrée en phase S s’accompagne d’une activation du complexe cycline E/CDK2 qui favorise la stabilisation de PLK4 (Polo-Like Kinase 4) au niveau du centriole mère, en renforçant son ancrage sur la couronne proximale via CEP152 et CEP192, qui constituent la plateforme de recrutement indispensable à son activation et à l’initiation du procentriole (Centriole assembly at a glance 2019).
(Figure : vetopsy.fr d'après Arquint et Nigg)
- Cette stabilisation dépend du maintien de PLK4 dans sa forme active, dont le domaine catalytique (CAT) constitue le cœur enzymatique responsable de la phosphorylation de ses substrats.
- Le complexe cycline E/CDK2, en inhibant la dégradation de PLK4 par le complexe SCFβ-TrCP, permet son accumulation pour établir le point de départ de la duplication.
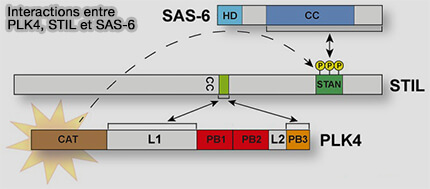
2. Une fois stabilisé, PLK4 phosphoryle STIL (The PLK4-STIL-SAS-6 module at the core of centriole duplication 2016).
a. STIL (SCL/SCL/TAL1 Interrupting Locus, i.e. SCL, Stem Cell Leukemia) déclenche (PLK4 promotes centriole duplication by phosphorylating STIL to link the procentriole cartwheel to the microtubule wall 2019) :
- le recrutement de SAS-6, à la base du centriole mère,
- l’assemblage du cartwheel sur la paroi proximale du centriole préexistant,
- la définition de la future géométrie 9×3 du procentriole.
(Figure : vetopsy.fr d'après Sullenberger et col)
b. Cette phosphorylation et le recrutement immédiat de SAS-6 représentent la signature moléculaire de l’initiation de la duplication, marquant le passage irréversible vers la formation d’un nouveau centriole).
Allongement du
procentriole
Au fur et à mesure de la progression de la phase S, le complexe cycline A/CDK2 prend le relais de la cycline E et soutient la croissance longitudinale du procentriole, en maintenant une activité CDK compatible avec l’incorporation ordonnée de dimères d'αβ-tubuline (The ABCs of Centriole Architecture: The Form and Function of Triplet Microtubules 2018).
Élongation proprement dite
1. À partir du gabarit établi par le cartwheel, les triplets de microtubules s’allongent progressivement et cette croissance longitudinale du procentriole, repose sur une nucléation dirigée à partir du tubule A, microtubule complet (13 protofilaments) qui constitue le point de départ de l’édification du triplet.
(Figure : vetopsy.fr d'après Arquint et Nigg)
a. La pinhead agit comme surface d’initiation et elle remplace fonctionnellement le rôle du γ-TuRC.
- Elle positionne le premier dimère αβ-tubuline.
- Elle maintient l’orientation correcte du protofilament.
- Elle bloque l’extrémité (-), comme le ferait une γ-tubuline.
b. L'échafaudage luminal, i.e. POC1, POC5 et WDR90, remplace la stabilisation fournie normalement par γ-TuRC dans les microtubules canoniques en :
- consolidant la paroi interne,
- empêchant l’ouverture des protofilaments,
- guidant la courbure correcte du microtubule A.
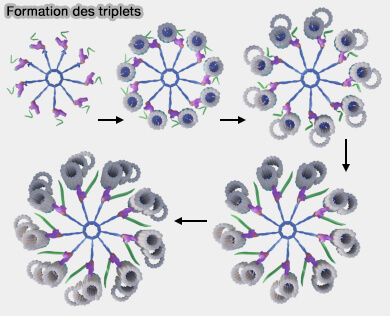
(Figure : vetopsy.fr d'après Laporte et coll)
2. Le tubule B se forme ensuite par accrochage latéral (templated growth) sur la face externe du tubule A et les dimères αβ-tubuline s’ajoutent contre la paroi latérale du tubule A :
- guidés par CEP120, qui définit le site où les dimères αβ-tubuline vont s’accrocher pour former le tubule B.
- stabilisés par SPICE1, qui s’associe à la face externe des tubules B/C, empêche l’ouverture des protofilaments et stabilise l’ajout latéral,
- soutenus par POC1, POC5 et CEP135 qui consolident la courbure interne et l’angle A-B nécessaires à la formation du microtubule incomplet.
3. La formation du tubule C suit le même principe, les dimères αβ-tubuline s’accrétant cette fois contre la paroi latérale du tubule B selon une croissance par gabarit identique.
Intégration des autres molécules
1. En outre, le complexe cycline A/CDK2 :
- intègre progressivement des facteurs structuraux tels que CEP135, CEP295, CETN2 qui renforcent l’axe central du centriole, stabilisent les jonctions A-B-C et consolident la cohésion longitudinale du cylindre en croissance,
- stabilise de l’axe 9×3 en construction, assurant que l’élongation reste strictement alignée avec la géométrie initiale définie par SAS-6 et le cartwheel.

Cette coordination étroite entre cycline A/CDK2, PLK4 et les composants structuraux garantit que la duplication reste strictement restreinte à la phase S, empêchant toute initiation aberrante en G1 (absence de PLK4 stabilisé) ou en G2 (verrouillage par l’activité CDK1).
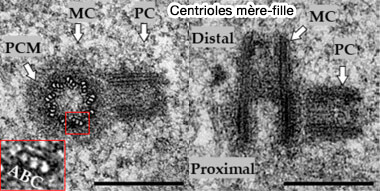
2. Le centriole présent au début du cycle devient automatiquement le centriole mère, tandis que le procentriole formé en phase S constitue le centriole fille.
- Le centriole mère est le seul à posséder les appendices distaux et subdistaux, nécessaires à l’ancrage microtubulaire et à la ciliogenèse.
- Le centriole fille, dépourvu de ces structures, ne peut pas initier une nouvelle duplication tant que sa maturation n’est pas achevée (au cours de la mitose suivante).
Maturation du centriole fille
1. Avant la mitose, la maturation précoce, intrinsèque à la duplication, a modifié le centriole fille qui a atteint une longueur quasi définitive et consolidé son architecture 9×3, mais reste immature avec (Control of centrosome distal appendages assembly and disassembly 2023) :
- l'absence d’appendices distaux et subdistaux,
- la capacité limitée à recruter le matériel péricentriolaire (PCM).
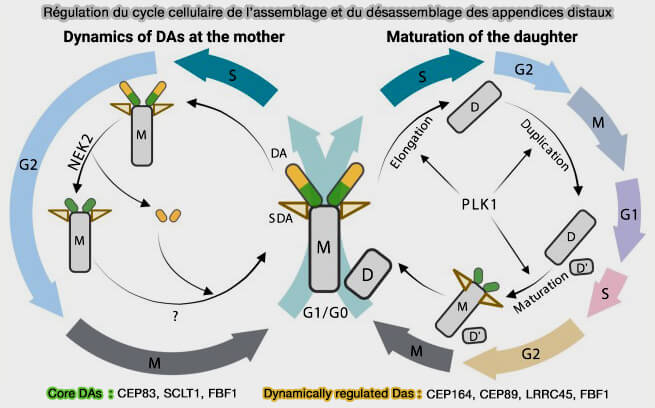
(Figure : vetopsy.fr d'après Streubel et Pereira)
2. La maturation tardive ne se produit qu’au cycle suivant, en G2 tardive puis en mitose, période durant laquelle le centriole fille acquiert les structures spécifiques qui le distinguent d’un centriole immature.
- Les appendices subdistaux, dont l’ossature repose sur la ninéine, CEP170 et un socle ODF2, assurent l’ancrage de microtubules cytoplasmiques stabilisés, participent à l’organisation du réseau interphasique et préparent la capacité du centriole à fonctionner comme pôle microtubulaire actif.
- Les appendices distaux, structurés autour de CEP164, CEP83, CEP89, FBF1 et SCLT1, forment le module d’amarrage indispensable à l’initiation de la ciliogenèse primaire, en définissant la zone où se mettra en place la membrane ciliaire émergente.
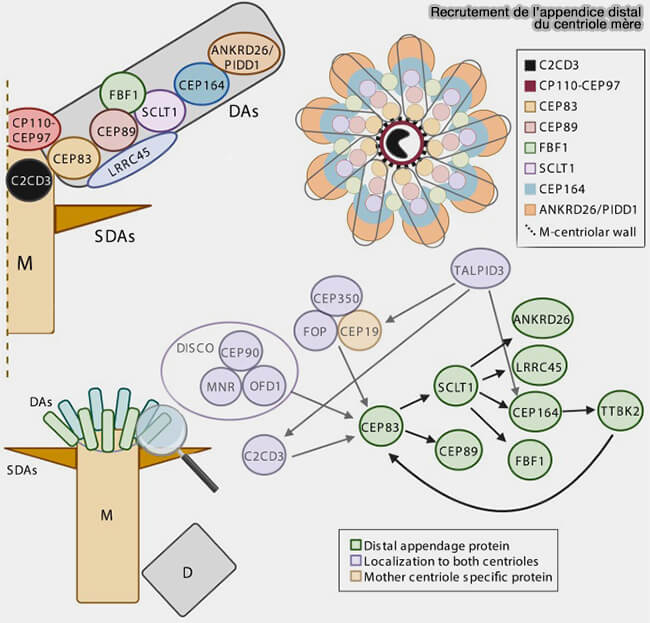
(Figure : vetopsy.fr d'après Streubel et Pereira)
3. Une fois ces éléments acquis, le centriole fille devient fonctionnellement un centriole mère, capable :
- de recruter efficacement le PCM en interphase,
- d’initier un nouveau procentriole lors du cycle suivant,
- de participer à l’ancrage des microtubules, à la stabilité du réseau microtubulaire et à la formation du cil primaire.

Cette maturation progressive constitue un verrou essentiel contre la duplication aberrante et garantit une asymétrie générationnelle stable entre les deux centrioles du centrosome.
4. En mitose, chaque pôle du fuseau reçoit une paire centriole mère + centriole fille, assurant la transmission fidèle du centrosome aux deux cellules filles.
Lien mère-fille (mother-daughter engagement)
Le lien mère-fille (mother-daughter engagement) désigne le lien structurel qui unit le centriole mère et le centriole fille nouvellement formé.
Remarque essentielle : dans les schémas, ce lien est parfois représenté sous forme de petites fibres reliant les deux centrioles. Il s’agit d’une simplification graphique, car aucune fibre réelle n’existe : le lien est exclusivement assuré par des contacts proximaux internes.
(Figure : vetopsy.fr d'après Bühler et Stolz)
1. Le lien mère-fille permet de maintenir la cohérence architecturale de la nouvelle paire centriole mère-centriole fille et de guider l’orientation du procentriole.
a. Il repose sur :
- le cartwheel (SAS-6, STIL),
- des éléments structuraux tels que CEP135 et CEP295,
- un ensemble de contacts proximaux qui stabilisent l’ancrage du centriole fille sur la face proximale du centriole mère.
b. Ces interactions moléculaires assurent la cohésion mère-fille et les " fibres " parfois dessinées dans des figures ne représentent donc pas une structure réelle mais une convention visuelle.
2. Ce lien assure également la persistance de la paire mère-fille tout au long du cycle cellulaire, en S, en G2, durant la mitose et même lors de la division cellulaire en :
- empêchant toute séparation prématurée,
- maintenant le centriole fille dans un état immature, dépourvu d’appendices distaux et subdistaux.
3. Ce n’est qu’au cours de G1 du cycle suivant que le centriole fille achève sa maturation et acquiert l’identité fonctionnelle d’un centriole mère, devenant alors capable d’initier à son tour une nouvelle duplication (
Remarque : ce lien interne est distinct du lien qui unit les deux centrioles mères du centrosome, lequel doit être rompu en G2/M pour permettre la formation des deux pôles du fuseau (
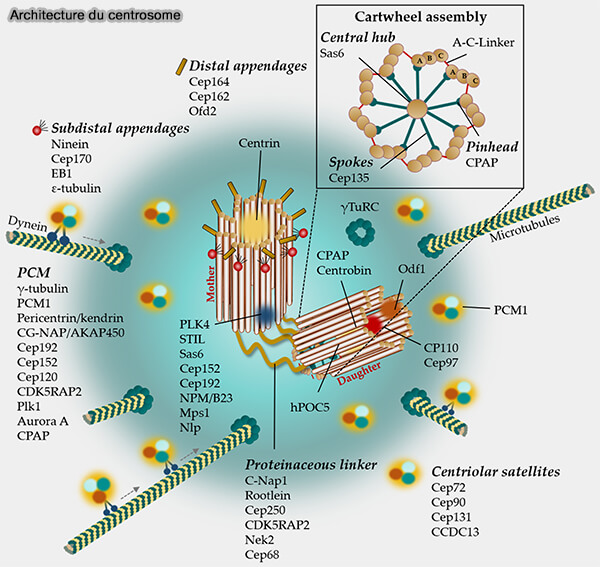
Rôle fonctionnel du centriole
1. Le centriole constitue l’élément structurant autour duquel se met en place le matériel péricentriolaire (PCM).
- Il fournit le gabarit géométrique permettant l’organisation du PCM,
- Il conditionne la localisation des complexes γ-TuRC,
- Il permet au centrosome de devenir le principal MTOC (MicroTubule-Organizing Center) de la cellule animale.
Les fonctions liées à la nucléation des microtubules, à la polarité intracellulaire et à la formation du fuseau relèvent ensuite du centrosome.
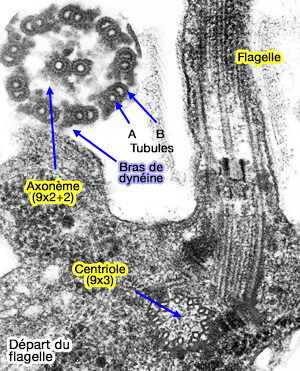
(Figure : vetopsy.fr)
2. Seul le centriole mère, du fait de ses appendices distaux, peut servir de corps basal et initier la ciliogenèse primaire ou la formation de cils mobiles (
a. Il assure :
- l’ancrage de la membrane au niveau de la zone de transition,
- l’amarrage des vésicules distales,
- l’établissement du gabarit d’axonème permettant d’organiser les doublets microtubulaires caractéristiques des cils.
b. Cette fonction est perdue en cas de défaut des appendices distaux, conduisant à une interruption de la ciliogenèse.
3. La position et l’orientation du couple centriolaire influencent directement (
- la séparation des pôles du fuseau en entrée de mitose,
- l’orientation du plan de division, particulièrement critique dans les tissus épithéliaux,
- l’héritage asymétrique dans certaines cellules souches, où la centriole mère est préférentiellement transmise à une des cellules filles.
Pathologies associées au centriole
Des altérations touchant la structure, la duplication ou la maturation du centriole compromettent ses fonctions essentielles et sont responsables de nombreuses pathologies humaines (Once and only once: mechanisms of centriole duplication and their deregulation in disease 2018).
1. Les défauts de duplication, en particulier l’amplification des centrioles, perturbent la génération normale du couple mère-fille.
Une production excessive, souvent liée à une suractivation de PLK4, mais aussi à STIL, SAS-6, CEP135, conduit à la formation de fuseaux multipolaires et favorise une instabilité chromosomique, étape fréquente dans la tumorigenèse.
Les mutations STIL ou CEP135 sont responsables de microcéphalies primaires chez l’humain.
2. Les perturbations de la maturation tardive du centriole (appendices distaux ou subdistaux défectueux, anomalies de CEP164 ou de la ninéine) compromettent l’initiation de la ciliogenèse.

La liste des principales ciliopathies est présentée dans le chapitre sur le rôle des INSPE/pharbine.
Centrosome
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


