Constituants cellulaires
Cytosquelette : microtubules
Centrosome : rôles
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le centrosome, constitué d’une paire de centrioles entourée d’un PCM riche en facteurs de nucléation, organise les microtubules, module le réseau d’actine et pilote l’orientation ainsi que la dynamique du fuseau mitotique.
Le centrosome n’est pas seulement une structure d’organisation microtubulaire, mais il constitue une véritable plateforme fonctionnelle capable :
- d’intégrer des signaux,
- de remodeler le cytosquelette,
- d’orienter la dynamique cellulaire tout au long du cycle.
Ses rôles dépassent largement la nucléation des microtubules en :
- pilotant la polarité et orientant la migration, en tant que MTOC (centre organisateur des microtubules),
- coordonnant la signalisation mitotique,
- modulant le réseau d'actine,
- participant au contrôle de qualité protéique.
Centrosome : centre organisateur des microtubules (MTOC)
En interphase, le centrosome constitue le MTOC (MicroTubule-Organizing Center) des cellules animales.

Les mécanismes structuraux et les étapes mitotiques sont détaillés dans structure et duplication du centrosome.
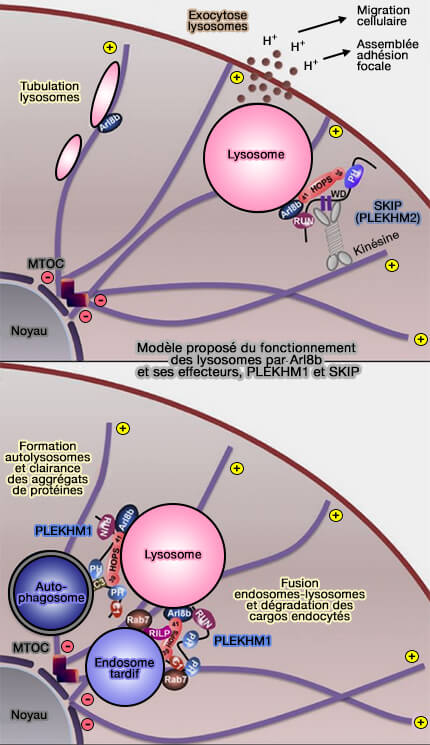
par Arl8b et PLEKHM1
(Figure : vetopsy.fr d'après Marwaha et coll)
1. Le centrosome génère un ensemble de microtubules orientés depuis leur extrémité (-) ancrée au matériel péricentriolaire (PCM) vers leur extrémité (+) dirigée vers la périphérie.
Cette organisation radiale structure l’espace cytoplasmique et fournit le support principal de la polarité et de la migration cellulaire.
2. Ce réseau permet :
- de distribuer l’espace cytoplasmique en territoires fonctionnels,
- d'orienter le transport dépendant de la dynéine vers l’extrémité (-) et des kinésines vers l’extrémité (+),
- de positionner les organites majeurs, notamment l'appareil de Golgi, qui s’organise autour du centrosome,
- d'aligner les endosomes et lysosomes selon l’axe des microtubules (
trafic des endosomes et des lysosomes).
- d'influencer la position du noyau via le complexe LINC, en couplant microtubules et enveloppe nucléaire (
couplage actine-noyau).
3. En orientant l’ensemble du réseau microtubulaire, le centrosome crée un axe directionnel stable, indispensable à la migration et à la structuration dynamique du cytosquelette.
a. Il sert ainsi de référence spatiale pour organiser le trafic membranaire et la polarité cellulaire.
b. Par exemple, dans les cellules en migration, le centrosome se repositionne en avant du noyau, sous l’effet combiné des forces corticales de la dynéine, des réarrangements locaux d’actine et du couplage mécanique assuré par le complexe LINC.
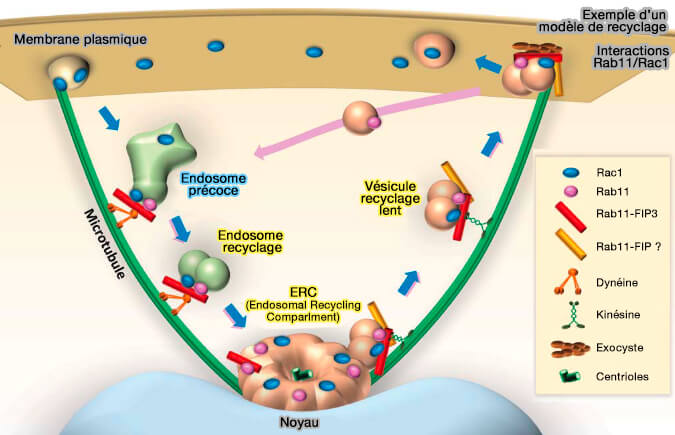
(Figure : vetopsy.fr d'après Boucher et coll)
Centrosome comme plateforme de signalisation mitotique

Le matériel péricentriolaire (PCM) n’est pas seulement une structure, mais aussi un hub de signalisation qui concentre et active les kinases mitotiques essentielles au passage G2/M et à l’assemblage du fuseau bipolaire.
Sa fonction essentielle n’est pas de produire ces signaux, mais une organisation focalisée qui permet une activation coordonnée, spatialement contrainte et temporellement précise des signaux G2/M.
1. En regroupant les principaux régulateurs mitotiques, i.e. Plk1, Aurora A et le complexe cycline B/CDK1 (MPF), au sein d’un espace restreint, le centrosome forme un point d’amplification efficient.
- Les seuils d’activation sont atteints plus rapidement.
- Les phosphorylations nécessaires à la maturation du PCM s’enchaînent de manière synchronisée.
- Les signaux sont transmis directement aux microtubules astraux, au cortex et aux pôles en formation.
2. En centralisant ces régulateurs, le centrosome impose une logique de signalisation hiérarchique :
- activation initiale des kinases,
- remodelage rapide du réseau microtubulaire,
- intégration des signaux avec le cortex, le fuseau naissant et les mécanismes de contrôle mitotique.

Les mécanismes détaillés concernant l’activation de Plk1, Aurora A et du complexe cycline B/CDK1, ainsi que leur rôle dans la maturation du PCM et la séparation des pôles, sont détaillés dans le chapitre sur la duplication du centrosome.
Centrosome et réseau d’actine
Le centrosome régule non seulement l’organisation des microtubules, mais aussi celle du réseau d’actine, en contrôlant l’assemblage péricentrosomal, la mécanique cortico-nucléaire et l’orientation cellulaire (Actin-microtubule crosstalk in cell biology 2019).
Ces fonctions, indépendantes des mécanismes de duplication, assurent l’intégration mécanique entre les différents cytosquelettes.

Vous pouvez lire : The crosstalk between microtubules, actin and membranes shapes cell division (2020).
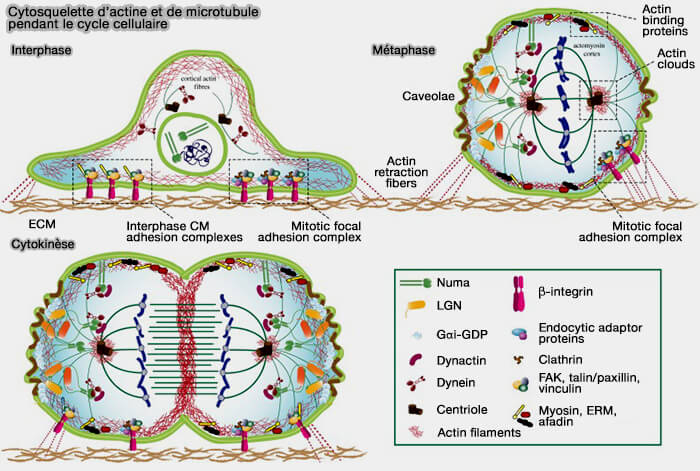
(Figure : vetopsy.fr d'après Rizelli et coll)
Organisation péricentrosomale de l’actine
Outre son rôle dans l’architecture microtubulaire, le centrosome constitue également un centre d’organisation du réseau d’actine, en concentrant plusieurs modules nucléateurs comme WASH, WAVE, et Arp2/3 dont l’activité façonne l’environnement péricentriolaire (The centrosome is an actin-organizing center 2016).
1. Le complexe WASH, et probablement dans certains contextes le complexe WAVE, sont fortement enrichis dans le matériel péricentriolaire où ils initient la formation de réseaux d’actine ramifiés (The trimeric coiled‐coil HSBP1 protein promotes WASH complex assembly at centrosomes 2018).
a. Ils agissent comme des facteurs de nucléation de l’actine ou NPF (Nucleation Promoting Factor), en coopération avec le complexe Arp2/3, pour générer des réseaux d’actine ramifiés.
HSBP1, composant trimérique coiled-coil, HSBP1 est recruté au PCM et favorise l’assemblage du complexe WASH, i.e. formation et stabilisation.
b. Le complexe WASH semble ancré au centrosome par PCM1 (Pericentriolar Material 1), protéine centrosomale enroulée, qui favorise la nucléation de réseaux d'actine ramifiés et donc l'activité de WASH (Local actin nucleation tunes centrosomal microtubule nucleation during passage through mitosis 2019).
c. WASH se lie également aux protéines centrosomales, γ-tubuline et BLOS2, une des huit sous-unités de BLOC-1, ce qui témoigne d’une intégration fine entre architecture microtubulaire et réseaux d’actine (
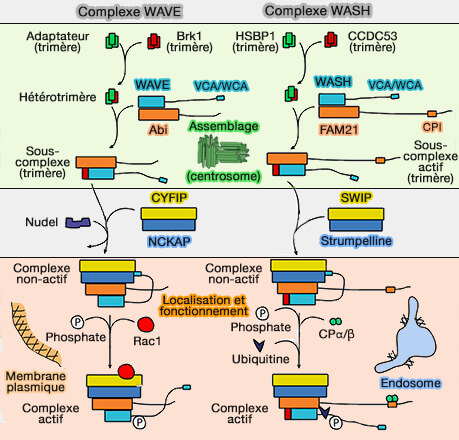
(Figure : vetopsy.fr d'après Jia et coll)
2. L'autre facteur d'assemblage, Ndel1 (Nuclear Distribution Element 1/Nde-like1), appelé aussi Nudel, joue un double rôle :
- Elle contribue à stabiliser le complexe WASH.
- Elle sert d’adaptateur pour la dynéine, facilitant le transport des cargos vers les extrémités (-) des microtubules.
Nudel s'accumule de manière constitutive au centrosome.
Couplage noyau-centrosome dépendant de l’actine
1. Le centrosome participe à la position du noyau et à la transmission des forces par l’intermédiaire du complexe LINC (Linker of Nucleoskeleton and Cytoskeleton), qui couple :
- les filaments d’actine du cortex,
- l’enveloppe nucléaire,
- la position et l’orientation du centrosome.
2. Ce couplage actine-noyau-centrosome établit un pont mécanique permettant :
- la stabilisation du noyau lors de la migration,
- l’intégration des contraintes mécaniques externes,
- l’alignement coordonné des réseaux actinique et microtubulaire selon un axe fonctionnel commun.

Le complexe LINC est étudié dans un chapitre spécifique de l'enveloppe nucléaire.
Réorganisation du réseau d’actine lors de l’entrée en mitose
Le centrosome, en orchestrant les transitions successives du réseau d’actine, assure le couplage mécanique entre le cortex cellulaire et le réseau microtubulaire tout au long de la mitose.
Cette coordination spatiotemporelle est indispensable à la séparation correcte des pôles, à la stabilité du fuseau mitotique et à la progression ordonnée de la division cellulaire.
La dynamique de l’actine est profondément remaniée à l’entrée en mitose sous le contrôle coordonné de Plk1, d'Aurora A et du complexe cycline B/CDK1 (MPF), plaçant le centrosome au cœur de l’intégration entre signalisation mitotique et réorganisation cytosquelettique.
1. À l’entrée en mitose (G2 ➞ prophase), la dynamique de l’actine change profondément sous le contrôle du centrosome (Local actin nucleation tunes centrosomal microtubule nucleation during passage through mitosis 2019).
Celui-ci contribue à :
- la déplétion du réseau actinique périnucléaire, facilitant la rupture de l’enveloppe nucléaire,
- la mise en tension du cortex, qui facilite la séparation des deux centrosomes,
- l’établissement d’un cortex d'actine plus rigide, nécessaire à la formation initiale des asters.

(Figure : vetopsy.fr d'après Plessner et Farina)
2. En prométaphase, lorsque la membrane nucléaire se fragmente, le centrosome conditionne la mise en place d’un fuseau correctement orienté en coordonnant (Centrosomal Actin Assembly Is Required for Proper Mitotic Spindle Formation and Chromosome Congression 2019) :
- la redistribution de l’actine corticale, qui stabilise les positions des pôles,
- l’ajustement des forces de traction exercées par la dynéine corticale sur les microtubules astraux.
3. En métaphase, le centrosome maintient un équilibre mécanique entre cortex et asters :
- La tension corticale homogène stabilise l’équateur.
- La dynamique actine-cortex contribue au positionnement précis de la plaque métaphasique.
- L’architecture corticale participe au maintien du fuseau dans un plan stable.
4. En anaphase, le centrosome demeure un point d’appui mécanique essentiel à la transmission de forces vers le cortex via la réorganisation du cortex actinique qui soutient :
- l’allongement du fuseau,
- la séparation des pôles,
- la traction sur les microtubules interpolaires.
5. Lors de la télophase et de a cytokinèse, le centrosome influence les derniers événements :
- en déterminant la position du plan de division, via l’équilibre des forces corticales,
- en facilitant l’assemblage de l’anneau contractile d’actine et de myosine,
- en coordonnant la fermeture finale de la cellule autour du midbody
Centrosome et contrôle de la qualité protéique
Le centrosome intervient comme un point de convergence pour l’élimination des protéines mal repliées, les complexes désassemblés ou les petits agrégats naissants (
1. Le trafic rétrograde dirigé par la dynéine dirige vers les extrémités (-) des microtubules les vésicules impliquées dans le contrôle de qualité, i.e. endosomes tardifs, autophagosomes précoces et lysosomes, dont le transport rétrograde rapproche la machinerie de dégradation de la zone péricentrosomale.
Ndel1/Nudel, fortement enrichie au centrosome, sert d’adaptateur essentiel entre ces vésicules et la dynéine, garantissant un acheminement efficace vers la zone péricentrosomale, où les cargos sont rassemblés avant traitement (Misfolded Gβ is recruited to cytoplasmic dynein by Nudel for efficient clearance 2012).
2. L’ensemble de ces flux converge dans la zone péricentrosomale, point de convergence naturel du trafic rétrograde qui agit donc comme un collecteur mécanique de tout cargo destiné à être dégradé ou trié.
a. Cette accumulation aboutit à la formation d'un agrésome (aggresome en anglais), microdomaine fonctionnel dépourvu de membrane (Aggresomes, inclusion bodies and protein aggregation 2000) :
- constitué par le regroupement centralisé des protéines anormales et des petites structures endosomales,
- entouré d’un environnement dense en chaperonnes, ligases E3 impliquées dans l'ubiquitination et protéasomes, facilitant la reconnaissance et le traitement des substrats.
b. Une fois formé, l’agrésome forme une plateforme de tri.
- Soit les protéines sont dégradées sur place par le protéasome 26S, lorsque les substrats sont solubles et accessibles.
- Soit les agrégats trop volumineux sont dirigés vers la macroautophagie.
Pathologies associées au centrosome
Les altérations du centrosome entraînent plusieurs types de perturbations cellulaires.
1. Les centrosomes surnuméraires provoquent des fuseaux multipolaires, des aneuploïdies et une forte instabilité génomique, caractéristiques de nombreux cancers.
De nombreuses tumeurs du sein triple négatif présentent une amplification marquée des centrosomes, corrélée à une agressivité accrue.
2. Les défauts de maturation du PCM affaiblissent la nucléation microtubulaire et la formation des asters, perturbent la séparation des pôles et favorisent les erreurs de ségrégation.
Les mutations de PCNT (péricentrine) entraînent des asters faibles et une séparation tardive des pôles sont associées à plusieurs pathologies humaines, notamment (Molecular analysis of Pericentrin gene (PCNT) in a series of 24 Seckel/ MOPD II families 2025) :
- le MOPD II (nanisme primordial sévère),
- des microcéphalies autosomiques récessives isolées,
- certains troubles de croissance d’origine endocrinienne
3. Les dysfonctions du contrôle de qualité péricentrosomal, i.e. dynéine-Ndel1 et agrésome, entraînent l’accumulation de protéines mal repliées, la surcharge du protéasome et une vulnérabilité cellulaire accrue.
La défaillance du transport dynéine-Ndel1 favorise la formation d’agrégats cytotoxiques observés dans plusieurs maladies neurodégénératives, notamment les maladies d'Alzheimee, de Parkinson et d'Huntington, où la clairance péricentrosomale est fortement perturbée.
4. Les anomalies de duplication des centrioles sont détaillées dans le chapitre correspondant.
Retour au centrosome ou aux microtubules
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


