Cycle cellulaire
Reproduction cellulaire : mitose
Cytokinèse : vue d'ensemble et événements cellulaires
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

La cytokinèse est la phase finale de la mitose où le sillon de clivage, l’anneau contractile et le corps central orchestrent la séparation physique des deux cellules filles.
Vue d’ensemble de la cytokinèse
La cytokinèse correspond à la phase terminale de la division cellulaire au cours de laquelle le cytoplasme est séparé en deux compartiments indépendants, spatialement et fonctionnellement coordonnés avec la fin de la ségrégation chromosomique.
Elle s’initie fonctionnellement en anaphase, sous l’influence des signaux issus du fuseau central, et se déroule principalement en télophase, avant de s’achever par l’abscission.
1. La cytokinèse ne constitue pas un événement autonome mais la continuité fonctionnelle de la sortie de mitose, rendue possible par :
- l’extinction de l’activité du complexe cycline B/CDK1 (MPF),
- la bascule vers l’APC/CCdh1,
- la redistribution spatiale des régulateurs mitotiques vers la zone médiane.
Remarque : cette phase peut aussi s'appeler aussi cytodiérèse et plus rarement cytocynèse et, conformément aux ouvrages de biologie cellulaire moderne, vetopsy.fr, la considère comme étroitement intégrée à mitose.
2. Sur le plan organisationnel, la cytokinèse comprend deux niveaux étroitement couplés mais conceptuellement distincts :
- une phase de constriction associée à l’anneau contractile et au sillon de division,
- une phase terminale d’abscission, responsable de la séparation physique définitive des deux cellules filles.

L’ensemble de ces processus converge vers une activation et une accumulation localisées de la petite GTPase RhoA au niveau du cortex équatorial, condition nécessaire à l’assemblage et à la constriction de l’anneau contractile.
Événements cellulaires de la cytokinèse
Sillon de clivage
Le sillon de clivage correspond à une invagination progressive de la membrane plasmique et du cortex sous-jacent, visible au plan équatorial de la cellule, qui marque morphologiquement le site de séparation des deux cellules filles.
1. Le sillon de clivage repose sur l’organisation progressive de la zone médiane du fuseau, mise en place durant l’anaphase B par l’assemblage des microtubules polaires en faisceaux antiparallèles, qui fournit les signaux spatiaux nécessaires à l’induction du sillon au niveau du cortex équatorial.
Le cortex équatorial désigne la région spécialisée du cortex actomyosine située sous la membrane plasmique, dans le plan équatorial de la cellule en division.
- Il correspond à la zone où convergent les signaux issus du fuseau central (notamment via le CPC, RhoA et les complexes de microtubules antiparallèles) pour déclencher l’assemblage de l’anneau contractile.
- Le cortex équatorial constitue ainsi une interface mécano-signalétique entre le fuseau mitotique et la machinerie de cytokinèse, distincte à la fois du fuseau central et du corps intermédiaire (midbody).
2. En anaphase, la relocalisation fonctionnelle et spatiale d’Aurora B au sein du complexe CPC (Aurora B-INCENP-Survivin-Borealin) vers la zone médiane du fuseau signale que la séparation des chromatides est en cours et que la division cytoplasmique peut être engagée au plan équatorial.
- La présence du CPC sur la zone médiane favorise l’accumulation du complexe centralspindlin sur le fuseau central, assurant le couplage entre l’architecture microtubulaire et le cortex équatorial.
- Cette organisation permet de restreindre le positionnement du sillon de clivage à la région équatoriale, en empêchant son initiation tant que des chromosomes ou des ponts chromosomiques persistent à proximité du plan de division, sans contribuer directement à la force de constriction.
Anneau contractile
L’anneau contractile se met en place autour du sillon de clivage pré-positionné par le fuseau, où il forme une structure d’acto-myosine capable de convertir la signalisation équatoriale en une force mécanique de constriction.
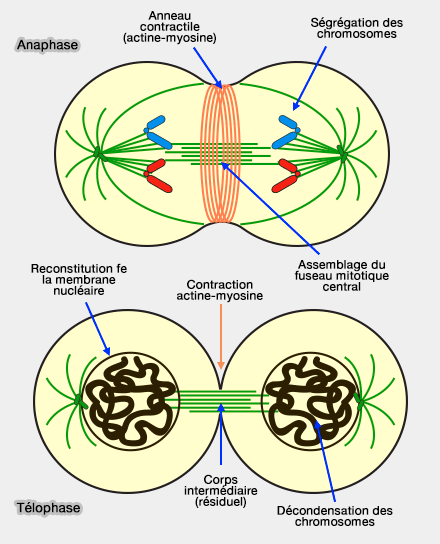
(Figure : vetopsy.fr)
L’anneau contractile est une structure caractéristique de la cytokinèse, dont l’assemblage débute en anaphase et dont la constriction se poursuit principalement en télophase.
Organisation générale
1. L'anneau contractile comporte des filaments d'actine antiparallèles concentriques de 7 nm de diamètre, entourant l’équateur cellulaire.
Les interactions entre actine et myosine II de l'anneau contractile sont à l'origine des forces mécaniques nécessaires à la constriction.
2. Le fait que cet anneau soit fixé à la membrane plasmique partage le cytoplasme parental par étranglement.
Le sillon de clivage se resserre jusqu’à former un pont intercellulaire centré sur le corps intermédiaire (midbody), structure dérivée du fuseau central et maintenue transitoirement avant l’abscission.
3. La formation et la constriction de l’anneau contractile sont déclenchées par une activation locale de RhoA, qui coordonne la polymérisation de l’actine et l’activation de la myosine II au niveau équatorial.
Assemblage et activation de l'anneau contractile
La voie RhoA active la formation de l'anneau contractile au bon endroit en coordonnant l’organisation du réseau d’actine et l’activation de la myosine II au niveau du cortex équatorial.
1. La formation du réseau d'actine est contrôlée par les formines, impliquée dans la polymérisation de filaments droits.
MgcRacGAP inhibe localement l’activité de Rac1, ce qui limite l’activation du complexe Arp2/3, et donc la formation de réseaux d’actine ramifiés, au profit de réseaux d’actine linéaires compatibles avec l’assemblage de l’anneau contractile.
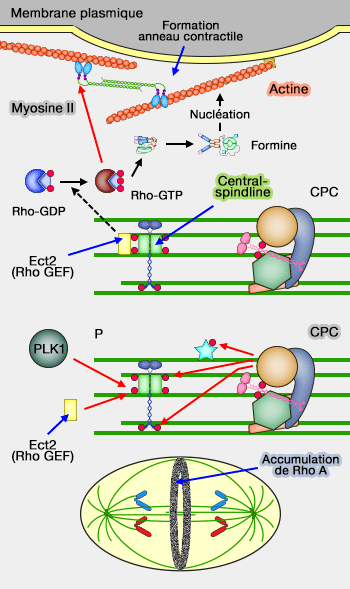
(Figure : vetopsy.fr)
a. Les formines jouent un rôle majeur dans la mise en place, le positionnement et la constriction de l'anneau contractile (Formin’ cellular structures Physiological roles of Diaphanous (Dia) in actin dynamics 2013) :
Son absence inhibe la formation de l'anneau et produit des cellules polynuclées, comme lors d'absence de myosine II.
Remarque : la formine intervienta aussi dans le cycle cellulaire en général :
- dans la séparation des centrosomes dans la transition G2/M,
- dans les attachements kinétochoriens, leur alignement et l'orientation du fuseau mitotique…
b. Comme dans toute polymérisation de l’actine, les ABP (Actin Binding Protein) régulent ce processus en contrôlant la nucléation, l’élongation, la coiffe et la fragmentation des filaments.
2. L'activation de la myosine II est nécessaire à la constriction de l'anneau.
Rho active les kinases ROCK et Citron qui favorisent le recrutement et l’activation de la myosine II (Citron kinase controls a molecular network required for midbody formation in cytokinesis 2013 et Citron kinase - renaissance of a neglected mitotic 2017).
- La phosphorylation de sa chaîne légère régulatrice de la myosine RLC induit la formation de filaments bipolaires et l’activation de son oteur moléculaire lent.
- La myosine LC phosphatase (MLCP) agit de manière antagoniste en déphosphorylant la RLC, contribuant au contrôle fin de l’intensité de la constriction.
Corps intermédiaire (midbody)
Au cours de la télophase, la zone médiane du fuseau cesse de participer à l’écartement des pôles et se stabilise en une structure dense et persistante.
Elle se transforme en corps intermédiaire (midbody), forme tardive et spécialisée de la zone médiane, qui maintient une continuité mécanique transitoire entre les deux cellules filles avant l’abscission.
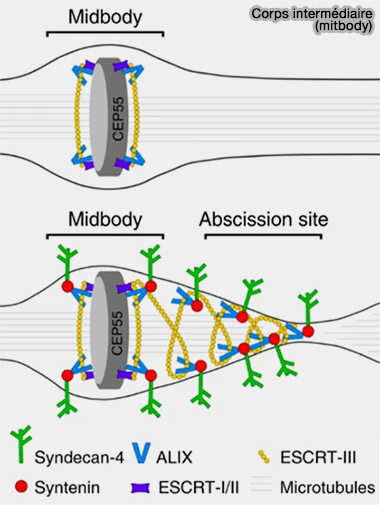
(Figure : vetopsy.fr d'après Addi, et coll)
1. Le corps intermédiaire est une structure dense composée de microtubules antiparallèles chevauchés qui persiste dans le pont intercellulaire, servant de plate-forme organisationnelle pour l’abscission (The midbody interactome reveals unexpected roles for PP1 phosphatases in cytokinesis 2019).
Cette structure renferme les protéines qui stabilisent et organisent la zone équatoriale en fin de mitose, notamment :
- Aurora B (CPC), qui coordonne temporellement la fin de la cytokinèse en maintenant transitoirement l’état pré-abscission et en empêchant une coupure prématurée tant que la séparation n’est pas correctement achevée,
- MKLP1 et MKLP2, kinésines de la zone médiane, qui participent à l’organisation du corps intermédiaire et servent de plates-formes de recrutement pour les facteurs nécessaires à la transition vers l’abscission,
- PRC1 (Protein Regulator of Cytokinesis 1) qui stabilise les microtubules antiparallèles du corps intermédiaire et contribue à la persistance structurale du pont intercellulaire jusqu’à l’étape finale (
organisation de la zone médiane).
- CEP55, marqueur clé de la cytokinèse tardive, recruté au corps intermédiaire, qui coordonne l’arrivée des complexes effecteurs de l’abscission.
2. Le corps intermédiaire joue un rôle d’interface entre la mécanique de constriction médiée par l’anneau contractile et les événements de coupure membranaire en :
- maintenant la continuité mécanique entre les deux cellules filles,
- définissant précisément l’axe et le site de la cytokinèse,
- en organisant le recrutement des complexes impliqués dans l’abscission finale.
Il constitue une plate-forme où se concentrent les signaux indispensables à l’étape finale de séparation cellulaire, notamment ceux délivrés par Aurora B et les composants du futur complexe ESCRT.
3. Cette transition marque le passage fonctionnel entre la fin de la division nucléaire et la séparation définitive du cytoplasme lors de la cytokinèse.
Ce corps intermédiaire, transitoirement maintenu entre les cellules filles, donne naissance après l’abscission à un résidu du corps intermédiaire, qui peut être éliminé ou internalisé par l’une des cellules.
Remarque : le corps résiduel (midbody remnant ou MBR) désigne la structure vestige du corps intermédiaire, devenue un débris cytoplasmique, éventuellement internalisé par l’une des cellules filles ou éliminé (The mammalian midbody and midbody remnant are assembly sites for RNA and localized translation 2023).
Dans cet article, ce sont les résidus du corps intermédiaire, et non le corps intermédiaire fonctionnel pré-abscission, qui apparaissent comme des sites d’assemblage de granules ribonucléoprotéiques (RNP), associés à une activité de traduction localisée, notamment observée dans certains contextes tumoraux..-
Régulations moléculaires de la cytokinèse et abscission
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


