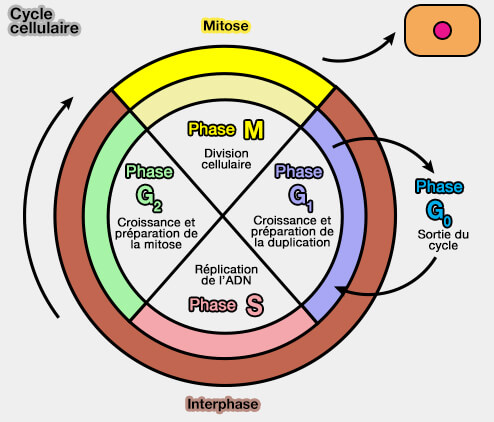
Cycle cellulaire
Quiescence (G0)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

La quiescence (G0) est un état cellulaire actif, stable et réversible, distinct des checkpoints, qui maintient la cellule hors du cycle tout en préservant sa capacité de réentrée en prolifération.
Vue d’ensemble
1. La quiescence (G0) correspond à un état cellulaire actif, dans lequel une cellule se maintient durablement hors du cycle de division tout en conservant la capacité de réentrer en prolifération en réponse à des signaux appropriés.
a. La quiescence doit être comprise comme un pont conceptuel majeur entre prolifération, spécialisation et stabilité cellulaire, qui relie directement :
- le cycle cellulaire,
- la différenciation,
- le métabolisme,
- l’environnement tissulaire,
- l’identité cellulaire.
b. Il s’agit d’un programme biologique spécifique, transcriptionnellement et fonctionnellement organisé, qui ne correspond pas à :
- un arrêt dû à un dommage,
- un blocage par checkpoint, qui correspond à un système de surveillance technique qui bloque le cycle en cas de problème biologique (ADN endommagé, attachement incorrect, réplication incomplète).
- une simple pause passive du cycle.
(Figure : vetopsy.fr d'après Zephris)
2. La quiescence s’inscrit en amont du point de restriction (R) de la phase G1.
a. Avant le point R, la cellule reste dépendante des signaux externes, et peut choisir :
- de poursuivre vers la phase S,
- ou de basculer vers l’état G0.
b. Après le point R, l’engagement dans le cycle devient autonome, l’entrée en phase S devient irréversible à court terme.
3. On distingue deux types de quiescence.
a. La quiescence dite superficielle, facilement réversible, est observée par exemple dans des cellules somatiques temporairement privées de signaux mitogènes.
b. La quiescence profonde, plus stable, caractéristique de certaines cellules souches adultes ou de cellules hautement différenciées, reflète des différences :
- d’état transcriptionnel, comme une répression durable des gènes E2F-dépendants associée à une faible expression de la cycline E et de la cycline A,
- d’organisation chromatinienne, comme un enrichissement en marques répressives (H3K27me3 dépendante de Polycomb) et une compaction accrue de la chromatine.
- de métabolisme cellulaire, comme un basculement vers un métabolisme oxydatif sobre avec diminution de la glycolyse, sous le contrôle d’AMPK et de FOXO.
- de seuil de réactivation, comme la nécessité d’un signal mitogène plus intense pour réactiver une cellule souche en quiescence profonde (ex. cellules satellites musculaires).
b. C'est un programme biologique spécifique, transcriptionnellement et fonctionnellement organisé, qui ne correspond pas :
- un arrêt dû à un dommage,
- un blocage par checkpoint,
- une simple pause passive du cycle.
Régulation moléculaire de l’état G0
1. L’état quiescent repose sur un équilibre transcriptionnel et post-traductionnel spécifique, i.e. il est donc activement maintenu, et non subi.
Plusieurs axes majeurs participent à son maintien.
- L’axe Rb/E2F, qui limite durablement l’expression des gènes de la phase S.
- Les CKI (CDK inhibitors), en particulier p21CIP1, qui maintiennent l’activité cycline/CDK à un niveau bas.
- La voie TGF-β, qui favorise l’expression d’inhibiteurs de CDK et renforce l’état non prolifératif.
- La voie Hippo (YAP/TAZ), qui couple l’adhérence, la densité cellulaire et le contexte mécanique à la décision proliférative ou quiescente.
(Figure : vetopsy.fr d'après Wang et coll)
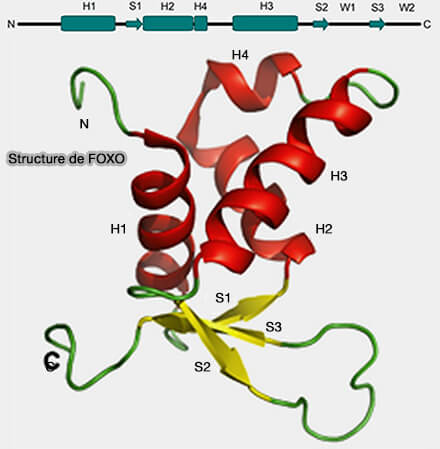
2. Parmi ces axes, les facteurs de transcription de la famille FOXO (Forkhead box O), en particulier FOXO3, avec une contribution variable de FOXO1 et FOXO4 selon le type cellulaire, occupent une position centrale dans le maintien de l’état quiescent (Forkhead followed by disordered tail: The intrinsically disordered regions of FOXO3a 2015 et Forkhead Domains of FOXO Transcription Factors Differ in both Overall Conformation and Dynamics 2019)
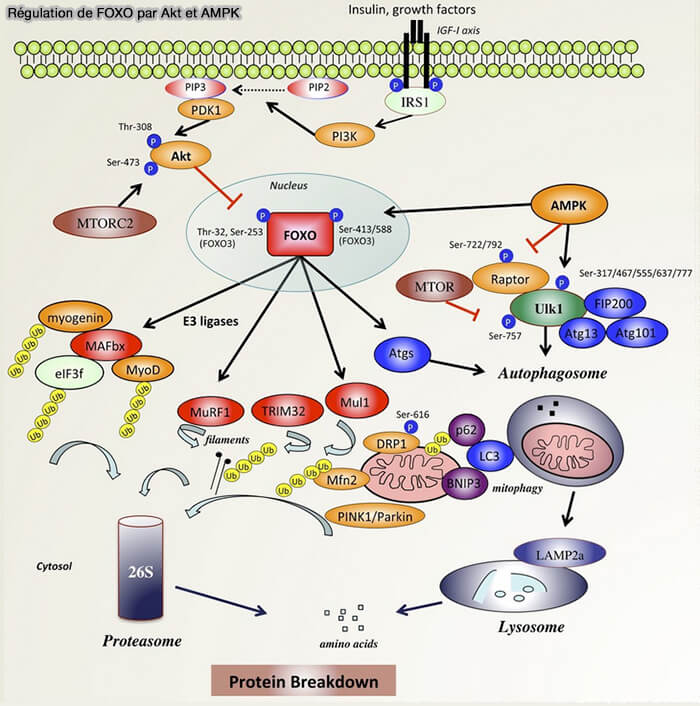
a. Leur activité est inhibée par la voie PI3K/Akt, typiquement activée par les signaux mitogènes (facteurs de croissance), qui entraîne l’exclusion nucléaire de FOXO.
b. À l’inverse, lorsque ces signaux sont faibles, FOXO reste nucléaire et induit l’expression de gènes favorisant la sortie du cycle, notamment :
- des CKI (CDK inhibitors) comme p27KIP1,
- la résistance au stress oxydatif, comme SOD2 et la catalase,
- la stabilité génomique et la réparation, comme GADD45,
- le maintien de l’homéostasie cellulaire, notamment via des gènes liés à l’autophagie et au métabolisme mitochondrial.
c. Cette activité est particulièrement importante pour le maintien de la quiescence des cellules souches et la survie à long terme des cellules non prolifératives.
(Figure : vetopsy.fr d'après Sanchez et coll)
Rôles physiologique et pathologique de la quiescence
1. La quiescence constitue un état majeur de la biologie cellulaire normale.
a. Elle est essentielle pour :
- le maintien des cellules souches adultes (réserve proliférative),
- l’homéostasie des tissus à renouvellement lent,
- la différenciation terminale de nombreux types cellulaires,
- la protection contre l’épuisement prolifératif,
- la prévention de l’accumulation d’erreurs génétiques.
b. Dans de nombreux tissus, la majorité des cellules fonctionnelles de l’organisme sont en réalité en état G0, état dans lequel se trouvent la plupart des cellules différenciées et qui peut durer plus ou moins longtemps.
- Chez l’homme, la cellule intestinale se divise environ 1 à 2 fois par jour, tandis que la cellule hépatique ne se divise qu’environ 1 à 2 fois par an.
- appelons que certaines cellules ne se divisent plus, comme la majorité des neurones (avec de rares exceptions), ainsi que les hématies et les fibres musculaires squelettiques.
2. La quiescence possède également une importance majeure en pathologie où elle intervient notamment dans :
- la cancérogenèse, lorsque les mécanismes maintenant G0 sont contournés,
- la résistance aux traitements anticancéreux, certaines cellules tumorales quiescentes échappant aux thérapies ciblant la prolifération,
- le vieillissement, avec l’altération progressive de la capacité de sortie et de retour en quiescence,
- les troubles de la régénération tissulaire.
Retour vers le cycle cellulaire
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


