Cycle cellulaire
Cyclin-Dependent Kinases (CDK)
Régulation : inhibition
CKI (CDK inhibitors) : p21, p27 et p57
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

p21, p27 et p57 sont des CKI (CDK inhibitors) exerçant des fonctions biologiques distinctes en modulant l’activité des CDK selon le contexte cellulaire, le stress, la quiescence ou le programme développemental.
Les CKI (CDK inhibitors) assurent une inhibition directe des complexes cycline/CDK et se répartissent en deux grandes familles fonctionnelles :
- la famille INK4 (Inhibitor of CDK4), comprenant p15INK4B, p16INK4A, p18INK4C, p19INK4D, qui se lient spécifiquement aux CDK4 et CDK6 et empêchent leur association avec les cyclines D,
- la famille CIP/KIP, comprenant p21CIP1, p27KIP1, p57KIP2, qui inhibent principalement les complexes cycline E/CDK2, cycline A/CDK2 et cycline B/CDK1 (MPF) par blocage du site catalytique.
La structure générale des CIP/KIP est étudiée dans le chapitre général des CKI.

Vous pouvez lire : CIP/KIP and INK4 families as hostages of oncogenic signaling (2024).
p21 (CIP1)
p21 est induite par p53 en réponse aux dommages de l’ADN, ce qui constitue le signal initial d’activation de la voie d’arrêt du cycle aux checkpoints G1/S et G2/M (Cell cycle regulation by the intrinsically disordered proteins, p21 and p27 2020).
p21 est aussi nommé p21CIP1/WAF1, p21CIP1 car elle a été identifiée comme une " CDK inhibitory protein " et p21WAF1 car elle a été décrite comme un gène induit par p53 sauvage (" wild-type p53 activated fragment ") lors de la réponse aux dommages de l’ADN.
Une fois exprimée, p21 inhibe directement plusieurs complexes cycline/CDK, en particulier les complexes cycline E/CDK2 et cycline A/CDK2, ce qui empêche l’entrée en phase S et ralentit la progression du cycle (Intrinsic disorder mediates the diverse regulatory functions of the Cdk inhibitor p21 2011).

Cette inhibition permet à la cellule de suspendre la prolifération afin de favoriser la réparation des lésions, ce qui fait de p21 un effecteur central de la réponse aux stress génotoxiques, toute situation qui endommage l’ADN de la cellule, et un stabilisateur des états d’arrêt prolongé.
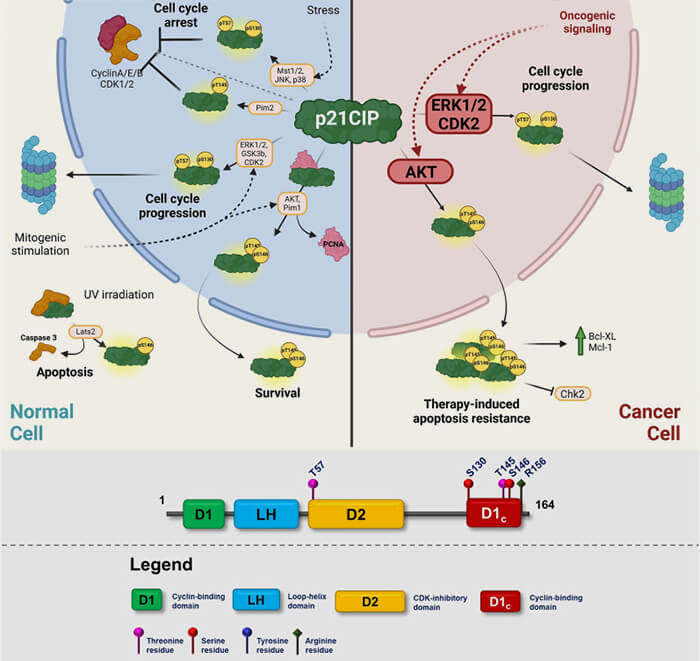
(Figure modifiée : vetopsy.fr d'après Csergeová et coll)
Intensité et durée de l'induction de p21
L’intensité et la durée de l’induction de p21 conditionnent la réponse biologique par l’intermédiaire de modifications post-traductionnelles, en particulier des phosphorylations qui modulent sa stabilité, sa localisation et sa dégradation.
1. Une induction transitoire est compatible avec un arrêt réversible suivi d’une reprise du cycle.
a. Elle est typiquement observée lors de dommages réparables, ce qui entraîne une inhibition temporaire des complexes cycline E/CDK2 et cycline A/CDK2, maintenant Rb sous forme hypophosphorylée et bloquant E2F pendant une durée limitée.
- La phosphorylation de p21 par CDK2 sur Ser130 favorise sa reconnaissance par les systèmes d’ubiquitination et sa dégradation, ce qui limite la durée de l’arrêt et permet la reprise du cycle.
- La phosphorylation par GSK3β contribue également à l’instabilité de p21 dans certains contextes prolifératifs.
b. Lorsque le signal de stress disparaît, la dégradation de p21 (via SCFSkp2 notamment) permet la réactivation progressive des CDK et la reprise du cycle.
2. Une induction prolongée favorise l’installation d’états d’arrêt durable, notamment lors de la sénescence, en maintenant durablement l’inhibition des CDK.
a. Une fraction nucléaire de p21 maintient l’inhibition des complexes cycline/CDK et contribue au maintien de Rb sous une forme hypophosphorylée, assurant une répression prolongée des gènes E2F-dépendants et un arrêt stable du cycle.
b. Parallèlement, la phosphorylation de p21 par Akt sur Thr145 et Ser146 stabilise la protéine et modifie sa localisation subcellulaire.
- Cette phosphorylation perturbe son signal de localisation nucléaire (NLS) et favorise sa rétention dans le cytoplasme.
- La p21 cytoplasmique devient ainsi plus stable, car elle échappe en partie aux voies de dégradation nucléaires, notamment celles dépendantes de SCFSkp2.
3. Dans le cytoplasme, p21 n’agit plus directement sur les complexes cycline/CDK nucléaires, mais peut acquérir des fonctions complémentaires selon le contexte cellulaire, notamment dans la régulation (Biology of the cell cycle inhibitor p21CDKN1A : molecular mechanisms and relevance in chemical toxicology 2011) :
- du cytosquelette, par l'interaction avec ROCK1 et l'inhibition de la contractilité acto-myosine,
- de l’apoptose, par l'inhibition de la caspase-3 par interaction directe avec procaspase-3,
- de la survie cellulaire, par activation de la voie PI3K/Akt et la protection contre l’apoptose,
- de la migration, par la modulation de l’adhésion focale via cofiline et la petite GTPase RhoA.
4. À l’échelle du système, ce basculement dépend donc moins de la présence ou non de p21 que de :
- son niveau d’expression,
- sa persistance temporelle,
- sa dynamique de dégradation.

p21 agit ainsi comme un intégrateur temporel du stress, traduisant une information quantitative (intensité/durée du signal) en décision qualitative (arrêt transitoire versus arrêt durable).
Régulation par p53
1. L’expression de p21 est principalement contrôlée par le facteur transcriptionnel p53, qui constitue le capteur central de l’intégrité du génome et de l’état de stress cellulaire.
L’axe p53 ➞ p21 permet ainsi de traduire un signal de stress génomique en une réponse fonctionnelle sur la dynamique du cycle cellulaire, en couplant directement l’état du génome à l’intensité et à la durée de l’inhibition des CDK (Cell cycle regulation: p53-p21-RB signaling 2022).
Ce mécanisme suspend la prolifération et laisse à la cellule le temps d’engager des processus de réparation, d’adaptation ou, si nécessaire, des programmes d’élimination. ou, si nécessaire, des programmes d’élimination.
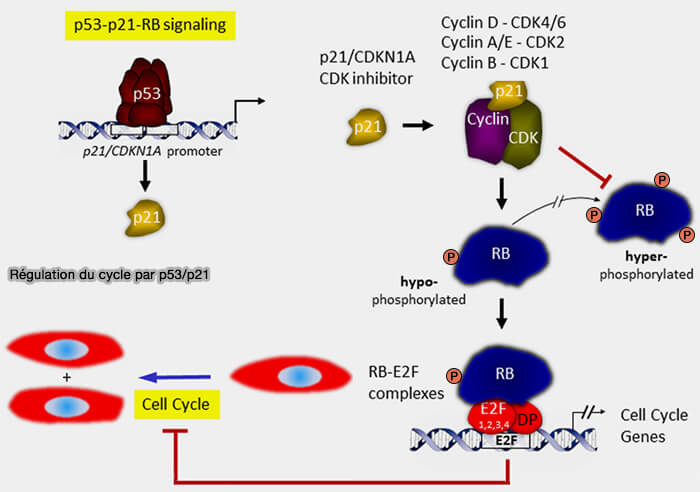
(Figure modifiée : vetopsy.fr d'après Engeland)
2. p53 (tumor protein p53, ou Tp53) intègre des signaux tels que les dommages de l’ADN, les défauts de réplication, le stress oxydatif ou l’activation oncogénique aberrante, et module en conséquence l’expression de gènes impliqués dans l’arrêt du cycle, la réparation, la sénescence ou l’apoptose (Decoding p53 tumor suppression: a crosstalk between genomic stability and epigenetic control? 2024).
a. En conditions basales, p53 est maintenue à un niveau faible par l’action de MDM2, une ligase E3 de la famille RING, qui ubiquitine p53 et cible la protéine vers la dégradation protéasomale, ce qui empêche l’activation inappropriée des programmes d’arrêt du cycle (
MDM2 est lui-même un gène cible transcriptionnel de p53, ce qui établit une boucle de rétrocontrôle négatif p53 ➞ MDM2 ➞ p53, responsable du caractère pulsatile et finement régulé de la réponse p53 au stress (
b. En réponse aux dommages de l’ADN, l’activation des kinases ATR/Chk1 et ATM/Chk2 entraîne la phosphorylation de p53 et de MDM2, ce qui stabilise p53, favorise son accumulation nucléaire et permet son activation transcriptionnelle.
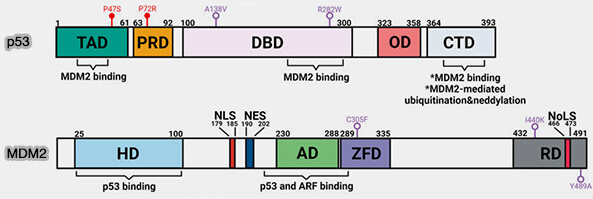
(Figure modifiée : vetopsy.fr d'après Kung et Weber)

Vous pouvez lire : It’s Getting Complicated—A Fresh Look at p53-MDM2-ARF Triangle in Tumorigenesis and Cancer Therapy (2022), article qui décrit les nombreuses fonctions de p53 et qui fait partie d'une recherche poussée comportant 13 articles différents (The Expanding Network of p53 Signaling: Reaching to the Unknown of Cancer 2022).
2. Lorsque les dommages dépassent un seuil critique, p53 n’oriente plus vers un arrêt transitoire, mais vers des programmes irréversibles.
- p53 peut induire l’expression de gènes pro-apoptotiques tels que BAX, PUMA, NOXA et FAS, conduisant à l’activation de la voie mitochondriale de l’apoptose. ou voie intrinsèque.
- p53 peut également induire un programme de sénescence stable via l’activation durable de p21 et de gènes impliqués dans le remodelage chromatinien.
- p53 active aussi des gènes impliqués dans la réparation de l’ADN, comme GADD45, contribuant directement au maintien de l’intégrité génomique.

Ainsi, p53 ne se limite pas à bloquer le cycle : elle arbitre entre réparation, arrêt durable et élimination cellulaire.
3. Au-delà de ces rôles dans le contrôle du cycle, p53 intervient également comme régulateur métabolique, notamment en modulant la glycolyse et l’utilisation du pyruvate établissant un lien fonctionnel entre contrôle de la prolifération et reprogrammation métabolique (
p27 (KIP1)
p27 est un régulateur central de la quiescence (G0) et du point de restriction (R) en contrôlant la décision entre maintien hors cycle et réengagement en prolifération (Cell cycle regulation by the intrinsically disordered proteins, p21 and p27 2020).
Elle agit ainsi comme un verrou physiologique de l’entrée en cycle en phase G1 dans les cellules non stimulées par signaux mitogènes.
1. La fonction de p27 dépend fortement de son niveau intracellulaire, ce qui lui confère un rôle bimodal.
- À faible concentration, elle peut faciliter l’assemblage de certains complexes cycline D/CDK4-6,
- À concentration élevée, elle devient au contraire fortement inhibitrice des complexes cycline/CDK et impose un blocage effectif de la progression du cycle.

La levée de ce verrou constitue une étape clé de la reprise de prolifération et de l’entrée en phase S.
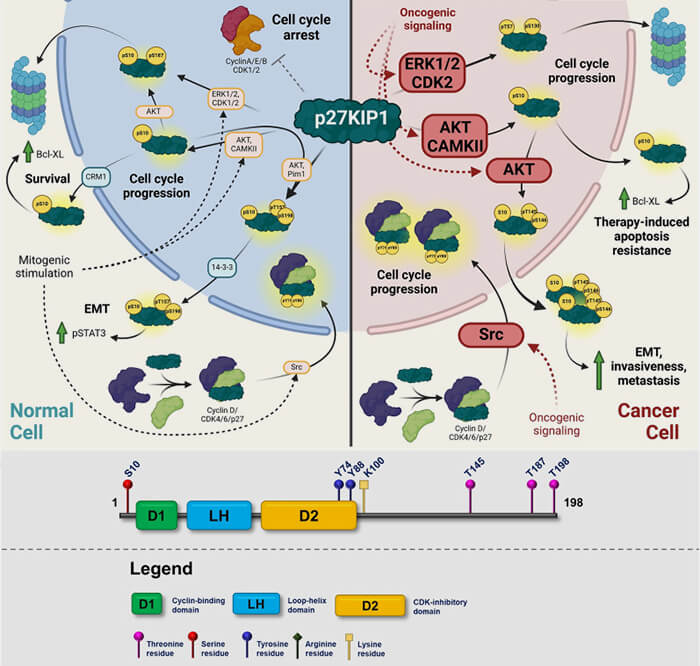
(Figure modifiée : vetopsy.fr d'après Csergeová et coll)
2. Cette dégradation est contrôlée par des modifications post-traductionnelles spécifiques.
La phosphorylation de p27 sur Thr187 par le complexe cycline E/CDK2 permet sa reconnaissance par l’ubiquitine-ligase SCFSkp2 et conduit à sa dégradation protéasomale, mécanisme central du franchissement du point R en G1 tardive, ce qui libère progressivement l’activité des CDK et favorise l’entrée en phase S.
3. D’autres phosphorylations, comme celle sur Thr198, favorisent la stabilisation cytoplasmique de p27 et lui confèrent des fonctions différentes de l’inhibition directe des CDK.
Comme p21, p27 exerce des fonctions distinctes selon sa localisation subcellulaire (
- nucléaire pour l’inhibition des complexes cycline/CDK,
- cytoplasmique pour des rôles indépendants du contrôle direct du cycle, mais avec des partenaires moléculaires et des effets biologiques spécifiques.
Remarque : sur le plan pathologique, p27 est fréquemment dérégulée dans les cancers, non par mutation du gène, mais par accélération de sa dégradation, ce qui contribue à une activation inappropriée des CDK et à une prolifération incontrôlée.
p57 (KIP2)
1. Contrairement à p21 et p27, p57 n’est pas un régulateur général de la réponse aux dommages de l’ADN ou de la quiescence (Functional Versatility of the CDK Inhibitor p57Kip2 2020).
a. Elle exerce principalement ses fonctions dans des contextes développementaux spécifiques, notamment dans le placenta, le muscle, le cerveau et plusieurs tissus en cours de maturation où elle contribue :
- au contrôle du développement embryonnaire,
- à la limitation de la prolifération dans les cellules engagées dans la différenciation,
- à l’instauration d’un arrêt durable du cycle cellulaire lorsque cela est requis pour la maturation tissulaire.
b. Au-delà du développement, p57 contribue à la stabilisation des programmes cellulaires spécialisés et à la prévention d’une ré-entrée inappropriée en prolifération (Cellular Response upon Stress: p57 Contribution to the Final Outcome 2015).
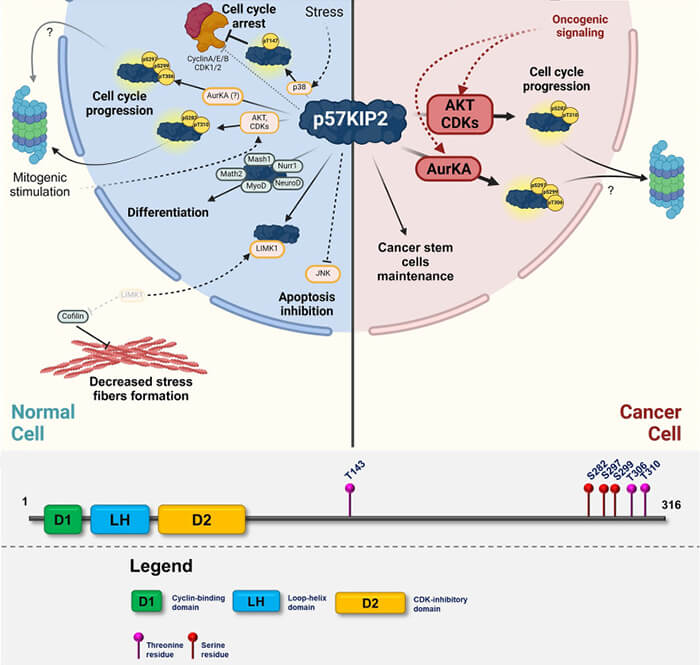
(Figure modifiée : vetopsy.fr d'après Csergeová et coll)
1. Sur le plan moléculaire, p57 partage avec p21 et p27 un mécanisme d’inhibition similaire des complexes cycline/CDK.
Il repose sur la formation d’un complexe ternaire cycline/CDK/p57 et sur le blocage du site catalytique de la CDK et du site de recrutement des substrats de la cycline, notamment pour les complexes cycline E/CDK2 et cycline A/CDK2, qui constituent les modèles les mieux caractérisés.
2. L’expression de p57 est fortement régulée au niveau transcriptionnel par des mécanismes d’empreinte génomique.
a. Le gène CDKN1C, qui code p57, est soumis à une empreinte parentale car seul l’allèle maternel est exprimé dans de nombreux tissus, ce qui rend sa régulation particulièrement sensible (Functional Versatility of the CDK Inhibitor p57Kip2 2020).
- L’empreinte génomique est un mécanisme épigénétique par lequel un seul des deux allèles (maternel ou paternel) est actif, l’autre étant silencé de manière programmée par la méthylation de l’ADN sur les régions régulatrices, des modifications d’histones répressives, notamment H3K9me3 et H3K27me3, et une organisation de la chromatine en état condensé transcriptionnellement inactif.
- Cette empreinte parentale, avec un allèle maternel actif et un allèle paternel épigénétiquement silencieux, assure un contrôle strict du dosage de p57 pendant le développement, en évitant une inhibition excessive ou insuffisante de la prolifération cellulaire.
b. Une diminution de son expression est impliquée dans le syndrome de Beckwith-Wiedemann, caractérisé par une croissance excessive et une prédisposition tumorale, soulignant le rôle de p57 comme frein physiologique de la prolifération pendant le développement (Beckwith–Wiedemann syndrome 2009).
Retour à la régulation des CDK
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


