Cycle cellulaire
Cyclines : cycline D
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

Les cyclines D intègrent les signaux mitogènes extracellulaires pour activer CDK4/6 et contrôler le franchissement du point de restriction en G1.
Structure et isoformes de la cycline D
La cycline D appartient à la famille des cyclines mitotiques et partage avec elles une architecture structurale conservée caractérisée par un repliement de type cyclin fold constitué de deux boîtes à cycline caractéristiques de sa famille, dont l’organisation tridimensionnelle est nécessaire à l’interaction avec les CDK et à leur activation.
Elle se distingue toutefois par des régions périphériques particulièrement étendues et flexibles, qui conditionnent fortement sa régulation et sa dépendance aux signaux extracellulaires.
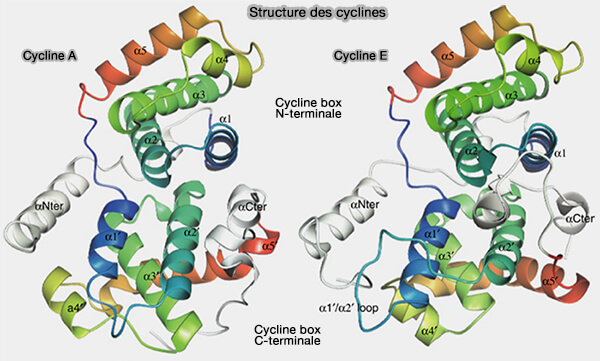
(Figure : vetopsy.fr d'après Honda et coll)
1. Chez les mammifères, trois isoformes principales sont présentes : la cycline D1 (CCND1), la cycline D2 (CCND2) et la cycline D3 (CCND3).
a. Ces trois isoformes possèdent :
- une architecture globale comparable,
- des fonctions globalement redondantes dans l’activation de CDK4 et CDK6.
b. Elles présentent des profils d’expression dépendants du tissu et du stade de développement, reflétant une spécialisation fonctionnelle selon le contexte biologique.
- La cycline D1 est la forme la plus largement exprimée dans les cellules épithéliales (sein, foie, peau, intestin) et constitue la principale isoforme impliquée dans de nombreux contextes oncogéniques.
- La cycline D2 est préférentiellement exprimée dans les tissus hématopoïétiques et joue un rôle important dans la prolifération des lymphocytes et la réponse aux cytokines.
- La cycline D3 présente une expression marquée dans les lignages lymphocytaires, le muscle et le système nerveux, et intervient davantage dans des programmes de prolifération associés à la différenciation cellulaire.
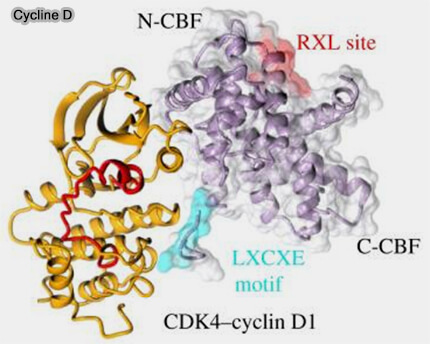
(Figure : vetopsy.fr d'après Wood et Endicott)
2. La cycline D possède des extensions N- et C-terminales relativement longues et faiblement structurées par rapport aux autres cyclines du cycle (Structural insights into the functional diversity of the CDK-cyclin family 2018).
a. Ces régions périphériques jouent un rôle structural indirect majeur en servant de plateforme pour :
- l’intégration de multiples signaux de phosphorylation,
- la reconnaissance par des partenaires régulateurs,
- la modulation de la stabilité protéique.
b. La région N-terminale contient notamment plusieurs motifs de phosphorylation régulant la stabilité, dont un site critique dont la phosphorylation conditionne la reconnaissance par le système SCF et la dégradation de la cycline D.

Cette organisation explique la forte instabilité intrinsèque de la cycline D et sa dépendance étroite aux signaux mitogènes actifs pendant la phase G1.
3. Les surfaces périphériques du cyclin fold de la cycline D sont adaptées à une interaction préférentielle avec CDK4 et CDK6, ce qui explique que la cycline D ne forme pas de complexes catalytiquement efficaces avec CDK1 ou CDK2 dans des conditions physiologiques.
La formation d’un complexe cycline D/CDK4-6 stable repose en outre largement sur la présence de partenaires stabilisateurs, notamment des CKI (CDK inhibitors) de la famille CIP/KIP, ce qui constitue une particularité structurale et fonctionnelle propre aux cyclines D.
Complexes cycline D/CDK4-6
Activation du complexe cycline D/CDK4-6
Signaux mitogènes et induction de la cycline D
1. L’activation des complexes cycline D/CDK4-6 constitue la première étape enzymatique structurante du cycle cellulaire en réponse aux signaux mitogènes.
Contrairement aux autres complexes cycline/CDK, leur activation dépend prioritairement de l’intégration des signaux extracellulaires et de l’état cellulaire interne, et ne relève pas d’un programme autonome du cycle.
2. L’expression des cyclines D est directement contrôlée par les voies de signalisation activées par les facteurs de croissance (EGF, PDGF, IGF), via les récepteurs tyrosine-kinase (RTK) qui activent des facteurs de transcription précoces qui induisent la transcription des gènes CCND1, CCND2 et CCND3.
a. La régulation repose principalement sur (
- la voie Ras-MAPK/ERK, qui stimule directement la transcription de la cycline D1,
- la voie PI3K/Akt/mTOR, qui favorise la traduction, la biogenèse ribosomale, la croissance cellulaire et surtout la stabilisation de la protéine cycline D1, reliant ainsi disponibilité métabolique et engagement prolifératif,
- des voies contextuelles selon le type cellulaire, comme la voie Wnt/β-caténine, qui peut activer directement la transcription de CCND1 dans de nombreux tissus (épithélium intestinal, foie, tumeurs colorectales),
- des mécanismes de crosstalk avec NF-κB et les signaux cytokiniques, particulièrement dans les cellules hématopoïétiques.
b. Ces différentes voies convergent vers un objectif commun : ajuster finement le niveau de cycline D à l’environnement extracellulaire.
Cofacteurs d’assemblage et partenaires d’interaction
1. L’association cycline D-CDK4-6 ne suffit pas à induire une conformation catalytique pleinement active, contrairement aux complexes cycline E/CDK2 ou cycline A/CDK2.
Dans ces complexes, l’hélice αC de CDK4 reste partiellement désalignée et la boucle d’activation n’adopte pas spontanément une géométrie compatible avec une activité kinase optimale.
Le complexe formé doit donc être considéré comme structurellement assemblé mais fonctionnellement incomplet.
2. Cette organisation explique que l’activité effective des complexes cycline D/CDK4-6 dépend de déterminants supplémentaires.
a. Les protéines p21CIP1 et p27KIP1, classiquement considérées comme inhibiteurs des CDK (CKI), jouent ici un rôle paradoxal de cofacteurs structuraux, dont le mécanisme constitue une particularité propre aux complexes cycline D/CDK4-6.
- Elles stabilisent l’assemblage du complexe cycline D/CDK4-6,
- Elles favorisent son accumulation nucléaire,
- Elles contribuent à sa fonctionnalité enzymatique.
Remarque : en G1 tardive et à la transition G1/S, l’activation d’Akt lui permet de phosphoryler p27 (et en partie de p21) pour entraîner leur exclusion nucléaire et/ou leur déstabilisation, ce qui libère les complexes cycline E/CDK2 et cycline A/CDK2 de leur inhibition et permet le basculement vers une activité CDK2 élevée.
b. CDK4 et CDK6 doivent être phosphorylées sur la thréonine de la T-loop par la CAK (cycline H/CDK7/Mat1) pour atteindre une activité catalytique réelle.
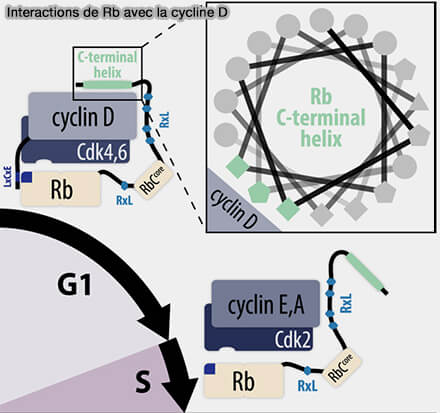
(Figure : vetopsy.fr d'après Topacio et coll)
c. Des interactions protéiques associées, en particulier via les surfaces de recrutement portées par la cycline D1, sont nécessaires à la stabilisation et à la fonctionnalité du complexe :
- le motif RXL (Cy motif), susceptible de participer au docking de partenaires régulateurs ou de substrats, comme observé pour d’autres cyclines,
- le motif LxCxE, impliqué dans les interactions avec les protéines de la famille Rb, positionnant la cycline D comme plateforme de recrutement de substrats,
- La surface CBF (Cyclin D Binding Factor) de la cycline D1, impliquée dans le recrutement de partenaires adaptateurs et associée fonctionnellement à l’axe CUL7-Fbw8.
Ainsi, les complexes cycline D/CDK4-6 ne fonctionnent pas comme de simples kinases déclenchées par assemblage, mais comme des plateformes régulées dont l’activité résulte d’une intégration progressive de signaux structuraux et moléculaires en G1.
4. Même une fois formé, le complexe cycline D/CDK4-6 reste une kinase relativement peu active comparée aux complexes CDK2 ou CDK1.
a. Son rôle n’est pas d’imposer un programme massif de phosphorylation, mais d’assurer une phosphorylation progressive et cumulative de Rb, corépresseur transcriptionnel, amorçant la libération des facteurs de transcription E2F (
b. Tant que les signaux extracellulaires persistent :
- l’expression des cyclines D est maintenue,
- les complexes cycline D/CDK4-6 restent actifs,
- la phosphorylation de Rb progresse.
c. À l’inverse, en absence de signaux mitogènes, les cyclines D sont rapidement éliminées, les complexes cycline D/CDK4-6 s’éteignent, et la cellule peut revenir vers un état de quiescence (G0).
- Les complexes peuvent être dégradés par ubiquitination via des ligases E3 de type SCF, en particulier SCFFbxo4 , ligase E3 majeure et canonique de la cycline D1 phosphorylée (notamment sur Thr286), et SCFFbxw8, dans certains contextes cellulaires, notamment activé dans des contextes de stress, de signalisation aberrante ou de contrainte cellulaire.
- L’action des inhibiteurs de la famille INK4, dont p16INK4A, peut bloquer directement l’activité de CDK4/6.
Actions chronologiques du complexe cycline A/CDK2
L’activité du complexe cycline D/CDK4-6 s’étend tout au long de la phase G1 et structure la progression de la cellule depuis la dépendance aux signaux mitotiques jusqu’à l’engagement autonome dans le cycle.

Le complexe cycline D/CDK4-6 ne déclenche donc pas directement l’entrée en phase S, mais conditionne progressivement la cellule à devenir compétente pour franchir le point de restriction (R).
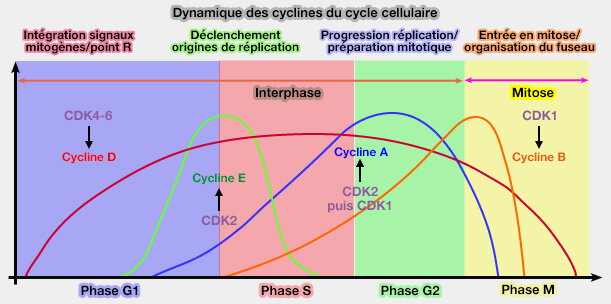
(Figure : vetopsy.fr)
1. En G1 précoce, l’expression des cyclines D et l’activité du complexe cycline D/CDK4-6 dépendent directement de la persistance des signaux mitotiques.
À ce stade, l’arrêt des signaux entraîne l’extinction rapide de l’activité CDK4-6 et le retour possible vers G0.
2. En G1 intermédiaire, l’activité cycline D/CDK4-6 s’installe progressivement et induit une phosphorylation partielle et cumulative de Rb, sans encore abolir complètement sa fonction répressive.
La cellule reste encore réversible sur le plan décisionnel.
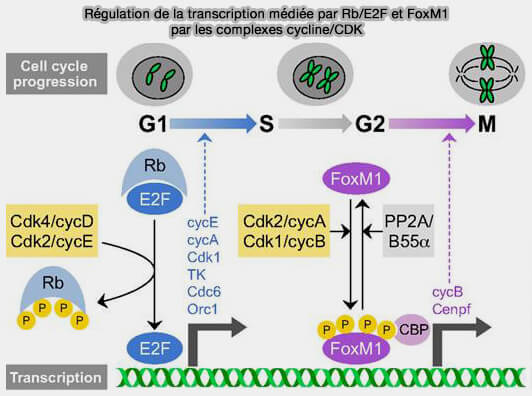
(Figure : vetopsy.fr d'après Lim et Kaldis)
3. En G1 tardive, lorsque l’activité CDK4-6 devient suffisante, elle permet l’expression efficace de la cycline E et l’activation du complexe cycline E/CDK2.
À partir de ce point, le contrôle du cycle bascule progressivement d’un régime dépendant des signaux mitotiques (cycline D) vers un régime endogène (cycline E puis cycline A).
Rôle en physiopathologie
1. La dérégulation de l’axe cycline D/CDK4-6 constitue un mécanisme fréquent d’oncogenèse.
- La surexpression de la cycline D1 est observée dans de nombreux cancers, notamment du sein, du pancréas et dans certains mélanomes, où elle favorise un franchissement inapproprié du point R et une prolifération incontrôlée.
- Dans les lymphomes du manteau, i.e. prolifération cancéreuse de lymphocytes B issus de la zone du manteau des ganglions, une translocation t(11;14) plaçant le gène CCND1 sous le contrôle du locus des immunoglobulines (CCND1-IGH) entraîne une expression constitutive de la cycline D1.
2. Cet axe constitue aujourd’hui une cible thérapeutique majeure, avec l’utilisation clinique d’inhibiteurs de CDK4/6 (palbociclib, ribociclib, abemaciclib), particulièrement en oncologie mammaire.
Retour aux cyclines
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


