Cycle cellulaire
Cyclin-Dependent Kinases (CDK)
Régulation : vue d'ensemble et activation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

La régulation des complexes cycline/CDK repose sur l’intégration coordonnée de mécanismes d’activation, d’inhibition et de checkpoints, qui conditionnent les décisions irréversibles du cycle cellulaire.
Vue d’ensemble de la régulation des CDK
La régulation des complexes cycline/CDK conditionne l’organisation correcte de nombreux processus cellulaires, notamment le cycle cellulaire, mais aussi la transcription, la réponse aux dommages de l’ADN et certains programmes de différenciation.
1. L’activité des complexes cycline/CDK ne repose pas sur l’activité d’une kinase isolée, mais sur un ensemble coordonné de mécanismes qui déterminent à quel moment, dans quel compartiment et avec quelle intensité un complexe devient actif.
2. Cette régulation repose principalement sur :
a. des mécanismes d’activation des complexes cycline/CDK :
- compétence catalytique conférée par la phosphorylation de la T-loop par la CAK,
- levée des verrous régulatoires par Cdc25,
- boucles de rétrocontrôle positives qui amplifient l’activité,
- optimisation de l’efficacité fonctionnelle des complexes par les cofacteurs CKS (CKS1/CKS2).
b. des mécanismes d’inhibition et de contrôle :
- inhibition par contrôle des cyclines,
- verrouillage inhibiteur assuré par Wee1 et Myt1,
- boucles de rétrocontrôle négatif,
- intégration avec les checkpoints qui suspendent l’activation en cas d’anomalie,
- action des inhibiteurs protéiques des CDK (CKI).

Ces mécanismes assurent la cohérence des transitions, limitent les activations inappropriées et contribuent à la stabilité globale des programmes cellulaires.
Activation des complexes cycline/CDK
En amont, l’activation des complexes cycline/CDK des phases G1 et de transition G1/S est déclenchée par des signaux mitogènes extracellulaires et intracellulaires (facteurs de croissance, état métabolique, intégrité génomique) qui contrôlent l’expression des cyclines via des axes transcriptionnels spécifiques, notamment la voie Rb/E2F qui régule l’induction de la cycline E et de la cycline A après l’activation préalable de la cycline D.
En revanche, l’activation des enzymes mitotiques associées à la transition G2/M (complexe cycline B/CDK1, Plk1, Aurora A) repose essentiellement sur des mécanismes post-transcriptionnels et des boucles de rétroactivation, constituant un commutateur enzymatique distinct de la logique transcriptionnelle Rb/E2F des phases G1-S.
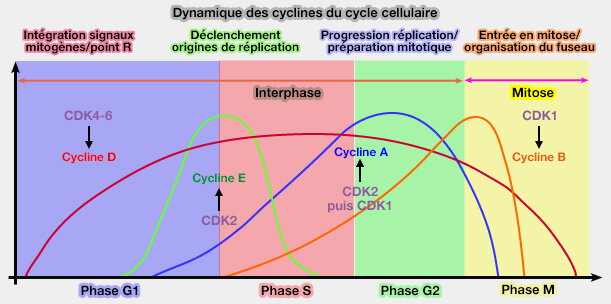
(Figure : vetopsy.fr)
1. L’activation d’un complexe cycline/CDK ne correspond jamais à un simple événement binaire, mais à un processus intégré résultant de la convergence de plusieurs paramètres.
Un complexe peut exister sous trois états fonctionnels distincts :
- complexe formé mais catalytiquement incompétent,
- complexe compétent mais maintenu inactif par inhibition,
- complexe pleinement actif après franchissement d’un seuil d’activité.
L’activation fonctionnelle correspond à un franchissement de seuil transformant une activité progressive en transition cellulaire effective.
2. Cette activation ne dépend jamais d’un facteur isolé, mais résulte de l’intégration dynamique de plusieurs paramètres :
- le niveau d’expression de la cycline (
régulation par les cyclines),
- l'état de phosphorylation de la CDK, déterminé par l’équilibre entre CAK, Wee1 et Myt1 (PKMYT1) et Cdc25,
- l'activité de Cdc25,
- la présence ou absence de CKI (CDK inhibitors),
- l'état des checkpoints.
L’activation ne correspond donc pas à un mécanisme local, mais à une décision moléculaire globale, reflétant l’état fonctionnel de la cellule.
Maturation fonctionnelle des complexes cycline/CDK par la CAK
La CAK (CDK-activating kinase) correspond au complexe trimérique cycline H/CDK7/MAT1 (The cryoelectron microscopy structure of the human CDK-activating kinase 2020).
Activation catalytique des CDK
1. L’activation catalytique d’une CDK associée à une cycline repose sur la phosphorylation de la boucle T, ce qui stabilise la conformation active de la kinase et augmente son efficacité catalytique (Structural basis of T-loop-independent recognition and activation of CDKs by the CDK-activating kinase 2025).
a. La CAK phosphoryle la boucle T sur :
- Thr160 sur CDK2,
- Thr161 sur CDK1.
b. Ces résidus correspondent à une thréonine hautement conservée au sein de la boucle d’activation des CDK, localisée dans une région stratégique contrôlant l’accès au site catalytique.
- Leur phosphorylation induit une stabilisation électrostatique de la T-loop par la formation d’interactions intramoléculaires avec des résidus basiques voisins, ce qui verrouille la boucle dans une conformation ouverte compatible avec la fixation du substrat et l’alignement correct des résidus catalytiques.
- Sur le plan structural, cette phosphorylation favorise notamment l’organisation optimale de la triade catalytique et renforce le couplage fonctionnel entre la T-loop, l’hélice αC et la poche ATP, ce qui explique l’augmentation marquée de l’efficacité catalytique des complexes cycline/CDK activés.
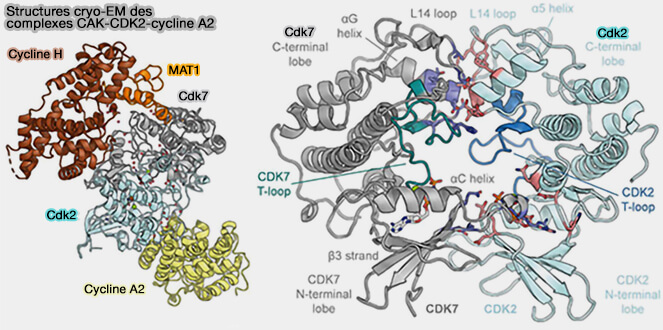
(Figure modifiée : vetopsy.fr d'après Cushing et coll)
2. Sur le plan fonctionnel, la phosphorylation de la T-loop ne suffit pas à déclencher à elle seule une transition du cycle.
- De nombreux complexes cycline/CDK sont déjà phosphorylés par la CAK tout en restant inactifs, en raison de phosphorylations inhibitrices par Wee1 et Myt1 (PKMYT1) ou de l’action des CKI (CDK inhibitors).
- Cela renforce l’idée que la CAK confère une compétence catalytique, mais que la décision d’activation relève d’un niveau de régulation supérieur.
Structure du complexe
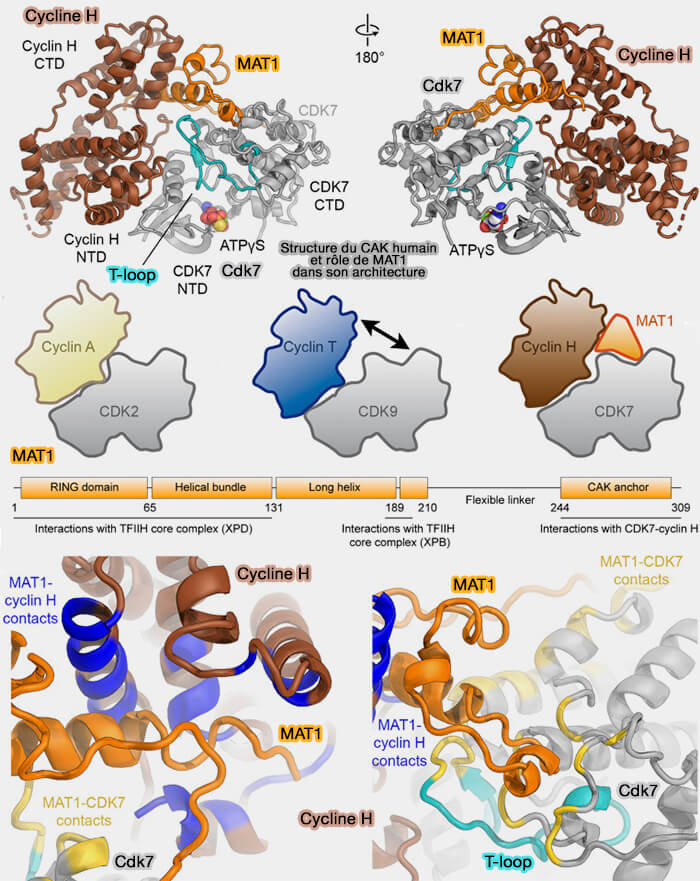
(Figure modifiée : vetopsy.fr d'après Greber et coll)
1. Sur le plan structural, CDK7 présente l’architecture canonique des kinases sérine/thréonine, mais avec des particularités qui conditionnent sa fonction de kinase d’activation plutôt que de kinase de transition du cycle
a. La boucle d’activation (T-loop) de CDK7 présente une conformation plus rigidifiée que dans de nombreuses autres CDK, en raison de contacts stabilisateurs avec la cycline H et surtout avec MAT1 (Structural basis of T-loop-independent recognition and activation of CDKs by the CDK-activating kinase 2025).
Cette contrainte structurale limite la variabilité conformationnelle du site catalytique et favorise une géométrie compatible avec une activité constitutive modérée, adaptée à une fonction de kinase d’activation agissant sur plusieurs CDK substrats plutôt qu’à une régulation cyclique stricte.
b. L’interface CDK7-cycline H est plus étendue que dans les complexes cycline/CDK classiques et implique non seulement l’hélice αC de CDK7, mais également des régions adjacentes du lobe N-terminal et des contacts secondaires avec la seconde boîte à cycline.
Cette organisation renforce la stabilité du complexe et oriente le site catalytique vers une fonction de phosphorylation de substrats multiples, cohérente avec le rôle de CDK7 comme kinase maîtresse plutôt que comme régulateur temporel du cycle.
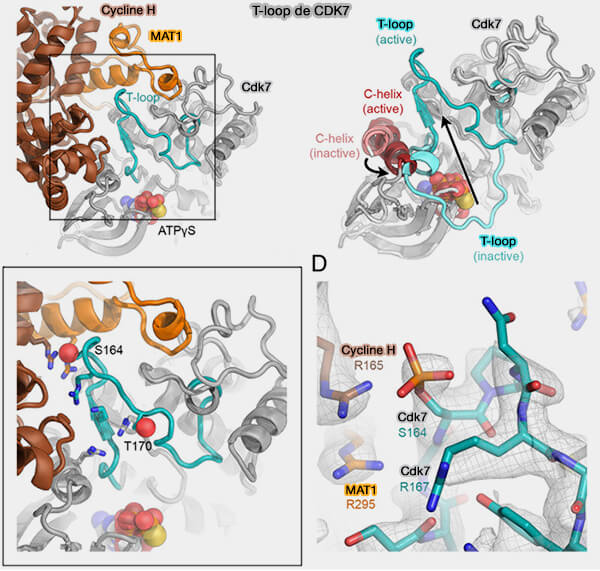
(Figure modifiée : vetopsy.fr d'après Greber et coll)
2. La cycline H, cycline de type G1, adopte un repliement en cyclin fold conservé, mais son orientation relative à CDK7 diffère partiellement de celle observée dans les complexes cycline/CDK du cycle, ce qui contribue à la spécificité fonctionnelle de la CAK et à son profil de reconnaissance de substrats.
3. MAT1 (ménage à trois 1) joue un rôle structural central dans l’architecture du complexe (Structural basis for CDK7 activation by MAT1 and Cyclin H 2020).
a. Sa région centrale adopte un repliement en faisceau de trois hélices (three-helix bundle) qui s’insère à l’interface CDK7-cycline H, augmentant la surface de contact entre les deux partenaires et rigidifiant l’ensemble du complexe.
b. Au niveau moléculaire, MAT1 interagit directement avec la région C-terminale de CDK7 et avec la seconde boîte à cycline de la cycline H.
Ces interactions contribuent à maintenir l’hélice αC de CDK7 dans une position active et à stabiliser l’organisation spatiale de la boucle d’activation, favorisant ainsi une géométrie catalytique compatible avec la phosphorylation efficace des CDK cibles.

Cette organisation trimérique du complexe cycline H/CDK7/MAT1 confère à la CAK une architecture spécifiquement adaptée à sa fonction de kinase maîtresse d’activation des CDK et la distingue des complexes cycline/CDK du cycle cellulaire, dont l’activité repose principalement sur l’allostérie cycline-dépendante et la dynamique de phosphorylation de la T-loop.
(Figure modifiée : vetopsy.fr d'après Greber et coll)
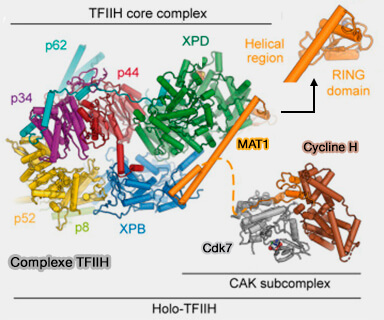
Remarque : le complexe CAK (cycline H/CDK7/Mat1) peut aussi être associé au complexe TFIIH, un assemblage multiprotéique essentiel à :
- la transcription par l’ARN polymérase II,
- la réparation par excision de nucléotides (NER).
Au sein de TFIIH, le module cycline H/CDK7 constitue la sous-unité kinase responsable de la phosphorylation du domaine CTD (C-terminal domain) de l’ARN polymérase II, principalement sur les résidus sérine 5 et sérine 7.
Cette modification favorise la transition de l’initiation vers l’élongation transcriptionnelle et le recrutement des enzymes impliquées dans la maturation co-transcriptionnelle des ARN.

La cycline H occupe une position charnière entre mécanismes transcriptionnels et contrôle du cycle cellulaire, ce qui lui confère un rôle de régulateur de l’équilibre entre prolifération et intégrité génomique.
Déclenchement et amplification de l'activation des CDK
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


