Cycle cellulaire
Cyclines : interactions avec CDK
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

Les cyclines constituent une large famille de protéines régulatrices dont l’expression et la dégradation contrôlent des processus cellulaires essentiels, notamment le cycle cellulaire, la transcription, la différenciation et certaines voies de signalisation.
Le tableau suivant décrit les principaux complexes cycline/CDK en fonction de la phase du cycle cellulaire au cours de laquelle ils interviennent et des fonctions qu’ils assurent.
| Complexe cycline/CDK |
Phase cycle cellulaire |
Fonctions principales |
|---|---|---|
| Cycline D/CDK4-6 | Phase G1 |
|
| Cycline E/CDK2 | Fin G1 ➞ entrée en S |
|
| Cycline A/CDK2 | Phase S |
|
| Cycline A/CDK1 | Phase G2 précoce |
|
| Cycline B/CDK1 (MPF) |
G2/M ➞ mitose |
|
| Métaphase |
|
|
| Anaphase ➞ Sortie de mitose |
|
|
| Cycline F (SCFcycline F) |
G2 ➞ Début mitose |
|
Vue d'ensemble
Les complexes cycline-CDK sont des hétérodimères fonctionnels constitués d’une kinase dépendante des cyclines (CDK) et d’une sous-unité régulatrice de type cycline (Insights on Structural Characteristics and Ligand Binding Mechanisms of CDK2 2015).
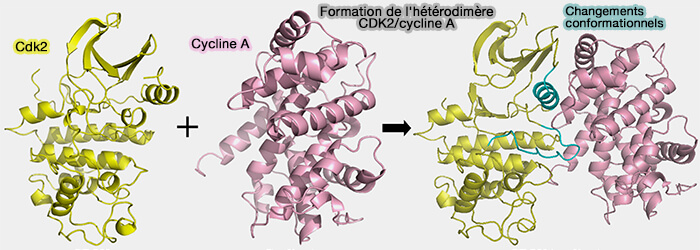
Figure : vetopsy.fr d'après Li et coll)
1. La CDK seule est catalytiquement inactive car son site actif est partiellement masqué et sa boucle d’activation (T-loop) adopte une conformation incompatible avec une fixation efficace de l'ATP et des substrats.
- D'une part, l’association avec une cycline est indispensable pour induire les changements structuraux nécessaires à l’activation enzymatique.
- D'autre part, elle confère également une spécificité fonctionnelle, car chaque cycline oriente la kinase vers un ensemble particulier de cibles protéiques et module son activité selon le contexte cellulaire et la phase du cycle.
2. Ainsi, les cyclines ne se contentent pas d’activer les CDK, elles déterminent la temporalité, la localisation subcellulaire et la sélectivité du complexe, ce qui constitue le principe central de la diversité fonctionnelle des complexes cycline/CDK.
Nature des interactions entre cycline et CDK
1. Les interfaces CDK/cycline sont étendues et complexes.
a. Les deux boîtes à cycline s’organisent en une structure tridimensionnelle en fer à cheval, créant une surface interne concave et c'est cette géométrie :
- qui explique l’activation de la CDK,
- qui justifie les différences fines entre cyclines, via résidus de surface variables, tout en restant de nature purement structurale.
b. Elles associent plusieurs types d’interactions complémentaires :
- des liaisons hydrophobes entre le domaine N-terminal de la cycline et le motif PSTAIRE ou ses variantes de la CDK constituant le cœur de l’ancrage,
- des liaisons hydrogène et des ponts salins entre la boucle d’activation (T-loop) de la CDK et des résidus polaires situés dans la région inter-domaines de la cycline.
c. Des interactions secondaires peuvent également impliquer des régions C-terminales ou des boucles flexibles, renforçant la spécificité du complexe.
d. Cette interface stabilise le cœur catalytique du dimère et détermine sa préférence de substrat.

La conformation précise des hélices αC et αE de CDK, imposée par la cycline, module l’activité catalytique, la stabilité du site actif et la sensibilité à la phosphorylation régulatrice.
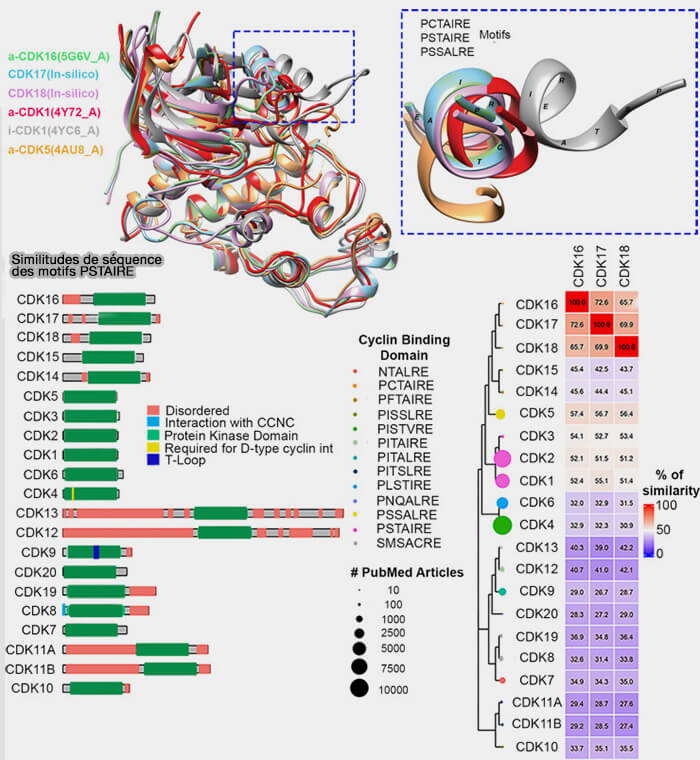
Figure : vetopsy.fr d'après Karimbayli et coll)
2. Des motifs peptidiques de reconnaissance dans l’hélice αC de la CDK assurent l’interaction avec la cycline (Insights into the structural and functional activities of forgotten Kinases: PCTAIREs CDKs 2024).
a. Le motif PSTAIRE (Pro-Ser-Thr-Ala-Ile-Arg-Glu) est un motif peptidique hautement conservé, caractéristique des CDK impliquées dans la progression du cycle cellulaire, i.e. CDK1 et CDK2, dont l'activité est finement régulée et intrinsèquement cyclique.
- Ce segment joue un rôle de charnière structurale en formant un point d’ancrage stable avec une cavité hydrophobe de la cycline.
- Il participe à la réorganisation du domaine catalytique de la CDK lors de l’activation.
b. Des motifs divergents apparaissent dans les CDK transcriptionnelles, reflétant la diversification évolutive des complexes cycline/CDK selon leur fonction et leur partenaire cyclinique.
- Ces variantes, qui incluent de légères différences d’acides aminés telles que Ile/Leu ou Thr/Ser, modifient l’environnement électrostatique local et la complémentarité structurale.
- Elles confèrent à chaque CDK une affinité spécifique pour sa cycline, déterminent la géométrie de l’interface d’interaction et participent à la spécificité fine de l’appariement cycline/CDK.
| CDK | Motif de reconnaissance |
Cycline associée |
Contexte fonctionnel |
|---|---|---|---|
| CDK1/ CDK2 |
PSTAIRE | Cyclines A, B, E |
Progression du cycle cellulaire (S, G2, M) |
| CDK4/ CDK6 |
PISSLRE | Cyclines D1, D2, D3 |
Contrôle du point de restriction G1 |
| CDK7 | PSSALRE | Cycline H |
|
| CDK8/ CDK19 |
PITALRE | Cycline C | Régulation transcriptionnelle via Mediator |
| CDK9 | PITAIRE | Cycline T, K | Élongation transcriptionnelle (P-TEFb) |
| CDK11 | PITSLRE | Cycline L |
|
| CDK12/ CDK13 |
PISSLRE/ PISALRE |
Cycline K |
|
Mécanisme d’activation allostérique
L’association d’une cycline à sa CDK n’est pas simplement un événement d’ancrage, mais induit une activation allostérique majeure de la kinase.
En l’absence de cycline, la CDK adopte une conformation catalytiquement inactive.
1. La liaison de la cycline entraîne une réorganisation structurale profonde de la CDK par une série d’événements coordonnés.
- La rotation conformationnelle de l'hélice αC, contenant le motif PSTAIRE (ou ses variantes), repositionne la lysine catalytique et le glutamate du motif dans une orientation favorable à la fixation de l’ATP, permettant la formation du pont ionique essentiel entre ces deux résidus.
- Le réarrangement de la boucle d’activation (T-loop) déplace celle-ci vers l’extérieur, ouvrant l’accès au site catalytique.
- L’ouverture du site de liaison à l’ATP rend la kinase compétente pour la phosphorylation de ses substrats.
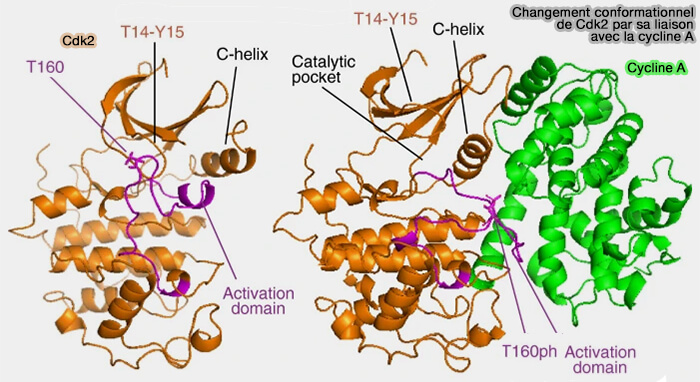
(Figure : vetopsy.fr d'après Malumbres)
2. La cycline transforme une CDK inactive en une enzyme catalytiquement opérationnelle, créant un environnement propice à la catalyse.
- La spécificité de substrat est ajustée par l’exposition de nouvelles surfaces de reconnaissance.
- La formation du complexe cycline/CDK stabilise la kinase et prolonge sa demi-vie fonctionnelle.
- Le motif PSTAIRE (et ses variantes) joue ici le rôle de signature structurale en couplant directement l’architecture tridimensionnelle du complexe à sa fonction enzymatique.
3. Ce principe est commun à toutes les hétérodimères cycline/CDK, bien que la dynamique précise varie selon la nature de la cycline et le contexte cellulaire :
- progression du cycle cellulaire via les ccomplexes cycline D/CDK4-6, cycline E/CDK2, cycline A/CDK2 et cycline B/CDK1 (MPF),
- contrôle transcriptionnel via cycline T/CDK9 ou cycline H/CDK7,
- réponse aux dommages de l’ADN via cycline K/CDK12-13,
- programmes de différenciation via CDK5 associée à p35/p39.

Les principales familles de cyclines et leurs fonctions sont résumées dans un tableau.
Spécificité de substrat
La spécificité de substrat des complexes cycline/CDK dépend en grande partie d’interactions de recrutement assurées par la cycline.
- Au-delà du site catalytique de la kinase, des domaines structuraux portés par la cycline recrutent les substrats grâce à des séquences consensus présentes sur ces derniers.
- Ces interactions permettent d’orienter la CDK vers une sous-population précise de cibles, modulant l’efficacité catalytique et le contexte fonctionnel de la phosphorylation.
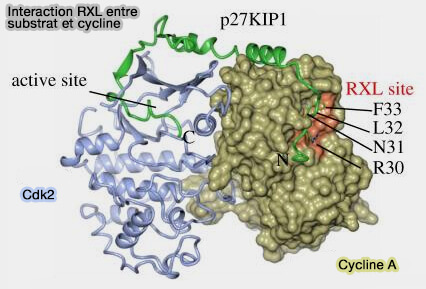
(Figure : vetopsy.fr d'après Wood et Endicott)
1. e motif RXL (Arg-X-Leu), également appelé Cy-motif (Cyclin-binding motif), constitue la principale signature de recrutement des substrats par les complexes cycline/CDK (Structural insights into the functional diversity of the CDK-cyclin family 2018).
a. Ce motif est localisé dans les substrats de nombreuses CDK, notamment CDK1, CDK2 et certains complexes impliquant CDK4.
Il s’insère dans une poche hydrophobe spécifique de la cycline, appelée Cyclin Recruitement Site (CRS) ou Cy-box, située sur le domaine N-terminal de la cycline.
Remarque : dans la figure, le motif FLNR de la cycline A contribue au site de docking (site Cy) impliqué dans la reconnaissance des substrats RXL, mais n’est pas universel à toutes les cyclines, la spécificité reposant avant tout sur la structure tridimensionnelle de la poche de liaison.
b. Le rôle fonctionnel du RXL-motif est multiple :
- stabiliser le substrat à proximité du site catalytique,
- ugmenter l’efficacité catalytique en favorisant une phosphorylation processive et en réduisant la dissociation enzyme-substrat,
- contribuer à la hiérarchisation temporelle des phosphorylations au cours du cycle cellulaire.
c. On peut citer quelques exemples : p27KIP1, p21CIP1, E2F, Rb, Cdc6…
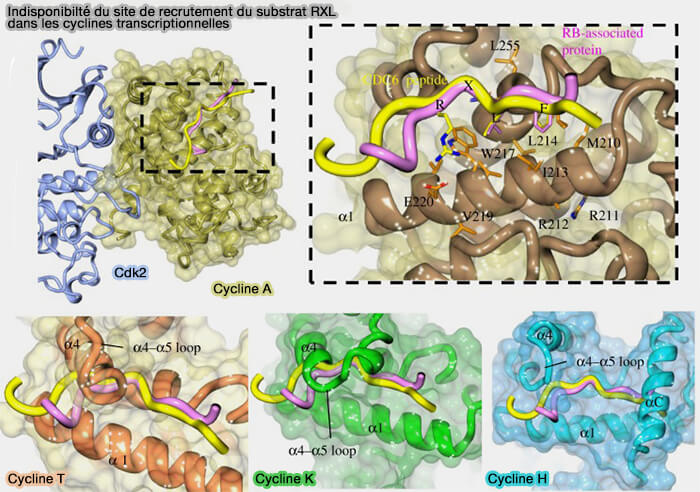
(Figure : vetopsy.fr d'après Wood et Endicott)
2. D’autres motifs participent également à l’interaction substrat-cycline et contribuent à définir une double spécificité.
a. Une spécificité enzymatique, déterminée par la reconnaissance par la CDK du motif consensus S/T-P présent sur ses substrats, permet de déterminer si cette protéine peut être phosphorylée et oriente la catalyse enzymatique vers des cibles spécifiques (
La présence du motif minimal S/T-P est nécessaire à la reconnaissance, mais des séquences étendues telles que S/T-P-X-K/R augmentent considérablement l’efficacité catalytique et contribuent à la spécificité des interactions substrat-CDK
b. Une spécificité structurale, assurée par la reconnaissance de motifs de recrutement tels que RXL par la cycline.
Remarque : le motif S/T-P permet à la CDK de reconnaître les sites de phosphorylation sur ses substrats, tandis que le motif PSTAIRE intervient dans la reconnaissance de la cycline et dans l’activation catalytique du complexe.

L’articulation entre reconnaissance enzymatique et structurale assure la spécificité des substrats et la précision des phosphorylations.
| Motif substrat | Description | Cycline concernée | Fonction principale |
|---|---|---|---|
| Spécificité enzymatique (reconnaissance par la CDK) | |||
| S/T-P | Sites de phosphorylation Pro-dirigés (CDK consensus S/T-P-X-K/R) | Tous complexes |
Reconnaissance du site catalytique CDK |
| Spécificité structurale (Recrutement par la cycline) | |||
| RXL (Cy-motif) |
Motif de recrutement majeur des substrats (Arg-X-Leu) | Cyclines A, B, E, D |
Ancrage du substrat à proximité du site catalytique |
| MRAIL | Motif hydrophobe conservé (Met-Arg-Ala-Ile-Leu) formant la poche d'accueil du RXL | Cyclines A, B, E | Surface de reconnaissance du substrat |
| LxF/FxD | Motif de liaison secondaire retrouvé dans des substrats transcriptionnels | Cyclines T, K, H | Ciblage des CDK transcriptionnelles |
| RxLxE | Variante étendue du RXL, renforçant la liaison par ponts salins | Cyclines mitotiques (A, B) | Stabilité accrue des complexes transitoires |
Modulation dynamique des interactions substrat-cycline
La liaison entre la cycline et ses substrats est finement régulée par des mécanismes post-traductionnels et compétitifs.
Cette régulation dynamique ajuste l’affinité, la spécificité et le moment de l’interaction, modulant une activation précise des phosphorylations.
1. La phosphorylation préalable du substrat peut masquer ou exposer le motif RXL.
Ce mécanisme modifie l’accessibilité du site de recrutement et contrôle ainsi la capacité du substrat à interagir avec la cycline.
2. Les CKI (CDK inhibitors) peuvent entrer en compétition avec les substrats pour l’accès au site de recrutement de la cycline.
- p27KIP1 ou p21CIP1 possèdent eux-mêmes un motif RXL, leur permettant d’occuper la poche de liaison de la cycline.
- Cette occupation empêche les substrats véritables de s’y fixer et contribue ainsi à l’inhibition fonctionnelle du complexe.
3. Des modifications post-traductionnelles de la cycline modulent sa capacité de reconnaissance.
La phosphorylation, l’acétylation ou l’ubiquitination peuvent altérer la conformation du site MRAIL ou de son environnement structural, modifiant ainsi l’affinité du complexe pour ses substrats.

Par leur interaction fine avec les CDK et leurs substrats, les cyclines orchestrent l’activation, la spécificité et le rythme des phosphorylations, ce qui constitue un niveau majeur de régulation fonctionnelle des complexes cycline/CDK.
Retour vers les CDK ou les cyclines
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


