Complexe APC/C
Cdh1 : coactivateur post-mitotique
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Cdh1 prend le relais de Cdc20 après l’anaphase, prolongeant l’activité de l’APC/C pour stabiliser la sortie de mitose et instaurer l’état G1.
L’APC/C requiert des cofacteurs temporaires pour sa pleine activité :
- Cdc20 (Cyclosome division cycle 20), actif pendant la métaphase-anaphase,
- Cdh1 (Cdc20 homolog 1), actif durant la fin de mitose et la phase G1.
Ces coactivateurs confèrent à l’APC/C sa spécificité de substrat et sa régulation temporelle, assurant la succession ordonnée des événements de dégradation indispensables à la progression mitotique et à la transition vers la phase G1.

L'organisation générale des coactivateurs Cdc20 et Cdh1 est étudiée dans un chapitre spécifique.
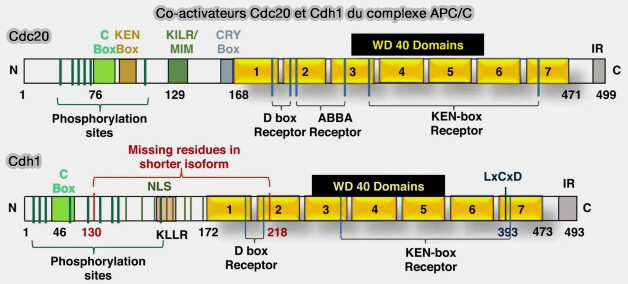
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Cdh1, coactivateur post-mitotique du complexe APC/C
Vue d'ensemble
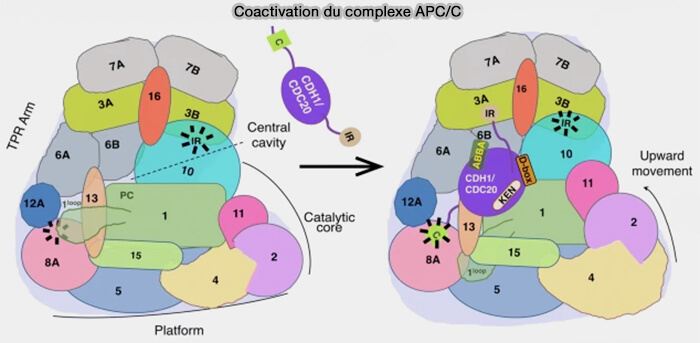
(Figure : vetopsy.fr d'après Bansal et Tiwari)
1. Cdh1 (Cdc20 homolog 1) prend le relais de Cdc20 à la fin de la mitose en maintenant l’activité de l’APC/C durant la sortie de mitose et la phase G1 pour :
- abaisser durablement l’activité CDK,
- favoriser la sortie de mitose,
- stabiliser un état G1 propice à la réplication ultérieure.
Cette transition marque le passage d’un système de dégradation rapide et déclencheur typique de Cdc20 à un mécanisme plus stabilisateur et sélectif, destiné à réinitialiser le cycle cellulaire après la division.
2. En phase mitotique, Cdh1 est maintenue inactive par phosphorylation de nombreux sites induite par la cycline B/CDK1.
a. Les résidus sérine/thréonine voisines du motif KLLR, situés dans la région intermédiaire de son extrémité N-terminale, i.e. Ser40, Thr121, Ser151 selon les espèces, perturbent les interactions ioniques stabilisant cette interface.
Les groupements phosphates introduisent une charge négative qui repousse électrostatiquement les surfaces chargées de l’APC/C et masque la C-box et le KLLR, empêchant leur reconnaissance simultanée par le module TPR, i.e. APC8 et APC3.
b. Ainsi, cette modification post-traductionnelle verrouille Cdh1 dans un état auto-inhibé, équivalent fonctionnellement à celui observé pour Cdc20 lors de la métaphase, mais maintenu jusqu’à la désactivation de CDK1 (
c. Sous cette forme, Cdh1 reste cytoplasmique ou faiblement associée à la fraction soluble du complexe, mais ne peut se fixer ni au noyau ni au cœur catalytique de l’APC/C.
3. En parallèle, la phosphorylation des sous-unités APC3, APC6 et APC8 par la cycline B/CDK1 favorise l’association de Cdc20, car elle crée des interfaces reconnues par ses domaines WD40 et stabilise l’état catalytique spécifique de l’APC/CCdc20.
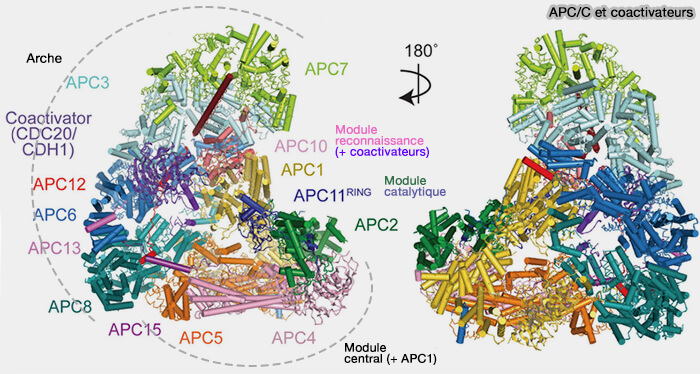
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Activation de Cdh1
L’activation de Cdh1 repose sur deux mécanismes étroitement coordonnés qui interviennent à la fin de la mitose :
- la diminution rapide de l’activité CDK1, consécutive à la dégradation des complexes cycline B/CDK1 par l’APC/CCdc20,
- la déphosphorylation sélective de Cdh1 et de plusieurs sous-unités du complexe assurée principalement par les phosphatases PP2A-B55 et PP1.
1. La dégradation séquentielle des complexes cycline B/CDK1, déclenchée par l’APC/CCdc20, provoque une chute brutale de l’activité kinase qui entretenait l’état phosphorylé de Cdh1 et du cœur de l’APC/C.
- Lorsque la concentration en cycline B diminue, les phosphorylations de Cdh1 et de la plateforme TPR (APC3, APC6, APC8) cessent d’être renouvelées et les groupements phosphates sont progressivement retirés.
- Ce relâchement du contrôle kinase constitue la condition préalable à la réactivation du complexe.
2. De plus, la déphosphorylation des sites de Cdh1 et des sous-unités de l’APC/C repose alors principalement sur l’action des phosphatases PP2A-B55 et PP1, dont l’activité augmente à mesure que CDK1 s’effondre en fin de mitose.
Cette déphosphorylation restaure la capacité de Cdh1 à se lier à la plateforme TPR et permet la transition vers l’APC/CCdh1, actif en G1.
a. chez Saccharomyces cerevisiae, la phosphatase Cdc14, qui se libère du nucléole après l’anaphase, déphosphoryle les sites de Cdh1, ainsi que des sous-unités phosphorylées de l’APC/C (The Multiple Roles of the Cdc14 Phosphatase in Cell Cycle Control 2020).
- Cette libération de Cdc14 dépend des réseaux FEAR (Cdc fourteen Early Anaphase Release) et MEN (Mitotic Exit Network), qui orchestrent la sortie de mitose.
- Chez les mammifères, aucun équivalent fonctionnel direct n’existe ; ces rôles sont assurés par PP2A-B55 et PP1.
b. Chez les mammifères, les phosphatases Cdc14A et Cdc14B possèdent des rôles confirmés dans la réparation de l’ADN, la stabilité du fuseau et la dynamique des centrosomes (Mammalian CDC14 phosphatases control exit from stemness in pluripotent cells 2022).
Toutefois, contrairement à la levure, elles ne réactivent pas l’APC/CCdh1 et ne déphosphorylent pas Cdh1 lors de la sortie de mitose.
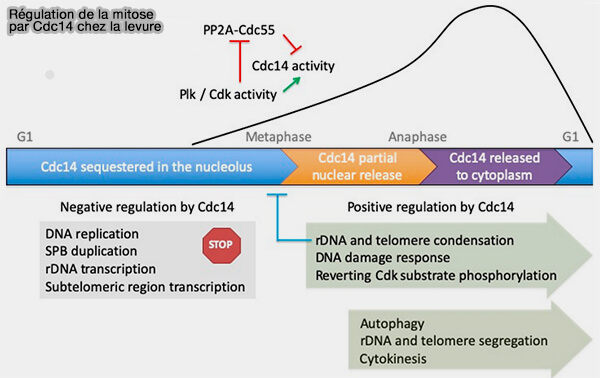
(Figure : vetopsy.fr d'après Manzano-López et Monje-Casas)
3. Cette déphosphorylation coordonnée du coactivateur et du cœur catalytique induit un basculement structural :
- Cdh1 adopte une " conformation ouverte " exposant la C-box et le motif KLLR.
- les interfaces TPR d’APC3, d'APC6 et d'APC8 recouvrent leur charge positive, redevenant compétentes pour l’ancrage. sur le cœur catalytique du complexe.

Le complexe APC/C passe ainsi de l’état inactif à la forme active APC/CCdh1, capable de recruter de nouveaux substrats post-mitotiques. pour leur dégradation.
Fonctions de Cdh1 dans la sortie de mitose et la stabilisation de G1
Une fois fixé sur le cœur catalytique, Cdh1 maintient la cellule dans un état de faible activité CDK, empêchant toute réentrée prématurée en mitose et stabilisant le programme post-mitotique, préalable à la réplication de l’ADN du cycle suivant.
1. En prolongeant la fonction de l’APC/C au-delà de l’anaphase, le complexe APC/CCdh1 devient le principal régulateur de la sortie de mitose et de la mise en place du programme de G1.
Son action repose sur la dégradation sélective et chronologique de substrats post-mitotiques, assurant la désactivation progressive des processus mitotiques tout en rétablissant un environnement compatible avec la G1.
2. Le début de la sortie de mitose, i.e. fin d’anaphase/début de télophase, est déclenché par l'ubiquitination de plusieurs kinases.
- Celle d'aurora A désactive la machinerie mitotique et arrête la nucléation des microtubules au niveau des centrosomes.
- Celle d'aurora B dissout le fuseau central et désassemble le complexe du sillon de cytokinèse.
- Celle de Plk1 réorganise le cytosquelette d’actine et stabilise la cytokinèse.
3. La transition vers la phase G1 est induite par la dégradation de Cdc20 qui met fin à l’activité de l’APC/CCdc20 et clôt la phase mitotique, ouvrant la voie à l’activation complète de Cdh1 (
4. L'établissement du programme de G1 dépend ensuite de la dégradation sélective de plusieurs substrats tardifs :
- la géminine, dont la destruction empêche tout re-licensing prématuré des origines de réplication et garantit une seule duplication du génome par cycle ;
- les régulateurs Skp2 et Cks1, dont l’élimination favorise l’accumulation des inhibiteurs de CDK et le maintien d’une faible activité kinase caractéristique de la phase G1.

Par cette succession ordonnée de dégradations, Cdh1 assure la désactivation complète des fonctions mitotiques, la reconstruction du cytosquelette interphasique, la stabilité du génome et la préparation de la cellule à un nouveau cycle de réplication.
Régulation de l’activité
L’activité de Cdh1 est soumise à une régulation hiérarchisée qui assure son activation exclusive après la séparation des chromosomes et sa désactivation contrôlée avant l’entrée en phase S.
L’activité de Cdh1 est régulée par plusieurs mécanismes successifs qui garantissent sa spécificité temporelle et préviennent toute activation prématurée du complexe APC/CCdh1.
Phosphorylation/déphosphorylation
1. L’activation de Cdh1 dépend d’un équilibre dynamique entre la phosphorylation par CDK1 et la déphosphorylation progressive assurée en fin de mitose.
a. En métaphase, la cycline B/CDK1 maintient Cdh1 sous forme phosphorylée, incapable de se lier au cœur catalytique de l’APC/C.
b. Après l’anaphase, la chute rapide de l’activité CDK1 et l’action combinée des phosphatases PP2A-B55 et PP1 permettent la déphosphorylation de Cdh1, qui s’associe alors de manière stable au complexe, déclenchant la formation d’un APC/CCdh1 pleinement actif.
Ce mécanisme de bascule assure que Cdh1 ne s’active qu’une fois les chromosomes correctement séparés.
2. En situation de dommages à l’ADN ou de réplication incomplète, la voie voie ATR-Chk1 et ATM/Chk2 empêche l’activation de Cdh1 via une inhibition indirecte mais robuste, reposant sur l’activation de kinases relais (
- Plk1,
- CDK2 (lorsque les dégâts ne bloquent pas totalement la phase S),
a. Ces kinases phosphorylent Cdh1 sur des sérine inhibitrices multiples entraînant :
- sa dissociation du noyau,
- la perte d’affinité pour APC/C, i.e. empêchant la formation du complexe APC/CCdh1
b. Cdh1 ne peut donc plus servir de frein au cycle tant que les anomalies persistent, ce qui stabilise les substrats précoces, notamment les cyclines B1/B2, Aurora A, Plk1, Cdc20 et la géminine, empêchant toute entrée prématurée en mitose.
Stabilité du complexe
Le niveau de Cdh1 est soumis à une régulation temporelle de stabilité, qui limite sa présence à la phase post-mitotique et conditionne la durée d’activité de l’APC/CCdh1.
1. En début de G1, Cdh1 est stable et étroitement associé au complexe APC/C, assurant la dégradation des substrats résiduels de la mitose et le maintien d’un faible niveau de CDK.
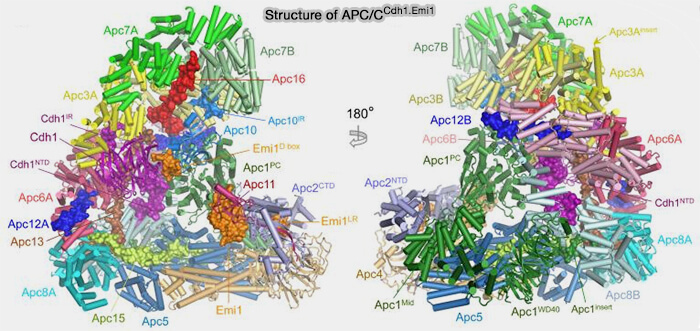
(Figure : vetopsy.fr d'après Bansal et Tiwari)
2. Au fur et à mesure que la cellule progresse vers la G1 tardive, l’expression d’EMI1 (Early Mitotic Inhibitor 1) augmente (Examining the mechanistic relationship of APC/CCDH1 and its interphase inhibitor EMI1 2022).
a. L’extrémité C-terminale d’EMI1 s’associe directement au complexe APC/CCdh1 par plusieurs interfaces synergiques.
- Sa pseudo-D-box (RxxLxxI) s’insère dans la même poche de reconnaissance de Cdh1 qu’un substrat réel, agissant comme un leurre compétitif et bloquant l’accès des véritables substrats.
- Sa KEN-box renforce cet ancrage en interagissant avec la sous-unité APC10, stabilisant la position d’EMI1 sur la plateforme de liaison du substrat.
- Son motif ZBR (Zinc-Binding Region) interagit avec le module catalytique APC2-APC11, ce qui empêche la conjugaison de l’ubiquitine.
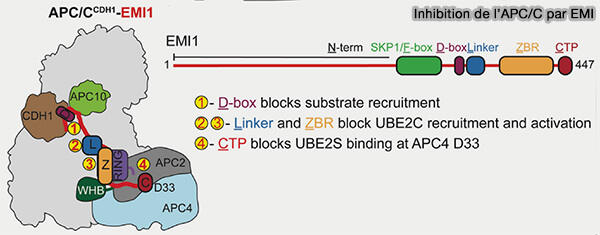
(Figure : vetopsy.fr d'après Bohlhuis et coll)
b. Par ce triple ancrage, EMI1 stabilise l’APC/CCdh1 dans une conformation verrouillée qui mime la présence d’un substrat tout en figeant Cdh1 dans un état inactif (Cryo-EM structures of apo-APC/C and APC/CCDH1:EMI1 complexes provide insights into APC/C regulation 2024).
c. Cette inhibition transitoire empêche la dégradation prématurée des cyclines A et E, nécessaires à la transition G1/S, et prépare la cellule à la réactivation du cycle en neutralisant temporairement la fonction ligase de l’APC/C.

(Figure : vetopsy.fr d'après Michael et Taylor)
3. En fin de G1, l’extinction de l’activité l’APC/CCdh1 repose sur deux mécanismes ubiquitine-dépendants complémentaires.
a. D’une part, l’activation progressive de la cycline F conduit à la formation du complexe SCFcycline F, qui cible Cdh1 pour sa dégradation lorsque la cellule approche de la transition G1/S.
Ce mécanisme contribue à lever la contrainte exercée par APC/CCdh1 et favorise l’engagement en phase S.
b. D’autre part, une fois la phase S initiée, la phosphorylation de Cdh1 par Chk1 crée un phospho-dégron reconnu par SCFβ-TrCP (Chk1-mediated phosphorylation of Cdh1 promotes the SCFβTRCP-dependent degradation of Cdh1 during S-phase and efficient cell-cycle progression 2020)..
- Le complexe SCFβ-TrCP recrute alors Cdh1 phosphorylée via son domaine WD40, catalyse sa polyubiquitination et la dirige vers le protéasome pour dégradation.
- Cette dégradation séquentielle de Cdh1, d’abord par SCFcycline F, puis par SCFβ-TrCP, est indispensable pour désactiver APC/CCdh1, permettre l’accumulation des cyclines A et E et assurer une entrée efficace en phase S.
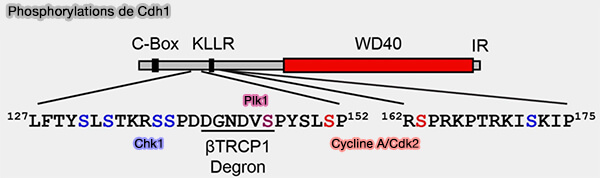
(Figure : vetopsy.fr d'après Pal et coll)
| Moment du cycle | État de Cdh1 | Mécanismes moléculaires | Conséquences fonctionnelles |
|---|---|---|---|
| Fin de mitose |
Activation |
|
|
| G1 précoce |
Cdh1 pleinement actif |
|
|
| Fin de G1 | Début d’inactivation |
Accumulation de cycline F ➞ formation de SCFcycline F ciblant Cdh1 |
|
| Transition G1 ➞ S |
Inactivation croissante |
CDK2 (cycline E/A) phosphorylent Cdh1 ➞ perte d’affinité pour APC/C |
|
| Début de phase S |
Dégradation accélérée |
Chk1 phosphoryle Cdh1 ➞ phospho-dégron reconnu par SCFβ-TrCP |
|
| Phase S engagée |
Cdh1 absent/ inactif |
|
|
| G2/Mitose | Cdh1 maintenu inactif |
|
Prévention de toute réactivation inappropriée d’APC/C |
| Sortie de mitose suivante |
Réactivation |
|
|
Conclusion sur Cdh1 et CDC20
Cdc20 et Cdh1 se relaient successivement pour assurer la continuité fonctionnelle de l’APC/C tout au long de la mitose et de la transition vers la phase G1.
- Ce relais temporel orchestre la chronologie des ubiquitinations mitotiques, depuis la dégradation rapide et déclencheuse des substrats de la métaphase par APC/CCdc20, jusqu’à l’action plus sélective et stabilisatrice de Cdh1 en sortie de mitose.
- Par cette succession ordonnée, Cdh1 prolonge l’activité du complexe et garantit un rééchelonnage des spécificités de degrons, accompagnant la bascule conformationnelle de l’APC/C et la réorganisation du cycle cellulaire de la mitose vers la G1.


