Complexe APC/C
Organisation générale des coactivateurs Cdc20 et Cdh1
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les coactivateurs Cdc20 et Cdh1, protéines WD40 adaptatrices de l’APC/C, assurent la reconnaissance structurée des substrats et la régulation temporelle de l’ubiquitination mitotique.
L’APC/C requiert des cofacteurs temporaires pour sa pleine activité :
- Cdc20 (Cyclosome division cycle 20), actif pendant la métaphase-anaphase,
- Cdh1 (Cdc20 homolog 1) actif durant la fin de mitose et la phase G1.
| Paramètre | Cdc20 | Cdh1 |
|---|---|---|
| Moment d’expression maximal |
G2-mitose | Fin de mitose-G1 |
| Activation principale |
|
|
| Coactivateur de |
APC/CCdc20 (prométaphase anaphase) |
APC/CCdh1 (sortie de mitose et G1) |
| Inhibition en G2-M |
Phosphorylations inhibitrices (CDK et MCC - MAD2/ BUBR1/BUB3 -) |
Hyperphosphorylation par CDK1/2 (pas d’activation possible avant la mitose tardive) |
| Blocage spécifique |
SAC/MCC séquestrent Cdc20 |
|
| Déclencheur d’activation |
Attachement bipolaire des chromosomes ➞ extinction SAC |
Sortie de mitose ➞ chute CDK1/cycline B |
| Fonction principale |
Dégradation de la sécurine et des cyclines B ➞ déclenchement de l’anaphase |
Dégradation des facteurs pro-S (Skp2, Geminin) ➞ tabilisation du G1 |
| Dégradation du coactivateur |
|
|
| Rôle dans la transition |
Active la séparation des chromatides |
Prépare la transition G1 ➞ S |
| Rôle dans la stabilité génomique |
Correct attachement des kinétochores ➞ prévention de l’aneuploïdie |
|
| Interconnexion avec SCF |
Dégradation par SCF via autoubiquitination assistée |
Dégradé par SCFcycline F + SCFβ-TrCP |
| Retour à l’état actif |
Cycle suivant : réaccumulation en G2 |
Cycle suivant : déphosphorylation en fin de mitose |
Ces coactivateurs confèrent à l’APC/C sa spécificité de substrat et sa régulation temporelle, assurant la succession ordonnée des événements de dégradation indispensables à la progression mitotique et à la transition vers la phase G1.
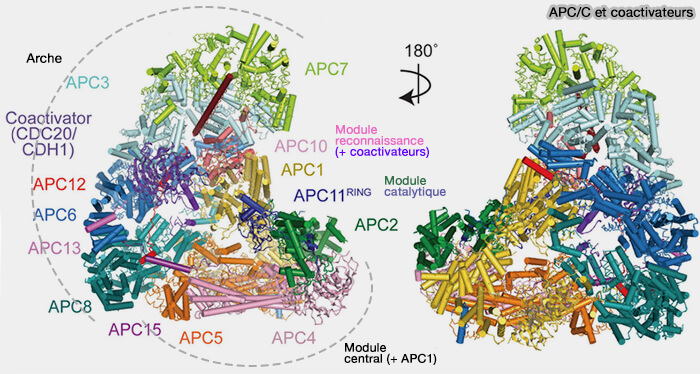
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Structure des coactivateurs Cdc20 et Cdh1
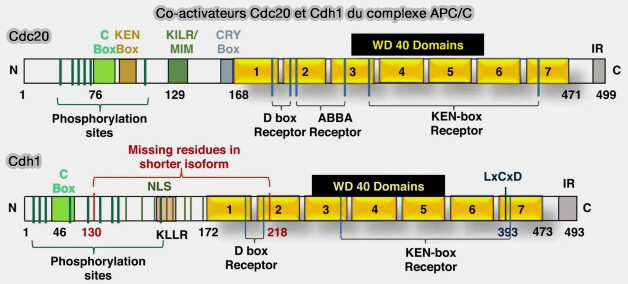
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Domaines WD40
Les coactivateurs Cdc20 et Cdh1 appartiennent à la famille des protéines WD40, caractérisées par la présence d’environ sept répétitions WD formant une structure en propeller β.

Le domaine WD est étudié dans un chapitre spécifique.
Cette architecture crée une surface concave adaptée à la reconnaissance des motifs de dégrons, i.e. D-box, KEN-box et motif ABBA portés par les substrats.
Les coactivateurs agissent comme des récepteurs adaptateurs, identifiant les signaux de dégradation présents sur les protéines cibles, et orientant ces substrats vers le site catalytique du complexe APC/C.
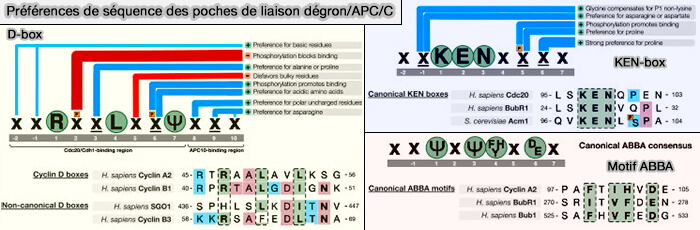
(Figure : vetopsy.fr d'après Davey et Morgan)
Extrémité N-terminale
Structure commune
1. L'extrémité N-terminale des coactivateurs, d’environ 200 à 250 résidus, est intrinsèquement flexible et peu structurée en l’absence du complexe et contient plusieurs motifs régulateurs conservés qui orchestrent l’interaction dynamique du coactivateur avec l’APC/C.
a. Cette région établit des contacts transitoires avec les sous-unités APC3 et APC8, deux composants de l’arche TPR (tetratricopeptide repeat) du complexe, qui servent de plateformes d’ancrage pour les coactivateurs.
Cette zone N-terminale s’enroule partiellement autour de l’arche TPR, créant un réseau d’interactions hydrophobes et ioniques qui stabilisent l’association initiale du coactivateur.
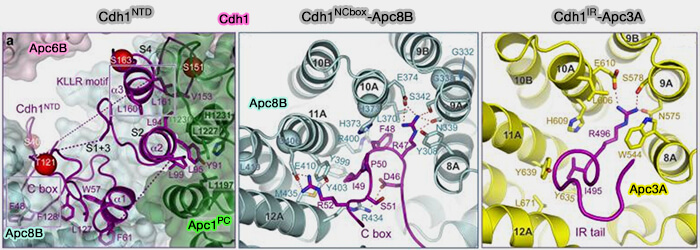
(Figure : vetopsy.fr d'après Chang et coll)
b. Le degré de flexibilité intrinsèque de la région N-terminale varie entre les deux coactivateurs.
- Celle de Cdc20 est plus flexible et désordonnée en l’absence de l’APC/C, adoptant une structure partiellement stabilisée seulement lors de son ancrage à APC8 et APC3.
- Celle de Cdh1, en revanche, présente une conformation plus compacte et un repliement local stabilisé par des interactions intramoléculaires, ce qui favorise une association plus stable avec l’APC/C et une activité prolongée pendant la phase G1.
2. L’extrémité N-terminale comprend un motif C-box (Cdc20-box), i.e. résidus 77-84 de Cdc20, essentiel pour la fixation au cœur du complexe, en interagissant dans une cavité de APC8 (Mechanisms for the temporal regulation of substrate ubiquitination by the anaphase-promoting complex/cyclosome 2019).
a. Elle initie la capture et favorise la transition vers un état “ ouvert ” apte au recrutement du substrat.
Elle est indispensable pour former un APC/C-coactivateur compétent catalytiquement car son altération abolit l’activation.
b. L'exposition de la C-box varie entre les deux coactivateurs.
- Chez Cdc20, ce motif est plus exposé et dynamique, facilitant une interaction transitoire avec APC8 compatible avec une activation rapide et temporaire en mitose.
- Chez Cdh1, la C-box est enfouie dans une boucle plus rigide, ce qui stabilise la liaison au complexe et contribue à la persistance du mode APC/CCdh1 après l’anaphase.
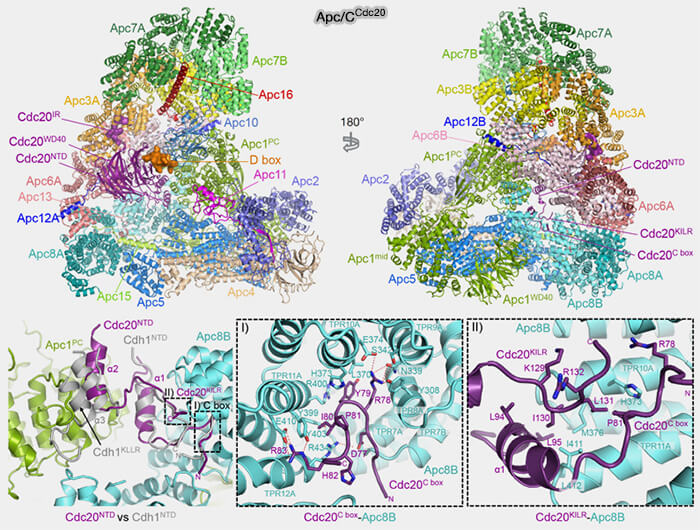
(Figure : vetopsy.fr d'après Zhang et coll)
3. La région intermédiaire, entre la C-box et le domaine WD40, des coactivateurs contient des motifs courts à polarité basique.
a. Ils participent à la stabilisation de leur ancrage sur la plateforme TPR de l’APC/C.
- Chez Cdc20, le motif KILR (Lys-Ile-Leu-Arg) interagit principalement avec APC8 et joue un rôle déterminant dans l’activation du complexe durant la métaphase (Taming the beast: control of APC/CCdc20-dependent destruction 2017).
- Chez Cdh1, le motif KLLR, de topologie similaire, établit des contacts plus durables avec APC1 et APC5, contribuant à la stabilité prolongée du complexe en phase G1 (Molecular mechanism of APC/C activation by mitotic phosphorylation 2016).
b. Ces deux motifs sont soumis à une régulation par phosphorylation dépendante de CDK1.
- En mitose, CDK1 phosphoryle des sérines/thréonines voisines du motif, inhibant la liaison au complexe APC/C et empêchant toute activation prématurée.
- À la sortie de mitose, la chute de l’activité cycline B/CDK1 et la déphosphorylation progressive assurée principalement par PP2A-B55 et PP1 rétablissent l’interaction électrostatique avec les sous-unités du module TPR et activent l’association du coactivateur.
Chez la levure, la déphosphorylation par la phosphatase Cdc14 restaure la charge positive locale de la région.
4. La Box1 est située dans la région N-terminale, juste en aval de la C-box et constitue un second site d’ancrage entre le coactivateur et le module TPR de l’APC/C, notamment avec APC6 et APC8.
a. Chez Cdc20, la Box1 participe à la stabilisation transitoire du complexe APC/CCdc20 durant la métaphase.
- Elle agit en synergie avec la C-box, renforçant l’association initiale avec le module TPR, avant que le MIM/KILR n’assure le verrouillage complet.
- Cette interaction reste toutefois labile, cohérente avec la fonction temporaire de Cdc20 comme coactivateur mitotique.
b. Chez Cdh1, la Box1 est plus structurée.
- Elle forme une hélice amphipathique stabilisée par des interactions intramoléculaires et contribue à la fixation durable au module TPR.
- Combinée à la queue IR, elle confère à APC/CCdh1 une stabilité post-mitotique prolongée, essentielle au maintien du complexe actif pendant la phase G1.
c. La Box1 de Cdc20 et celui de Cdh1 sont régulés par phosphorylation CDK1-dépendante.
- Phosphorylée, elle provoque une perte d’affinité pour la plateforme TPR.
- Déphosphorylée, elle rétablit un ancrage stable sur la plateforme TPR, permettant l’association productive du coactivateur avec l’APC/C.
Différences structurales entre Cdc20 et Cdh1
Cdc20 possède plusieurs motifs spécifiques qui ne sont pas retrouvés chez Cdh1.
1. Un motif CRY-box (Cys-Arg-Tyr) est aujourd’hui considéré comme une variante fonctionnelle ou un équivalent partiel du motif ABBA (Functional analysis of Cdc20 reveals a critical role of CRY box in mitotic checkpoint signaling 2024).
a. Le motif CRY agit comme un élément de reconnaissance secondaire permettant d’optimiser l’orientation du substrat porteur de D-box ou KEN-box sur le site de liaison de l’APC/C.
- Il stabilise transitoirement le complexe APC/CCdc20-substrat en créant un pont électrostatique entre la surface basique de Cdc20 et le sillon latéral d’APC3/APC8, contribuant à la mise en place de la conformation " ouverte " active du complexe.
- Ainsi, la CRY-box n’interagit pas directement avec l’ABBA du substrat, mais pré-organise la conformation du propeller WD40 pour en améliorer la reconnaissance.
2. Cdc20 contient un domaine MIM (Mad2-interacting motif), appelé aussi MBM (Mad2-Binding Motif) pour l'interaction avec O-Mad2.
Remarque : le motif KILR de Cdc20 se trouve au centre du domaine MIM.
- Outre l'ancrage à APC8, lors du checkpoint mitotique (SAC), le KILR reconnaît la cavité d’interaction de O-Mad2, initiant la formation du pré-complexe MCC (C-Mad2-Cdc20).
- Tant que les résidus sérine/thréonine voisines sont phosphorylés, Mad2 ne peut pas se lier et l’ancrage à APC8 est affaibli, empêchant l’activation prématurée de l’APC/C avant la levée du SAC.
Extrémité C-terminale
1. À l'extrémité C-terminale, un motif IR-tail (Isoleucine-Arginine) se fixe dans une cavité du sous-complexe APC3-APC6, renforçant la stabilité de la liaison (
Ces motifs IR sont présents dans les sous-unités du module TPR.
2. Cette disposition permet au domaine WD40 de liaison du substrat des coactivateurs d’être flexible dans sa position en fonction des partenaires de liaison.
La similitude structurelle de la région de liaison C-box d’APC8 et des régions de liaison IR-tail d’APC3 est importante pour la régulation fonctionnelle de l’APC/C par le complexe de point de contrôle mitotique (MCC), qui se lie au complexe APC/C via l’interaction de la queue IR du Cdc20 avec la C-box d’APC8.
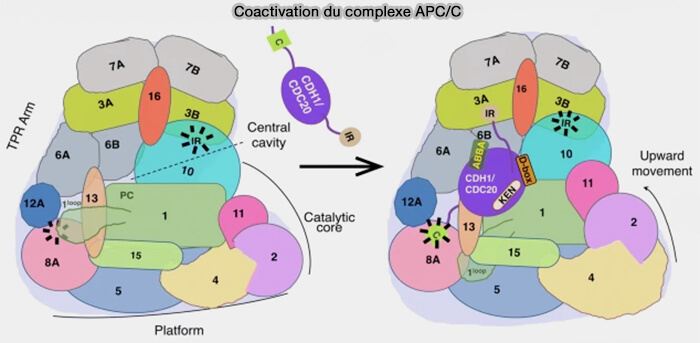
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Interaction coactivateurs/APC10
1. En parallèle, les coactivateurs s’associent à APC10 pour former un module de co-reconnaissance du substrat, disposé à proximité immédiate du site catalytique APC2-APC11.
Les reconstructions cryo-EM à haute résolution ont révélé que le propeller WD40 du coactivateur et la sous-unité APC10 encadrent le substrat selon une géométrie en pince, créant une poche bivalente de stabilisation.
a. Le substrat est ainsi maintenu par un pontage double :
- la face concave du domaine WD du coactivateur interagit directement avec le dégron, i.e. D-box, KEN-box et motif ABBA du substrat,
- APC10 établit un contact complémentaire avec une région peptidique du substrat adjacente au dégron, stabilisant son ancrage dans la poche de reconnaissance formée avec le coactivateur et orientant la lysine cible vers le site catalytique du complexe.
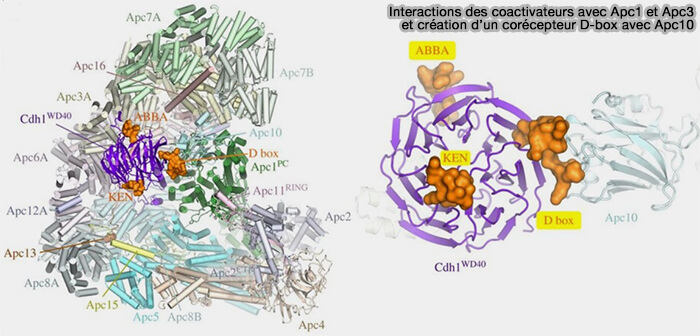
(Figure : vetopsy.fr d'après Alfieri et coll)
b. La disposition relative du propeller WD40 et d’APC10 diffère légèrement selon le coactivateur engagé.
- Dans APC/CCdc20, le propeller est orienté à un angle d’environ 25-30° par rapport à APC10, configuration ouverte favorisant un accès rapide aux substrats porteurs de D-box.
- Dans APC/CCdh1, l’angle est réduit à ~15°, rapprochant le propeller d’APC10 et formant une poche plus compacte, mieux adaptée à la reconnaissance des KEN-box et ABBA motifs.
c. Ce système coopératif, souvent décrit comme un " double verrou de reconnaissance ”, permet un positionnement précis du substrat face au module catalytique APC2-APC11, garantissant l’ubiquitination séquentielle et processive.
2. Cette organisation modulaire permet à l’APC/C de basculer entre des états conformationnels ouverts et fermés, modulant l’accès des substrats selon le coactivateur engagé (Cdc20 ou Cdh1).

Par la modulation de l’angle et de la position de leurs propellers WD40, les coactivateurs orchestrent la succession ordonnée des ubiquitinations, au cours de la mitose pour Cdh1 et de la sortie de mitose pour Cdc20.
Succession fonctionnelle des coactivateurs Cdc20 et Cdh1
Cdc20 et Cdh1 agissent de manière séquentielle pour assurer la continuité fonctionnelle de l’APC/C au cours du cycle cellulaire.
- Cdc20, actif durant la métaphase-anaphase, déclenche la dégradation rapide de la sécurine et des cyclines mitotiques, conditionnant la séparation des chromatides.
- Cdh1 prend le relais en sortie de mitose, prolongeant l’activité du complexe pour éliminer les substrats post-mitotiques, stabiliser la phase G1 et préparer la cellule à un nouveau cycle.

Le rôle de Cdc20 et le rôle de Cdh1 sont étudiés dans leur chapitre spécifique.
| Paramètre | Cdc20 | Cdh1 |
|---|---|---|
| Moment d’expression maximal |
G2-mitose | Fin de mitose-G1 |
| Activation principale |
|
|
| Coactivateur de |
APC/CCdc20 (anaphase) | APC/CCdh1 (sortie de mitose et G1) |
| Inhibition en G2-M |
Phosphorylations inhibitrices (CDK et MCC - MAD2/ BUBR1/BUB3 -) |
Hyperphosphorylation par CDK1/2 (pas d’activation possible avant la mitose tardive) |
| Blocage spécifique |
SAC/MCC séquestrent Cdc20 |
|
| Déclencheur d’activation |
Attachement bipolaire des chromosomes ➞ extinction SAC |
Sortie de mitose ➞ chute CDK1/cycline B |
| Fonction principale |
Dégradation de la sécurine et des cyclines B ➞ déclenchement de l’anaphase |
Dégradation des facteurs pro-S (Skp2, Geminin) ➞ tabilisation du G1 |
| Dégradation du coactivateur |
|
|
| Rôle dans la transition |
Active la séparation des chromatides |
Prépare la transition G1 ➞ S |
| Rôle dans la stabilité génomique |
Correct attachement des kinétochores ➞ prévention de l’aneuploïdie |
|
| Interconnexion avec SCF |
Dégradation par SCF via autoubiquitination assistée |
Dégradé par SCFcycline F + SCFβ-TrCP |
| Retour à l’état actif |
Cycle suivant : réaccumulation en G2 |
Cycle suivant : déphosphorylation en fin de mitose |
Implications biologiques et pathologiques
La régulation fine de Cdc20 et Cdh1 est essentielle au maintien de la stabilité génomique et à la progression ordonnée du cycle cellulaire (The Role of the APC/C and Its Coactivators Cdh1 and Cdc20 in Cancer Development and Therapy 2022).
1. Cdc20, déterminant de la ségrégation chromosomique, est fréquemment surexprimé dans les cancers (sein, poumon, côlon).
a. Cette surexpression favorise :
- l'instabilité chromosomique,
- la progression mitotique aberrante,
- la résistance au blocage du SAC.
b. Cdc20 est une cible thérapeutique privilégiée pour les stratégies antimitotiques et de sensibilisation (CDC20: a novel therapeutic target in cancer 2023).
2. À l’inverse, Cdh1 agit comme un frein tumoral et un gardien de la quiescence.
a. Sa perte ou sa dérégulation entraîne :
- une prolifération incontrôlée,
- une re-réplication de l’ADN,
- une aneuploïdie, i.e. nombre de chromosomes incorrect.
b. Les études récentes confirment également son rôle dans :
- la différenciation neuronale (APC/C-Cdh1-targeted substrates as potential therapies for Alzheimer’s disease 2022),
- la réponse au stress oxydatif,
- la préservation de la stabilité du génome en G1 (Regulation of APC/C-Cdh1 and Its Function in Neuronal Survival 2012).
La compréhension de ces deux coactivateurs, à la fois complémentaires et antagonistes, ouvre des perspectives majeures en oncologie moléculaire et en pharmacologie du cycle cellulaire, notamment pour le développement de modulateurs spécifiques du complexe APC/C.


