Dégradation des protéines
Dégrons internes et autres signaux d’ubiquitination
Dégrons du cycle cellulaire
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les dégrons du cycle cellulaire contrôlent la dégradation séquentielle des régulateurs mitotiques, garantissant l’ordre et la synchronisation des phases du cycle.
Vue d'ensemble
Les dégrons internes associés au cycle cellulaire sont des motifs essentiels qui assurent la dégradation temporellement contrôlée de protéines clés afin d’orchestrer la progression ordonnée des différentes phases.
1. Leur reconnaissance par des complexes ubiquitine-ligases, en particulier l’APC/C (Anaphase Promoting Complex/Cyclosome) :
- garantit l’activation ou l’inactivation séquentielle des régulateurs du cycle,
- prévient l’accumulation inappropriée de protéines à des stades critiques.

Ces dégrons agissent comme des interrupteurs moléculaires, coordonnant la destruction sélective des régulateurs du cycle cellulaire (Building a Regulatory Network with Short Linear Sequence Motifs: Lessons from the Degrons of the Anaphase-Promoting Complex 2016).
2. Ils déterminent la demi-vie de nombreux régulateurs essentiels, comme les cyclines, les activateurs ou inhibiteurs de CDK ou les protéines de cohésion , en contrôlant leur élimination au moment opportun.
Cette régulation fine conditionne le passage irréversible d’une phase à l’autre et contribue à la robustesse de l’horloge mitotique.
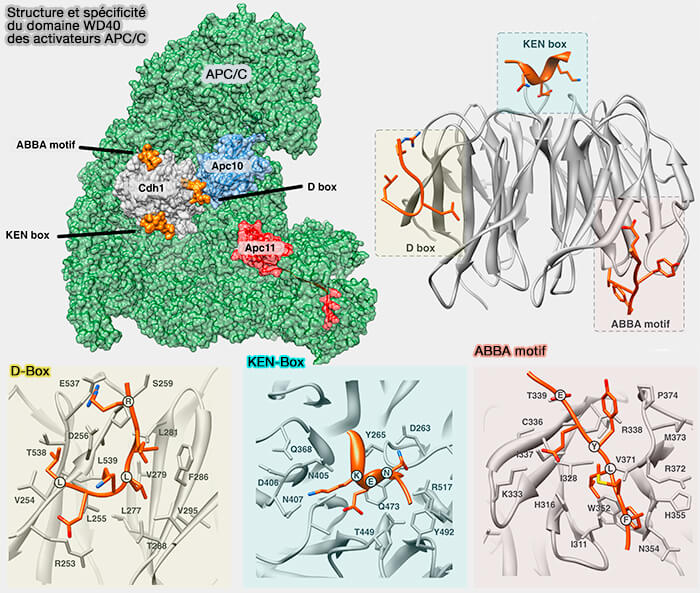
(Figure : vetopsy.fr d'après Davey et Morgan)
D-box (Destruction box)
La D-box est caractérisée par le motif RxxLxxxxN souvent localisée dans une région désordonnée de la protéine, accessible aux ligases (Development of D-box peptides to inhibit the anaphase-promoting complex/cyclosome 2025).
De légères variations du motif sont tolérées selon le contexte structural et la nature du substrat.
1. La D-box est le principal signal de reconnaissance par les complexes APC/CCdc20, Cdc20 étant le principale coactivateur de l'APC/C, une E3 ubiquitine-ligase majeure contrôlant la progression mitotique.
La liaison du motif au domaine WD40 de Cdc20 permet le recrutement du substrat et son ubiquitination.
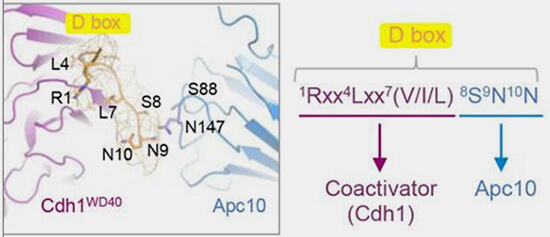
(Figure : vetopsy.fr d'après Chang et Coll)
2. La D-BOX est notamment présente dans les cyclines A et B, dont la dégradation séquentielle est essentielle à la progression mitotique.
a. Elle est indispensable pour leur élimination en métaphase pour conditionner l’entrée en anaphase.
- Après la métaphase, la spécificité du complexe APC/CCdc20 évolue par son association avec Cdh1, formant le complexe APC/CCdh1, actif durant l’anaphase et la phase G1.
- Cette transition prolonge le contrôle de la dégradation au-delà de la mitose, maintenant ainsi l’ordre et la stabilité du cycle cellulaire jusqu’à la phase G1.
b. Le D-box permet une dégradation temporellement contrôlée, assurant la séquence correcte des événements mitotiques.
- Sa reconnaissance dépend de l’état d’attachement des chromosomes au fuseau mitotique, via la levée du SAC (spindle assembly checkpoint).
- Ce contrôle garantit que la séparation chromosomique ne se produit que lorsque la cellule est prête à franchir l’anaphase.
c. Son altération peut bloquer la transition mitotique et perturber la ségrégation chromosomique.
3. On la trouve aussi sur :
- la sécurine, dont la dégradation libère la séparase et déclenche la séparation des chromatides ;
- divers cofacteurs mitotiques, comme la géminine ou la sororine.
KEN-box
La KEN-box est un motif peptidique interne, complémentaire de la D-box, localisée dans des régions flexibles ou désordonnées de la protéine, qui participe également à la reconnaissance des substrats par le complexe APC/C
Elle tire son nom de sa séquence consensus KENxxxN/D, où la triade Lys-Glu-Asn (KEN) constitue le cœur fonctionnel du motif.
1. Elle est principalement reconnue par le complexe APC/CCdh1, actif de l’anaphase à la fin de la phase G1.
- Cette spécificité temporelle la distingue de la D-box, plutôt ciblée par APC/CCdc20 en métaphase.
- Son accessibilité au sein des régions désordonnées facilite la reconnaissance par le domaine WD40 de Cdh1 et conditionne l’ubiquitination sélective des substrats.
2. La KEN-box permet la dégradation sélective des régulateurs mitotiques et post-mitotiques, assurant la séquence correcte des événements et empêchant toute réactivation prématurée des complexes cycline/CDK, garantissant la coordination temporelle entre la sortie de mitose et la préparation de la phase S.
a. En métaphase, la cycline A est l’un des premiers substrats dégradés par APC/CCdc20, amorçant la désactivation des CDK mitotiques (Structure of the mitotic checkpoint complex 2012).
- Elle contient à la fois une D-box et une KEN-box, deux motifs qui agissent de manière complémentaire pour assurer une reconnaissance efficace par l’APC/C.
- La KEN-box facilite l’interaction initiale avec le coactivateur Cdc20, renforçant l’affinité du complexe pour la cycline A et accélérant son ubiquitination.
Cette coopération entre les deux dégrons garantit une dégradation rapide et ordonnée de la cycline A dès la métaphase, amorçant la désactivation des CDK mitotiques et préparant la transition vers l’anaphase.
b En anaphase et en fin de mitose, la cycline B2 et le cofacteur Cdc20 sont à leur tour ubiquitinés par APC/CCdh1, limitant la persistance d’une activité CDK résiduelle et assurant la sortie complète de mitose.
c. En phase G1, la KEN-box prend une importance particulière pour maintenir un état post-mitotique stable.
- Le régulateur p21Cip1, un inhibiteur des complexes cycline/CDK, est ciblé par APC/CCdh1 via sa KEN-box.
- Sa dégradation lève le frein imposé sur les complexes cycline E/CDK2 et cycline A/CDK2, permettant la transition contrôlée de G1 vers S et la reprise du cycle.
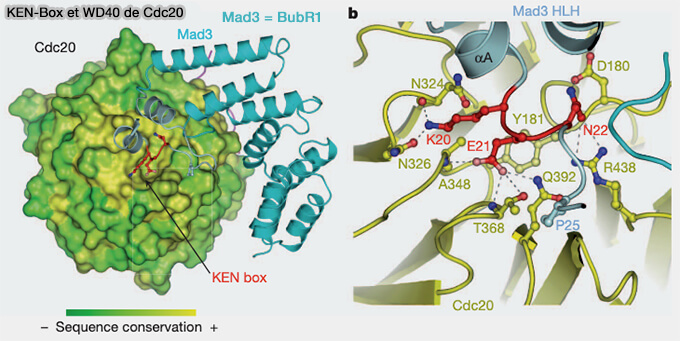
(Figure : vetopsy.fr d'après Chao et Coll)
3. D’autres protéines mitotiques présentent également des séquences apparentées à la Ken-box.
a. La Ken-box de BubR1 (BUB1-related kinase), composant clé du SAC (spindle assembly checkpoint), lui permet d’interagir avec le coactivateur Cdc20 du complexe APC/C, formant avec Mad2 et Bub3 le MCC (Mitotic Checkpoint Complex).
- Dans ce contexte, la KEN-box ne sert pas à la dégradation de BubR1, mais à inhiber temporairement l’APC/CCdc20 tant que tous les kinétochores ne sont pas correctement attachés.
- Ainsi, la KEN-box de BubR1 agit comme un motif d’interaction régulatrice, essentiel pour retarder l’entrée en anaphase jusqu’à la satisfaction du SAC.
b. La sécurine, qui déclenche l'anaphase, est un substrat direct de l’APC/C, qui la cible pour dégradation via une D-box et une KEN-box.
- Sa destruction libère la séparase, enzyme responsable du clivage de la cohésine liant les chromatides sœurs.
- Ici, la KEN-box agit comme un signal de dégradation complémentaire à la D-box, renforçant la reconnaissance par l’APC/CCdc20 et garantissant une activation synchronisée de la séparase.
Motif ABBA
1. Le motif ABBA constitue un élément interne reconnu par le complexe APC/C, contribuant à la régulation fine de la dégradation des substrats mitotiques (The ABBA motif binds APC/C activators and is shared by APC/C substrates and regulators 2015).
- Le motif ABBA, de 9 à 11 résidus, présente une séquence consensus hydrophobe, ΦxxΦxxxxΦ ou parfois Fx[ILV][FHY]x[DE] (Φ représentant un résidu hydrophobe : Phe, Ile, Leu, Val), identifiée dans plusieurs substrats et cofacteurs de l’APC/C.
- Le terme ABBA fait référence à la disposition alternée de résidus hydrophobes (A) et polaires (B) dans sa structure primaire.
Remarque : le motif CRY-box (Cys-Arg-Tyr), même s'il est cité dans certains articles, est aujourd’hui considéré comme une variante fonctionnelle ou un équivalent partiel du motif ABBA (
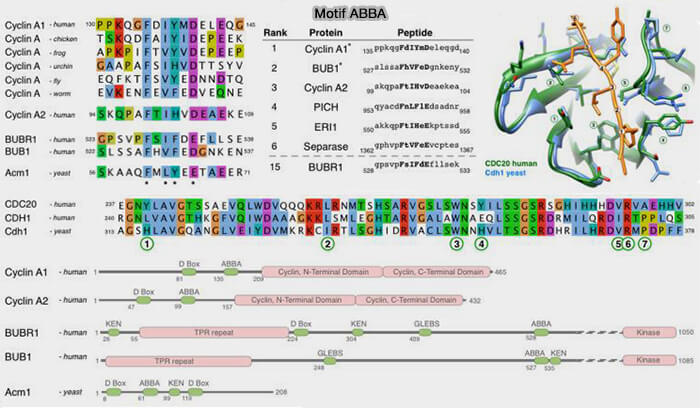
(Figure : vetopsy.fr d'après Di Flore et coll)
2. Il est localisé dans la région centrale des substrats de l’APC/C, en aval d’une D-box ou d’une KEN-box.
- ll assure la liaison directe au coactivateur Cdc20 ou Cdh1 via leur domaine WD40, agissant comme un site d’ancrage complémentaire aux D-box et KEN-box.
- Il coopère souvent avec la D-box et la KEN-box pour moduler l’affinité des substrats envers les coactivateurs Cdc20 ou Cdh1 et assurer la destruction séquentielle des régulateurs du cycle cellulaire.
3. Ce motif est présent dans :
- la cycline A, où il renforce la reconnaissance conjointe avec la D-box,
- la cycline B1 et la sécurine (PTTG1), ciblées pour la dégradation en métaphase,
- BubR1 et Cdc20, où il intervient dans la formation ou la régulation du MCC (Mitotic Checkpoint Complex).
4. Le motif ABBA peut donc agir :
- soit comme signal de dégradation,
- soit comme module d’interaction régulatrice, selon le contexte structural du substrat.
Autres motifs de régulation APC/C-dépendants
Outre les dégrons principaux, i.e. D-box, KEN-box, A-box, ABBA, d’autres séquences ou domaines contribuent à moduler la reconnaissance des substrats par l’APC/C.
Ces éléments, souvent moins conservés, renforcent ou adaptent la spécificité du ciblage selon le contexte structural ou cellulaire.
1. Le domaine PEST, classé parmi les dégrons conformationnels, contribue à l'instabilité rapide de certains régulateurs du cycle cellulaire, tels que les cyclines D1 et E, ainsi que les inhibiteurs de CDK comme p27Kip1 et p21Cip1 (The regulation of cyclin D1 degradation: roles in cancer development and the potential for therapeutic invention 2007).
- Ces régions, riches en résidus proline, glutamate, sérine et thréonine, souvent situées dans des zones désordonnées C-terminales, facilitent leur reconnaissance par les complexes SCFβ-TrCP ou SCFSkp2, notamment après phosphorylation préalable.
- Ainsi, le motif PEST agit comme un amplificateur de dégradation cyclique, couplant la signalisation kinase à l’ubiquitination régulée de ces protéines clés du cycle (Multifaceted behavior of PEST sequence enriched nuclear proteins in cancer biology and role in gene therapy 2020).
2. Le motif GxEN, site d’amarrage de Cdh1 chez la levure, sous-unité du complexe APC/C, semble jouer chez les eucaryotes supérieurs un rôle accessoire et coopératif avec d’autres dégrons tels que la D-box, la KEN-box ou le motif ABBA (Assembly of an APC-Cdh1-Substrate Complex Is Stimulated by Engagement of a Destruction Box 2005).
Reconnaissance multifactorielle et synergie des dégrons
1. La coexistence de plusieurs dégrons (D-box, KEN-box, ABBA) dans une même protéine permet une reconnaissance multifactorielle par l’APC/C, qui assure une régulation de la dégradation cyclique en garantissant :
- une robustesse du système de ciblage, chaque motif pouvant compenser partiellement la perte d’un autre,
- une hiérarchisation temporelle des dégradations selon la phase du cycle,
- une flexibilité adaptative face aux différents états du cycle mitotique.
L’intégration de ces différents motifs confère à l’APC/C une régulation multi-niveaux de la protéolyse cyclique en :
- empêchant l’activation prématurée de complexes mitotiques,
- coordonnant la dégradation séquentielle des régulateurs,
- sécurisant les étapes critiques comme la ségrégation chromosomique,
- assurant la réinitialisation correcte du cycle pour un nouveau tour de division.
2. Prenons l'exemple de la cycline A
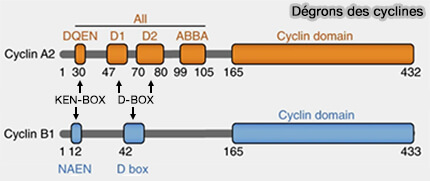
(Figure : vetopsy.fr d'après Zhang et coll)
a. La cycline A cumule les trois dégrons qui coopèrent pour permettre sa dégradation rapide dès la métaphase, avant la levée complète du SAC.
- Le motif ABBA facilite la reconnaissance initiale par le complexe APC/CCdc20, même lorsque celui-ci est encore partiellement inhibé par le SAC.
- La D-box et la KEN-box, plus classiques, assurent ensuite la liaison stable et l’ubiquitination efficace du substrat.
Remarque : D1 de la cycline A est une D-Box canonique et D2 est une boîte D non canonique qui est essentielle à l’ubiquitination de la cycline A2 in vitro et à la dégradation in vivo (Cyclin A2 degradation during the spindle assembly checkpoint requires multiple binding modes to the APC/C 2019).
b. Cette organisation modulaire confère à la cycline A une dégradation précoce et prioritaire, nécessaire à la désactivation progressive des CDK mitotiques et à la préparation de l’entrée en anaphase.


