Cycle cellulaire
Organisation des chromosomes
Complexes SMC : cohésines
Régulation mitotique et séparation des chromatides
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

La cohésion chromatidienne est levée de façon strictement contrôlée en mitose par la voie prophasique et par l’activation de la séparase, conditionnant la ségrégation fidèle des chromosomes.
La cohésion établie en phase S doit être levée de manière strictement contrôlée pour permettre la ségrégation correcte des chromatides sœurs.
Jusqu’à l’entrée en mitose, la cohésion, établie par l’acétylation de SMC3 par ESCO1/ESCO2, est maintenue sur l’ensemble des chromosomes, garantissant la juxtaposition des chromatides sœurs et leur comportement unitaire lors de la capture par le fuseau mitotique.
Cette levée repose sur deux mécanismes distincts et successifs :
Voie prophasique de dissociation (prophase-prométaphase)
L’organisation axiale, qui sera mise en place par la condensine II, s’appuie sur une chromatine déjà partiellement structurée par les cohésines en interphase et en début de prophase, qui assurent une première cohérence longitudinale des chromatides.
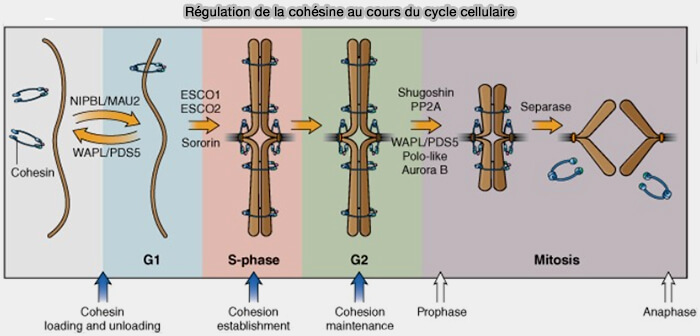
(Figure : vetopsy.fr d'après Zakari et coll)
Bras chromosomiques
Dès l’entrée en mitose, une fraction importante des cohésines associées aux bras chromosomiques est éliminée par un mécanisme indépendant de la séparase.
1. Ce processus repose sur la phosphorylation de sous-unités de la cohésine ainsi que de cofacteurs clés du module de régulation WAPL-PDS5 par les kinases mitotiques.
- SA2, phosphorylée par CDK1 et Plk1, constitue la cible majeure de cette phosphorylation et joue un rôle essentiel dans la dissociation préférentielle des cohésines sur les bras chromosomiques.
- La soririne, phosphorylée en entrée de mitose par CDK1 et Aurora B se dissocie du complexe cohésine-PDS5, libérant ainsi le site de liaison de WAPL au complexe pour promouvoir l’ouverture de la porte kleisine.
- La phosphorylation de RAD21 contribue à la déstabilisation globale du complexe cohésine, mais son rôle est secondaire par rapport à SA2/sororine.
2. Cette dissociation précoce :
- permet la séparation partielle des chromatides sœurs au niveau des bras chromosomiques, souvent désignée sous le terme de " résolution " dans la littérature scientifique,
- facilite la condensation chromosomique en libérant la chromatine et en permettant l’action efficace des condensines, tout en maintenant une cohésion stricte au niveau des centromères.
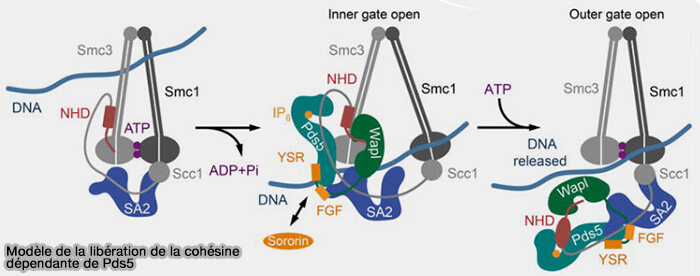
(Figure : vetopsy.fr d'après Ouyang et coll)
Protection du centromère chromosomique : shugoshines
La cohésine centromérique échappe à la voie prophasique de dissociation grâce à un mécanisme de protection spécifique, indispensable au maintien de la cohésion jusqu’à l’anaphase.
1. Les shugoshines (SGO1 en mitose et SGO2 en méiose) sont des protéines adaptatrices (scaffolds) non enzymatiques spécialisées dans le ciblage et l’organisation locale de complexes régulateurs au centromère (Shugoshins: Tension-Sensitive Pericentromeric Adaptors Safeguarding Chromosome Segregation 2015).
- Chez les mammifères, SGO1 est la shugoshine prédominante dans les cellules somatiques et assure principalement la protection de la cohésion centromérique en mitose, tandis que SGO2 est fortement enrichie dans les cellules germinales et constitue la shugoshine majeure de la méiose.
- Les deux protéines peuvent être exprimées dans les deux contextes, mais avec des contributions fonctionnelles très asymétriques.
a. Les shugoshines recrutent principalement PP2A-B56, mais interagissent également avec :
- la cohésine (RAD21/SA2 ou REC8), ce qui permet le ciblage précis de PP2A sur le bon substrat,
- la marque chromatinienne H2A-T120-P, histone H2A phosphorylée sur Thr120 par Bub1 qui sert de signal d’ancrage pour le recrutement des shugoshines au centromère interne, région chromatinienne située entre les deux kinétochores sœurs, et au kinétochore.
- les composants du CPC (Chromosomal Passenger Complex) pour contribuer à son positionnement (Aurora B-INCENP-Survivin-Borealin),
- les composants du point de contrôle du fuseau (SAC) par sa contribution organisationnelle au micro-environnement centromérique.
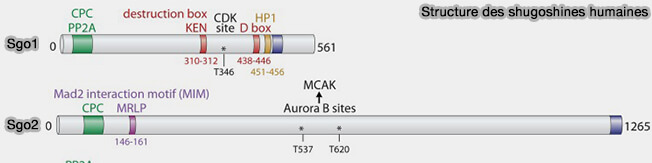
(Figures modifiées : vetopsy.fr d'après Martson)
b. Les shugoshines forment un complexe fonctionnel avec l’holoenzyme PP2A contenant la sous-unité régulatrice B56 grâce à un motif conservé de liaison à B56 et agissent comme un adaptateur de ciblage qui recrute spécifiquement PP2A-B56 au centromère, conférant au complexe sa capacité protectrice sur la cohésine.
c. En mitose, le complexe SGO1-PP2A-B56 protège la cohésine centromérique principalement en contrecarant la phosphorylation SA2 et la sororine, ce qui empêche l’accès de WAPL au complexe PDS5 et bloque la dissociation prématurée de la cohésine.
d. En méiose, la protection centromérique repose principalement sur un mécanisme distinct de celui de la mitose.
- Le complexe SGO2-PP2A se fixe directement sur la cohésine contenant la kleisine REC8 et empêche sa phosphorylation, bloquant ainsi sa reconnaissance et son clivage par la séparase jusqu’à la méiose II.
- La sororine est bien exprimée au cours de la méiose et peut contribuer à la stabilisation des complexes, mais elle ne constitue pas le mécanisme central de protection centromérique.
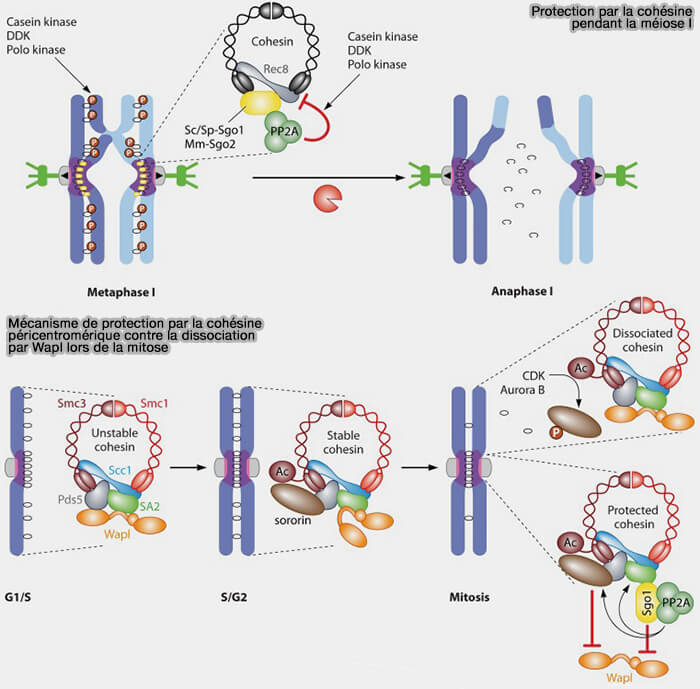
(Figure : vetopsy.fr d'après Martson)
2. Au-delà de cette fonction, les shugoshines participent plus largement à l’organisation fonctionnelle du centromère.
a. Dans les cellules de mammifères, les shugoshines s’associent à l’hétérochromatine péricentromérique via une interaction avec HP1, ce qui contribue à leur enrichissement initial dans la région centromérique.
b. En mitose, chez les mammifères, en absence de tension entre les kinétochores sœurs, SGO1 est enrichie au centromère interne (péricentromère).
- Chez les mammifères, cette localisation dépend de la phosphorylation de SGO1 sur T346, qui favorise son association avec la cohésine et permet le recrutement local de ses partenaires effecteurs (dont PP2A).
- Cette accumulation au centromère interne permet la constitution d’une plateforme fonctionnelle protectrice et permet la localisation de ses protéines effectrices au centromère interne/péricentromère.
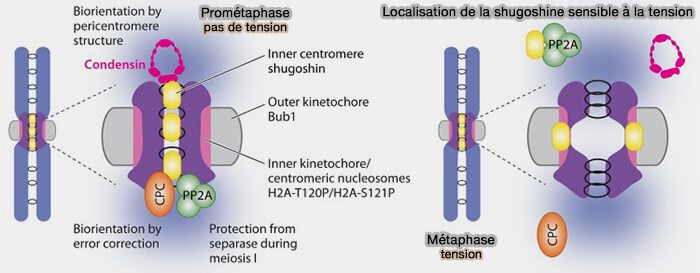
(Figure : vetopsy.fr d'après Martson)
c. La localisation de Shugoshin est dynamique et sensible à la tension bipolaire.
Chez les mammifères, la mise sous tension des kinétochores sœurs entraîne la déphosphorylation de T346, ce qui s’accompagne d’un déplacement partiel de SGO1 vers le kinétochore, où elle peut interagir avec H2A-T120-P générée par Bub1.
d. En reconnaissant H2A-T120 phosphorylée par Bub1, les shugoshines participent également au positionnement du CPC (Chromosomal Passenger Complex) et du point de contrôle du fuseau (SAC) au centromère interne, en coopération avec la voie Haspin/H3-T3-P/Survivine.
3. Par cette double action, les shugoshines assurent une coordination fonctionnelle entre :
- la protection de la cohésion centromérique,
- la tension kinétochorienne,
- la correction des attachements kinétochore-microtubules via l’activité d’Aurora B,
- la satisfaction progressive du point de contrôle du fuseau (SAC).
Transition métaphase-anaphase : activation de la séparase
La séparation effective des chromatides sœurs est déclenchée par l’activation brutale de la séparase à la transition métaphase-anaphase.
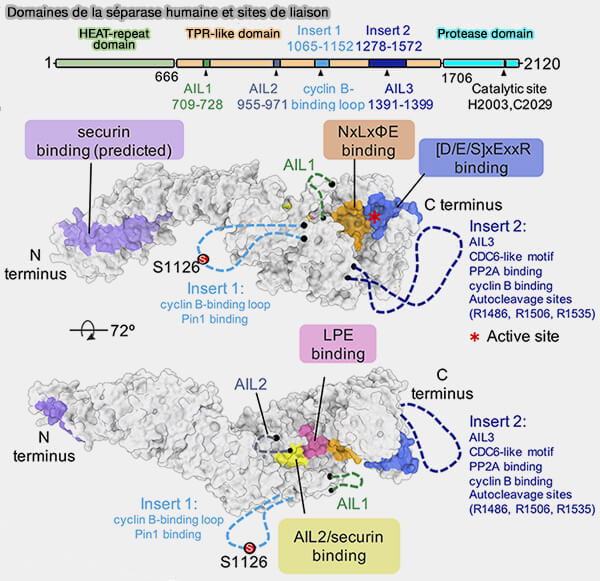
(Figure : vetopsy.fr d'après Yu et coll)
1. La séparase est une cystéine-protéase de la famille CD d'environ 2100 résidus dont la fonction est de cliver spécifiquement la sous-unité kleisine de la cohésine (The molecular mechanisms of human separase regulation 2023).
a. La séparase humaine est organisée en trois domaines structuraux :
- un domaine à répétitions HEAT N-terminal, contenant 3 boucles autoinhibitrices (AIL1/3) le motif principal de liaison à la sécurine,
- un domaine TPR-like central, avec deux grandes insertions flexibles servant de points d’interaction pour des régulateurs tels que la cycline B1, CDK1 et PP2A, et pour les sites d’auto-clivage,
- un domaine catalytique C-terminal, contenant les résidus His2003 et Cys2029 conservés.
b. Les sites de liaison des inhibiteurs (sécurine) et des motifs de reconnaissance des substrats convergent vers des régions proches du site actif marqué par His2003 et Cys2029, soulignant la modularité structurale qui sous-tend la régulation de l’activité protéolytique.
2. En métaphase, l’activité de la séparase est inhibée :
- par la sécurine, qui se lie directement à la séparase et bloque son site catalytique,
- par sa phosphorylation dépendante du complexe cycline B/CDK1 (MPF), qui stabilise une conformation inactive de l’enzyme,
- par son association transitoire avec des partenaires régulateurs, contribuant à affiner le seuil d’activation.
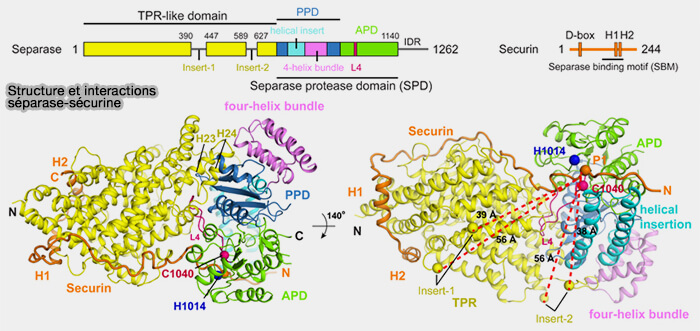
(Figure : vetopsy.fr d'après Boland et coll)
3. La sécurine est une protéine régulatrice essentielle de la transition métaphase-anaphase (Cryo-EM structure of a separase-securin complex at near-atomic resolution 2017).
Elle se lie directement à la séparase et exerce un double rôle moléculaire (Structure and function of the separase-securin complex 2021).
- Elle inhibe l’enzyme en occupant sa poche catalytique par un motif pseudosubstrat qui imite le site de clivage des kleisines sans permettre l’hydrolyse, et stabilise en parallèle la boucle L4, élément structural critique du site actif.
- Elle s’engage le long de plusieurs domaines de la séparase, contribuant ainsi à la stabilisation conformationnelle et au repliement fonctionnel de l’enzyme avant son activation.
4. L’entrée en anaphase dépend de l’activation de l’APC/CCdc20, qui ubiquitine la sécurine et cible celle-ci à la dégradation protéasomale.
- La dégradation de la sécurine, combinée à l’inactivation du complexe cycline B/CDK1 (MPF) par l'APC/CCdc20, libère la séparase et permet son activation enzymatique.
- La séparase activée peut en outre subir un auto-clivage intramoléculaire, qui ne conditionne pas son activation mais contribuerait à stabiliser sa conformation active et à affiner la dynamique de son activité pendant l’anaphase.
5. La séparase activée clive spécifiquement la kleisine de la cohésine, RAD21 dans les cellules somatiques et REC8 dans les cellules méiotiques.
- Le clivage de la kleisine, qui assure la jonction entre les têtes ATPasiques de SMC1 et SMC3 et ferme l'anneau, est clivé par la séparase et se produit préférentiellement au niveau centromérique, les cohésines des bras ayant déjà été majoritairement éliminées par la voie prophasique.
- Après clivage, tout lien mécanique entre les chromatides disparaît, les forces de traction exercées par les microtubules kinétochoriens deviennent alors dominantes et entraînent la séparation immédiate des chromatides sœurs vers les pôles.
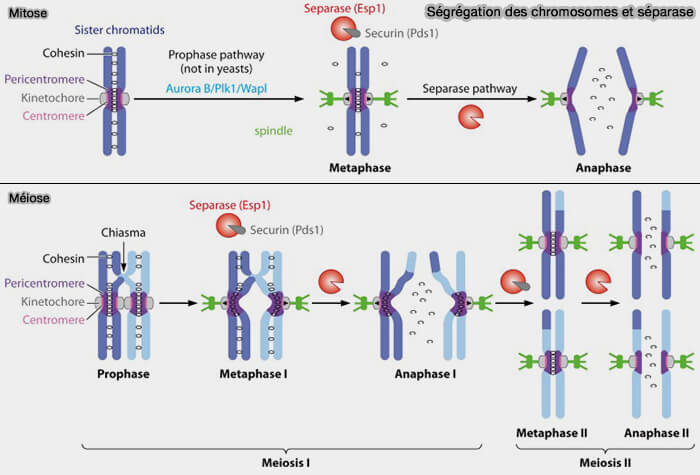
(Figure : vetopsy.fr d'après Martson)

Ce clivage provoque l’ouverture irréversible de l’anneau cohésine au niveau des centromères et entraîne la séparation immédiate des chromatides sœurs, marquant l’entrée effective en anaphase.
Rôle architectural en interphase
1. Indépendamment de la cohésion chromatidienne, la cohésine contribue à l’organisation tridimensionnelle du génome en interphase.
- Elle forme des boucles chromatiniennes par extrusion dépendante de son activité ATPasique, structurant la chromatine en TAD (Topologically Associating Domains).
- La dynamique et la position de ces boucles sont canalisées par CTCF, dont l’orientation convergente des sites de liaison définit les frontières des domaines.
2. Cette organisation conditionne les interactions promoteur-enhancer et la régulation fine de l’expression génique.
Remarque : les altérations de la cohésine ou de ses régulateurs compromettent la stabilité génomique et l’organisation de la chromatine (Etiology and pathogenesis of the cohesinopathies 2015).
- Les cohesinopathies correspondent à des maladies du développement liées à des mutations germinales affectant notamment NIPBL, SMC1, SMC3, RAD21 et ESCO2, entraînant principalement des défauts d’architecture chromatinienne et de régulation transcriptionnelle avec le syndrome de Cornelia de Lange comme prototype (MAU2 and NIPBL Variants Impair the Heterodimerization of the Cohesin Loader Subunits and Cause Cornelia de Lange Syndrome 2020).
- En cancérologie, les mutations somatiques de la cohésine sont fréquentes, en particulier celles touchant STAG2, et favorisent l’instabilité chromosomique et la dérégulation transcriptionnelle.
Ces pathologies illustrent le rôle central de la cohésine comme garant de l’intégrité structurelle et fonctionnelle du génome.
Retour aux complexes SMC
En construction


