Cycle cellulaire
Organisation des chromosomes
Complexes SMC : cohésines
Structure, chargement et dynamique
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

Les cohésines sont des complexes SMC dont la structure en anneau, le chargement ATP-dépendant et la régulation dynamique assurent la cohésion chromatidienne et l’organisation tridimensionnelle de la chromatine.
Les cohésines : cohésion et maintien des chromatides sœurs
Définition et positionnement fonctionnel
La spécificité fonctionnelle des cohésines repose sur un double rôle :
- un rôle mécanique dans la cohésion des chromatides sœurs,
- un rôle architectural dans l’organisation tridimensionnelle du génome.
Cette spécialisation distingue clairement les cohésines des condensines, principalement dédiées à la compaction mitotique des chromosomes.
1. Dans la reproduction cellulaire, mitose et méiose, la cohésine est un complexe SMC spécialisé dans le maintien physique des chromatides sœurs après réplication en phase S.
Cette cohésion est indispensable à :
- la bi-orientation correcte des chromosomes,
- l’établissement d’une tension kinétochorienne stable,
- la ségrégation fidèle des chromatides en anaphase.
2. Au-delà de la division cellulaire, la cohésine exerce une fonction structurale majeure en interphase :
- la formation des TAD (Topologically Associating Domain), domaines d’organisation de la chromatine dans lequel les régions d’ADN interagissent préférentiellement entre elles,
- la stabilisation des interactions régulatrices entre promoteurs et enhancers.
Composition moléculaire du complexe cohésine
Le complexe cohésine correspond à une déclinaison fonctionnelle spécialisée de l’architecture des complexes SMC.

La structure détaillée des complexes SMC est étudiée dans un chapitre spécifique.
1. Le cœur du complexe est constitué d’un hétérodimère formé par SMC1 et SMC3 qui permet la formation d’une structure en anneau capable d’encercler topologiquement l’ADN, base mécanique de la cohésion chromatidienne et de l’extrusion de boucles.
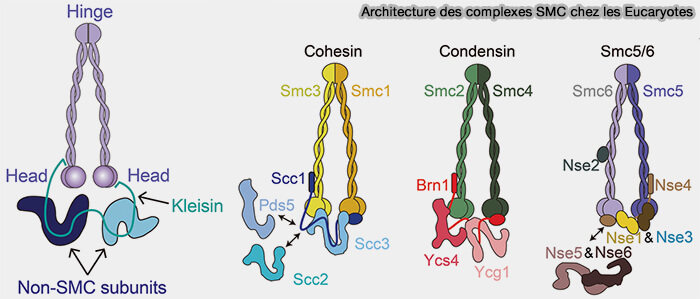
Figure : vetopsy.fr d'après Moon et Ryu)
2. La spécificité fonctionnelle du complexe repose sur l’association du dimère SMC1-SMC3 avec des sous-unités non-SMC spécialisées.
a. La kleisine relie directement les deux têtes ATPases de SMC1 et SMC3 et ferme l’anneau cohésine et constitue la cible du clivage par la séparase lors de la transition métaphase-anaphase, événement qui déclenche la séparation irréversible des chromatides sœurs.
- RAD21 est la kleisine des cohésines somatiques,
- REC8 est une kleisine spécifiquement exprimée au cours de la méiose.
b. Les sous-unités riches en répétitions HEAT, SA1/SA2, contribuent à la stabilisation du complexe sur la chromatine et à la formation d'une plateforme d’interaction pour les régulateurs de la cohésine.
- SA2 étant majoritairement impliquée dans la cohésion mitotique,
- SA1 joue un rôle plus marqué dans l’organisation architecturale de la chromatine interphasique.
Chargement et établissement de la cohésion en phase S
Le chargement de la cohésine sur la chromatine est un processus actif et régulé, indispensable à l’établissement de ses fonctions structurales et mécaniques.
1. Le recrutement initial de la cohésine dépend du complexe de chargement NIPBL-MAU2, homologues de Scc2-Scc4 chez la levure (NIPBL and cohesin: new take on a classic tale 2023)
a. NIPBL, protéine riche en répétitions HEAT à architecture en solénoïde α-hélicoïdal flexible, crée une surface allongée d’interaction protéine-protéine et protéine-ADN.
- Elle stabilise la conformation engagée des têtes ATPasiques de SMC1/SMC3 dont elle stimule l’activité ATPase, et se fixe également sur la kleisine RAD21 et son cofacteur MAU2.
- Elle se fixe également à l’ADN via ses domaines HEAT, ce qui positionne l’ADN au contact de la cohésine.
Cette double interaction permet l’ouverture transitoire de l’anneau et l’engagement topologique de l’ADN (Cryo-EM structure of the human cohesin-NIPBL-DNA complex 2020).
b. MAU2, par sa fixation sur NIPBL, n’a pas d’activité propre mais agit comme cofacteur structural de NIPBL, en stabilisant sa conformation et en renforçant l’interaction du complexe NIPBL-MAU2 avec la cohésine.
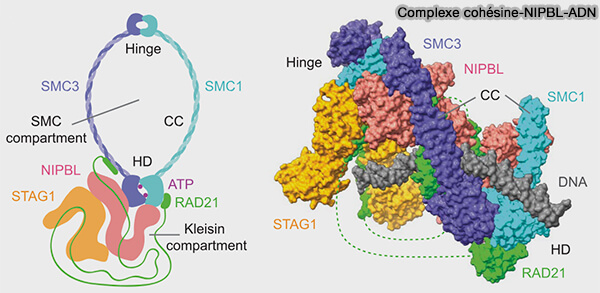
Figure : vetopsy.fr d'après Shi et coll)
2. Le chargement s’effectue préférentiellement dans des régions de chromatine accessible, souvent associées à l’activité transcriptionnelle et à des sites de remodelage nucléosomique.
Une fois chargée, la cohésine peut adopter plusieurs états fonctionnels :
- une forme transitoire, rapidement recyclée sous l’action de WAPL,
- une forme stabilisée par l’acétylation de SMC3 et le recrutement de la sororine, assurant la cohésion durable des chromatides sœurs,
- une forme dynamique conservant une activité ATPasique cyclique, impliquée dans l’extrusion de boucles et l’organisation de la chromatine en interphase.
3. La cohésion durable entre chromatides sœurs est mise en place au cours de la phase S, en coordination directe avec la réplication de l’ADN, puis finement régulée tout au long du cycle cellulaire.
a. L’établissement de la cohésion repose sur l’acétylation de SMC3 par les acétyltransférases ESCO1 et ESCO2 sur les cohésines associées aux chromatides nouvellement répliquées (Investigation of Structure and Function of Esco1 and Esco2 Acetyltransferase 2018 et Esco1 and Esco2 regulate distinct cohesin functions during cell cycle progression 2017).
L’acétylation de SMC3 favorise le recrutement de la sororine, protéine qui stabilise la cohésine sur la chromatine en antagonisant l’action du facteur de déchargement WAPL (Sororin is an evolutionary conserved antagonist of WAPL 2024).
b. Ce mécanisme permet le passage d’un état dynamique de cohésine compatible avec l’extrusion de boucles en interphase, à un état stabilisé assurant une cohésion robuste entre chromatides sœurs jusqu’à l’entrée en mitose (The structure of the cohesin ATPase elucidates the mechanism of SMC-kleisin ring opening 2020).
Acteurs de la régulation dynamique de la cohésine
La dynamique d’association de la cohésine à la chromatine repose sur un équilibre régulé entre plusieurs modules fonctionnels coordonnés :
- le chargement par NIPBL-MAU2,
- la stabilisation post-réplicative par ESCO1/ESCO2 et la sororine,
- le déchargement par WAPL.
L’ensemble de ces processus étant intégré et modulé par la plateforme structurale PDS5.
(Figure modifiée : vetopsy.fr d'après Ouyang et coll)
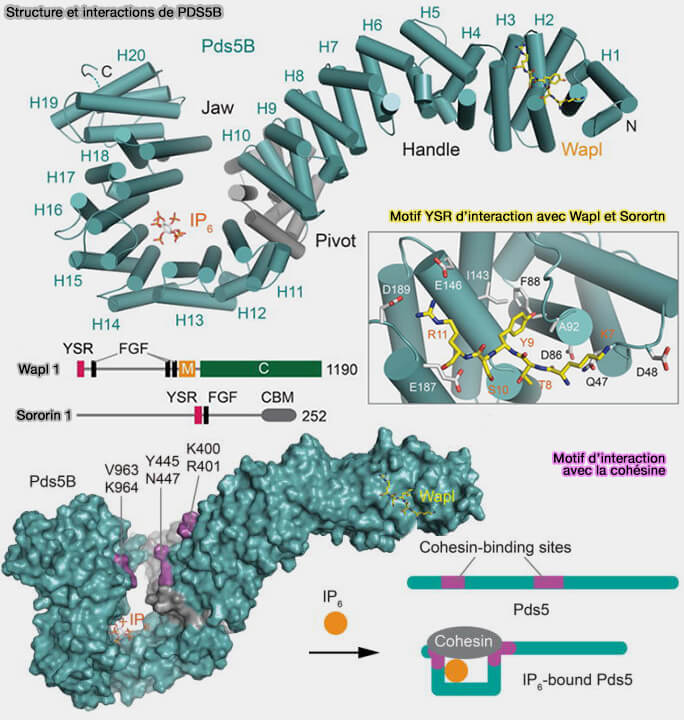
1. PDS5, à deux paralogues chez les mammifères (PDS5A et PDS5B), est une grosse protéine, i.e. d'environ 1300 résidus, modulant ainsi l’équilibre dynamique d’ouverture et de stabilisation du complexe (Regulation of cohesin‐mediated chromosome folding by PDS5 in mammals 2022).
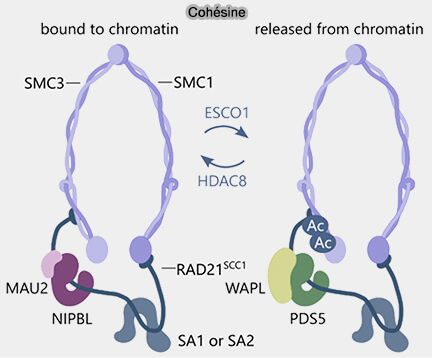
Figure : vetopsy.fr d'après Ryzhkova et coll)
a. Elle forme un solénoïde α-hélicoïdal courbé formé de 20 répétitions HEAT possédant avec :
- une face interne qui se fixe directement à la cohésine par interaction avec la région centrale de la kleisine RAD21 (Structural Basis and IP6 Requirement for Pds5-dependent Cohesin Dynamics 2017),
- une face externe qui possède des surfaces d’interaction pour WAPL, la sororine et NIPBL.
b. WAPL et Sororin, par leur motif YSR ([K/R][S/T]YSR), s’insèrent dans un creux hydrophobe/polaire d'une même région de la moitié C-terminale de PDS5, et par ce biais, modulent l’ouverture de la porte kleisine de la cohésine (interface RAD21-SMC3), favorisant soit le déchargement (via WAPL), soit la stabilisation post-réplicative (via la sororine).
Le motif FGF (Phénylalanine-Glycine-Phénylalanine) est requis pour leur activité biologique, vraisemblablement pour le positionnement sur la cohésine ou la stabilisation du complexe PDS5-WAPL/Sororin.
2. La sororine est une protéine régulatrice spécifique des cellules eucaryotes supérieures, exprimée principalement en phase S et G2.
- Elle se lie au complexe cohésine-PDS5,
- entre en compétition directe avec WAPL et empêche WAPL de promouvoir l’ouverture de la cohésine,
- stabilise la cohésine sur la chromatine après réplication.
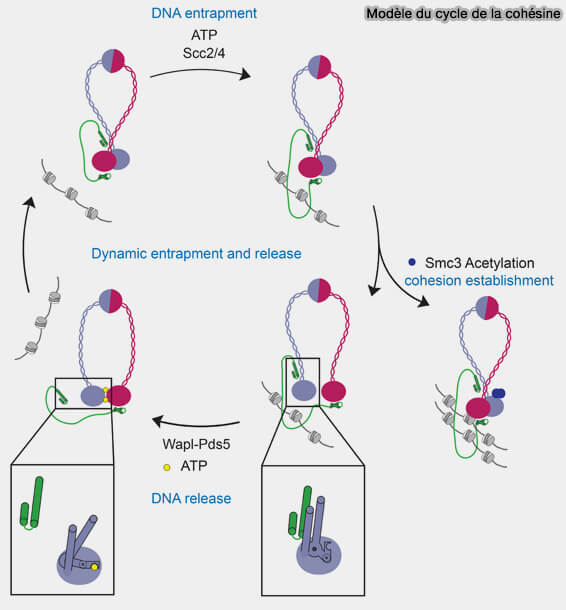
Figure : vetopsy.fr d'après Muir et coll)
3. WAPL, protéine régulatrice non enzymatique, riche en hélices, modifie la conformation de la cohésine et favorise l’ouverture de l’anneau en :
- se liant au complexe cohésine-PDS5,
- favorisant l’ouverture d’une interface de la cohésine,
- déstabilisant la rétention topologique de l’ADN,
- entraînant le déchargement de la cohésine hors de la chromatine.
a. WAPL, actif en interphase et en prophase et antagonisé par Sororin après réplication, limite la durée de résidence du complexe sur la chromatine (Molecular mechanism and functional significance of Wapl interaction with the Cohesin complex 2024).
4. L’antagonisme entre WAPL et la sororine permet de préserver la cohésion des chromatides sœurs tout en maintenant une population de cohésines dynamiques impliquées dans l’organisation tridimensionnelle du génome (Aurora B and CDK1 mediate Wapl activation and release of acetylated cohesin from chromosomes by phosphorylating Sororin 2013).
Cet équilibre fonctionnel conditionne directement la cohésion chromatidienne, l’organisation des domaines chromatiniens et la plasticité de l’architecture nucléaire au cours du cycle cellulaire.
Régulation mitotique de la cohésine
et séparation des chromatides
En construction


