Cycle cellulaire
Organisation des chromosomes
Complexes SMC (cohésines et condensines)
Mécanisme
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

Les complexes SMC organisent activement l’ADN grâce à un cycle ATPase qui contrôle leurs changements de conformation et permet l’extrusion directionnelle de boucles.
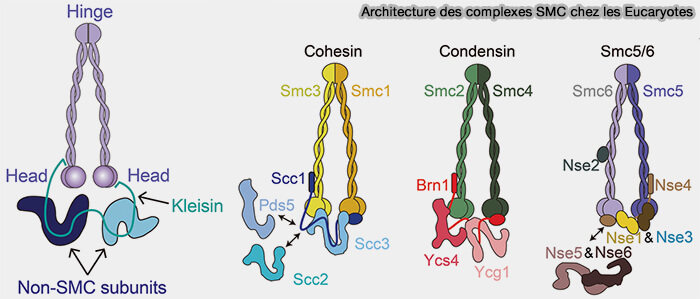
Figure : vetopsy.fr d'après Moon et Ryu)
Mécanismes des complexes SCP

La structure des complexes SMC est étudiée dans un chapitre spécifique.
Cycle de l'ATP
L’activité des complexes SMC repose sur un cycle de liaison et d’hydrolyse de l'ATP qui contrôle directement leurs changements de conformation et permet un déplacement actif le long de l’ADN.
Les deux têtes ATPases du dimère SMC fonctionnent de manière coordonnée et le cycle ATPase ne génère pas une force mécanique directe, mais pilote des transitions conformationnelles contrôlées du complexe (The structure of the cohesin ATPase elucidates the mechanism of SMC-kleisin ring opening 2020).
1. En absence d’ATP, les têtes sont désengagées et le complexe adopte une conformation ouverte.
2. La liaison de deux molécules d’ATP aux têtes provoque leur engagement face à face, ce qui stabilise une conformation fermée du complexe.
a. Chaque tête, qui fait partie des ATPases ABC (ATP-Binding Cassette transporters), possède :
- un site de liaison à l’ATP,
- une surface d’interface constituée notamment du motif signature ABC (LSGGQ), qui reconnaît l’ATP lié à la tête opposée et stabilise l’engagement des deux têtes.
- L'ATP devient littéralement un pont moléculaire entre les deux têtes.
b. Quand l’ATP se fixe et que les deux têtes s’engagent, on observe des rotations et des bascules de plusieurs degrés de ces domaines (The cohesin ATPase cycle is mediated by specific conformational dynamics and interface plasticity of SMC1A and SMC3 ATPase domains 2024).
Certains motifs internes (Q-loop, H-loop, signature LSGGQ) changent d’orientation, la surface de la tête devient plus compacte, l’angle entre la tête et le début du coiled-coil est modifié.
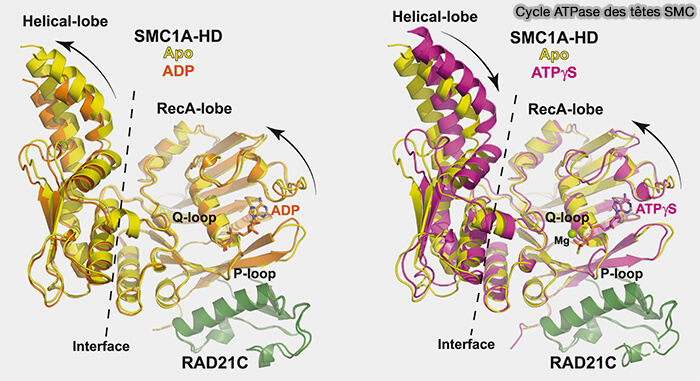
Figure : vetopsy.fr d'après Gomes et coll)
c. Quand l’orientation de la tête change (ATP lié), le point d’ancrage du coiled-coil change d’angle et le bras entier bascule ou se rapproche de l’autre bras.
- En présence d'ATP, les bras sont plus fermés et en absence d'ATP, ils sont plus ouverts.
- L’existence d’états " semi-fermés " reflète des conformations intermédiaires observées expérimentalement, correspondant à des engagements partiels des têtes ATPase au cours des transitions de liaison et d’hydrolyse de l’ATP.
d. Les têtes ATPase étant mécaniquement connectées aux coiled-coils et aux interfaces kleisine-SMC, leur rapprochement entraîne un réarrangement global de la géométrie de l’anneau.
Les zones appelées elbow ou joint le long des coiled-coils permettrent une courbure contrôlée du bras, absorbent les contraintes mécaniques et autorisent plusieurs géométries du complexe.
3. L’hydrolyse de l'ATP induit ensuite la dissociation des têtes et un nouveau changement de conformation globale.

Ces transitions conformationnelles successives modulent l’état de plusieurs interfaces structurales dynamiques de l’anneau, capables de s’ouvrir ou de se refermer de manière contrôlée, qui permettent le passage contrôlé de segments d’ADN à l’intérieur de l’anneau et rendent possible le mécanisme d’extrusion de boucles.
Transmission structurale du cycle ATPase vers l’ADN
Les changements d’angle et de géométrie des têtes ATPase provoquent :
- une modification du volume interne de l’anneau,
- un repositionnement de la kleisine,
- une modification des points de contact ADN-protéine,
- une redistribution des contraintes mécaniques sur les interfaces.
1. La kleisine (RAD21, CAP-H, Nse4) se fixe par son extrémité N-terminale sur la tête d’une SMC, par son extrémité C-terminale sur la tête de l’autre SMC.
- Ces deux points d’ancrage font de la kleisine une sangle mécanique reliant les deux têtes.
- Quand les têtes s’engagent (ATP lié), la distance et l’orientation entre ces deux points changent.
- La kleisine est alors directement déformée par transmission mécanique réelle.
2. Les sous-unités HEAT (SA1/SA2, CAP-D/G) s’attachent le long de la kleisine, forment une surface courbe riche en hélices α et constituent une plateforme majeure de contact avec l’ADN.
Elles se situent ainsi exactement à l’interface où la déformation de la kleisine se traduit en une modification des surfaces de contact avec l’ADN.
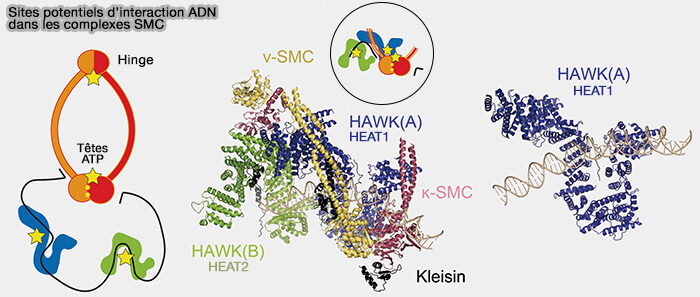
Figure : vetopsy.fr d'après Moon et Ryu)
3. Les structures cryo-EM mettent en évidence trois zones majeures de contact entre l’ADN et le complexe SMC.
- Certaines boucles exposées des têtes ATPases, autour de la fente catalytique, peuvent fixer transitoirement l’ADN, guider son orientation lors de la capture d’un segment et servir de points d’ancrage transitoires et hautement dynamiques.
- La kleisine possède des régions basiques, et parfois des motifs de liaison à l’ADN identifiés expérimentalement qui peuvent ainsi stabiliser un segment d’ADN à l’intérieur de l’anneau.
- Les domaines HEAT forment une surface continue de contacts électrostatiques, interagissent directement avec le squelette phosphate de l’ADN et guident le trajet de l’ADN à l’intérieur du complexe.
Remarque : dans certains modèles (modèle scrunching), la charnière (hinge) rentre aussi en contact avec l'ADN.
Les modifications géométriques induites par le cycle ATPase entraînent un repositionnement de la kleisine, qui déplace à son tour les domaines HEAT et modifie ainsi le trajet physique de l’ADN à l’intérieur du complexe.
Interfaces dynamiques de l’anneau SMC (portes moléculaires)
Le cycle ATPase module l’état de plusieurs interfaces structurales dynamiques des complexes SMC, qui fonctionnent comme de véritables portes moléculaires contrôlant l’accès et la circulation de l’ADN au sein de l’anneau.
Ces interfaces peuvent adopter deux états fonctionnels (A Structure-Based Mechanism for DNA Entry into the Cohesin Ring 2020) :
- un état fermé, dans lequel l’ADN est retenu topologiquement au sein du complexe,
- un état ouvert, permettant l’entrée, la sortie ou le transfert interne d’un segment d’ADN entre compartiments du complexe.
Porte tête-tête (ATPase gate ou head-gate)
1. La porte tête-tête (ATPase gate ou head-gate) correspond à l’interface entre les deux domaines ATPases des protéines SMC.
Il ne s’agit pas d’une ouverture large, mais d’une ouverture structurale finement contrôlée, de l’ordre de quelques nanomètres, suffisante pour autoriser le passage d’un segment d’ADN.
Cette porte est :
- fermée lorsque l’ATP est lié (têtes engagées),
- ouverte après hydrolyse de l’ATP (têtes désengagées), ce qui en fait une interface directement couplée à chaque cycle ATPase.
2. Cette dynamique couple directement l’ouverture de la porte à chaque cycle ATPase et permet le passage interne contrôlé de segments d’ADN entre compartiments du complexe.
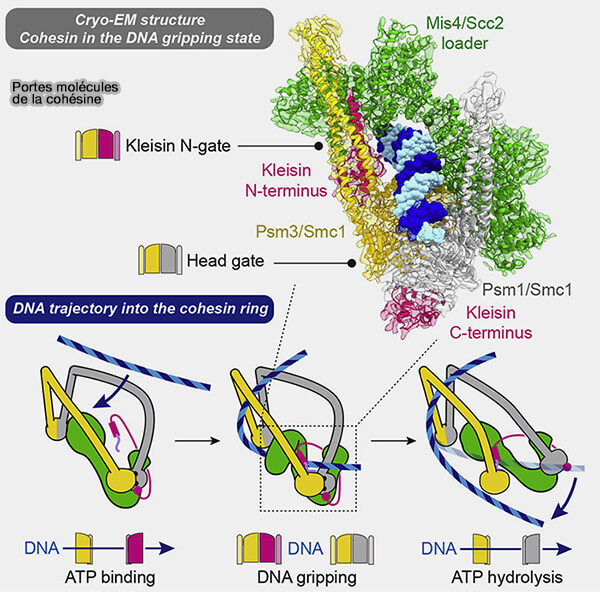
Figure : vetopsy.fr d'après Higashi et coll)
Porte kleisine-tête (kleisin gate)
1. La porte kleisine-tête (kleisin gate) se situe à la jonction entre la kleisine (RAD21, CAP-H, Nse4 selon le complexe) et l’une des deux têtes SMC.
Cette interface est asymétrique.
- L’une des extrémités de la kleisine établit une interaction très stable avec sa tête SMC.
- L’autre est plus labile et régulable, ce qui confère à cette interface un potentiel d’ouverture contrôlée.

Fonctionnellement, cette porte sert à contrôler l’accès global de l’ADN à l’anneau SMC.
2. Un complexe SMC ne peut extruder une boucle que s’il est déjà topologiquement chargé autour de l’ADN et la porte kleisine-tête intervient donc principalement lors :
- du chargement initial de l’ADN dans l’anneau,
- de la libération contrôlée du complexe,
- et, dans certains contextes biologiques spécifiques (réorganisation fonctionnelle du complexe, réponse aux dommages de l’ADN, recyclage topologique local), lors d’un repositionnement contrôlé du complexe sur l’ADN.
3. La porte kleisine-tête est régulée différemment selon les complexes SMC.
- Dans la cohésine, WAPL favorise l’ouverture de cette interface et provoque la dissociation des cohésines des bras chromosomiques en prophase (
voie prophasique), tandis que le clivage de RAD21 par la séparase en anaphase entraîne une ouverture irréversible de l’anneau (
transition métaphase-anaphase).
- Dans la condensine, la dynamique d’association et de recyclage du complexe sur la chromatine est principalement contrôlée par la phosphorylation mitotique des sous-unités de la condensine (notamment CAP-H/CAP-H2, CAP-D2/D3 et CAP-G/G2) par le complexe cycline B/CDK1 (MPF), Plk1 et Aurora B, ainsi que par leur déphosphorylation en sortie de mitose (
condensines et cycle cellulaire).
- Dans le complexe SMC5/6, l’ouverture de l’anneau est régulée dans des contextes liés à la réparation de l’ADN et au traitement des structures d’ADN aberrantes.
4. L’état de cette porte peut être modulé selon le contexte par :
- la contrainte mécanique induite par le cycle ATPase,
- des modifications post-traductionnelles, principalement des phosphorylations mitotiques (RAD21, SA2, Sororine, PDS5) par le complexe cycline B/CDK1, Plk1 et Aurora B, ainsi que l’acétylation de SMC3 par ESCO1/ESCO2,
- des facteurs régulateurs spécifiques comme WAPL, séparase…
Remarque : pendant le mécanisme d’extrusion décrit ci-dessous, la porte kleisine-tête reste fonctionnellement fermée car elle intervient principalement lors du chargement initial et de la libération régulée du complexe, mais n’est pas sollicitée à chaque cycle ATPase.
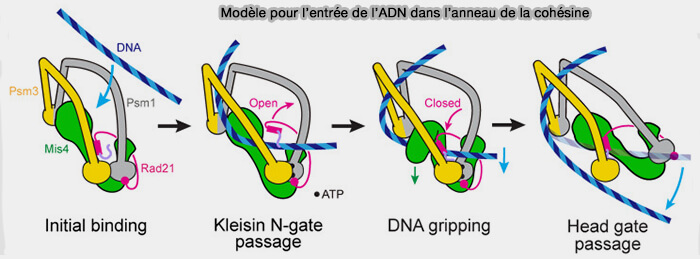
Figure : vetopsy.fr d'après Higashi et coll)
3. Le domaine charnière (hinge), qui assure l’association des deux protéines SMC, ne constitue pas une porte fonctionnelle dans le mécanisme normal d’extrusion.
Les données structurales montrent que cette interface est hautement stable et qu’elle ne s’ouvre pas au cours du cycle ATPase ni pendant l’extrusion de boucles.
États structuraux successifs du cycle ATPase et extrusion

Le mécanisme moléculaire complexe par lequel les CMS extrudent une boucle d'ADN est toujours en débat (Current working models of SMC-driven DNA-loop extrusion 2023 et SMC complexes: Lifting the lid on loop extrusion (2022).
La façon dont le cycle ATP-hydrolyse est couplé aux changements conformationnels des complexes SMC pour produire l’extrusion de boucles d’ADN reste imparfaitement élucidée et, à ce jour, plusieurs modèles mécanistiques sont discutés dans la littérature :
- le modèle hold-and-feed, dans lequel la condensine maintient un segment d’ADN et en injecte un second dans le complexe par des changements conformationnels ATP-dépendants, modèle actuellement le mieux étayé expérimentalement,
- le modèle scrunching, dans lequel l’ADN serait compacté par un raccourcissement interne du complexe lors des transitions conformationnelles, modèle partiellement compatible avec certaines données mais insuffisant pour expliquer la directionnalité et la processivité de l’extrusion,
- le modèle Brownian-ratchet, qui décrit l’extrusion comme un mécanisme de rectification des fluctuations thermiques de l’ADN par des changements conformationnels ATP-dépendants, fournissant une interprétation physique plutôt qu’un mécanisme structural détaillé,
- le modèle DNA-segment capture/DNA-pumping, dans lequel l’ATPase agirait comme une pompe poussant activement l’ADN à travers le complexe, modèle conceptuellement simple mais trop imprécis sur le plan mécanistique.
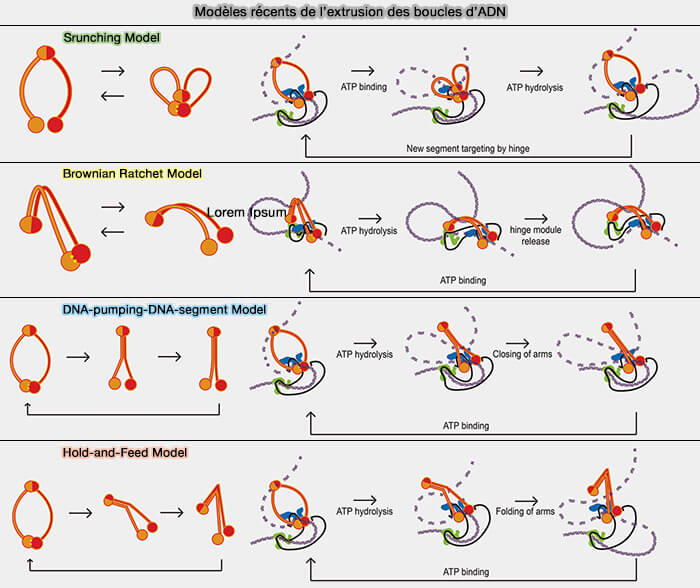
(Figure : vetopsy.fr d'après Moon et Ryu)
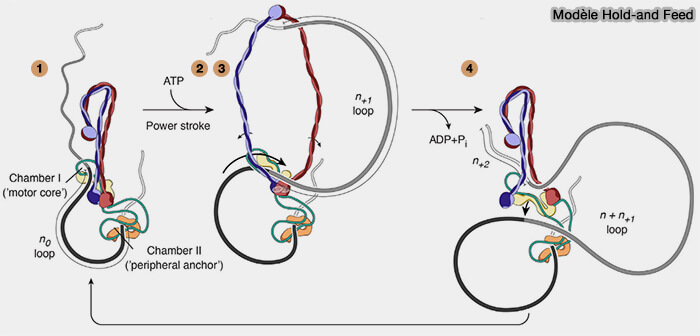
Dans le modèle hold-and feed qui domine actuellement, on peut décrire le fonctionnement en quatre états principaux. (A hold-and-feed mechanism drives directional DNA loop extrusion by condensin 2022).
- Le complexe SMC ne maintient pas l’ADN par un point d’ancrage unique, mais par un ensemble de surfaces de contact réparties le long de la kleisine et des domaines HEAT.
- Ces surfaces, riches en charges positives, interagissent de façon relativement stable avec le squelette phosphate de l’ADN et assurent ainsi le maintien continu d’un segment à l’intérieur du complexe tout au long du cycle ATPase.
Remarque : hold et feed sont des notions fonctionnelles décrivant des états de contact ADN-complexe, et non des structures fixes.
- Le segment hold correspond au fragment d’ADN qui, à un instant donné, établit les contacts les plus stables avec le complexe et constitue le point d’ancrage principal.
- FLe segment feed correspond au fragment d’ADN capturé de manière transitoire, positionné plus périphériquement dans le complexe, et susceptible d’être déplacé au cours du cycle ATPase.
1. Dans l'état 1, un premier segment d’ADN est retenu à l’intérieur de l’anneau et correspond au segment " hold ", qui signifie maintenu ou ancré dans l’anneau.
Le complexe est chargé, mais aucune extrusion active n’a encore lieu.
- ATP : absent ou ADP
têtes ATPase : séparées - porte tête-tête : ouverte
- porte kleisine-tête : fermée (anneau globalement intact)
2. Dans l’état 2, le complexe adopte une conformation plus compacte et devient compétent pour capturer un second segment d’ADN, selon le principe de segment capture.
a. Lorsque l’ATP se fixe et que la géométrie du complexe se modifie, ces contacts ne disparaissent pas brutalement.
- Ils se déplacent légèrement, se réorganisent, mais restent suffisants pour que l’ADN demeure associé au complexe.
- Cela explique pourquoi le complexe peut rester ancré sur un segment tout en devenant capable de recruter un second segment de la même molécule d’ADN.
b. La capture du second segment d'ADN repose sur des interfaces plus dynamiques, impliquant notamment certaines régions de la kleisine, les domaines HEAT repositionnés et, dans certains cas, des surfaces exposées des têtes ATPase.
- La capture de deux segments ne repose pas sur une séparation fonctionnelle stricte entre les deux moitiés du complexe, mais sur une redistribution dynamique des surfaces de contact ADN-protéine impliquant la kleisine et les domaines HEAT, induite par la liaison et l’hydrolyse de l’ATP.
- Pour bien comprendre, on peut utiliser la représentation suivante : la paume reste posée sur une corde (correspondant aux interactions HEAT + kleisine avec l’ADN), tandis que les doigts peuvent venir saisir un second point plus loin sur la même corde.
c. Ces zones permettent l’établissement d’un contact transitoire supplémentaire avec l’ADN, sans compromettre l’ancrage principal assuré par la surface HEAT-kleisine.
- deux molécules d’ATP : liées aux têtes
- têtes ATPase : engagées face à face,
- porte tête-tête : fermé.
(Figure : vetopsy.fr d'après Shaltiel et coll)
3. Dans l’état 3, le second segment d’ADN, rendu accessible en état 2, est effectivement capturé par le complexe et constitue le segment nouvellement capturé correspondant au segment " feed ", au sens de segment injecté dans le complexe.
a. Cet état correspond à la stabilisation effective de la capture.
b. Le complexe contient alors simultanément deux segments d’ADN dans des compartiments internes distincts, ce qui correspond directement au modèle hold-and-feed observé en cryo-EM.
- un segment d’ADN maintenu dans l’anneau (" hold "),
- un segment nouvellement capturé (" feed ").
4. Dans l’état 4, l’hydrolyse de l’ATP entraîne le transfert interne.
a. L’hydrolyse de l’ATP induit plusieurs changements.
- Les têtes ATPase se désengagent.
- La distance et l’orientation entre les points d’ancrage de la kleisine changent.
- Les domaines HEAT se repositionnent mécaniquement avec la kleisine.
- Les surfaces de contact ADN-protéine se redistribuent dans l’espace.
b. La conséquence directe est que :
- les contacts qui stabilisaient préférentiellement le segment « feed » deviennent plus favorables au centre de l’anneau,
- les contacts qui stabilisaient l’ancien segment « hold » ne disparaissent pas brutalement, mais deviennent progressivement moins dominants.
c. Le complexe reste toujours accroché à l’ADN dans son ensemble, mais l’endroit précis où l’ancrage est le plus fort se déplace.
- La reconfiguration structurale induite par l’hydrolyse de l’ATP fait que le segment capturé occupe désormais la position où les interactions sont les plus stabilisantes, tandis que l’ancien segment adopte une position plus périphérique.
- Il s’agit donc d’un transfert fonctionnel progressif du rôle d’ancrage, et non d’une alternance fixation-libération.
- Cette redistribution dynamique des interfaces ADN-protéine permet le transfert interne du segment capturé sans dissociation globale du complexe, ce qui assure la processivité et la directionnalité de l’extrusion.
d. La portion d’ADN contenue dans l’anneau est ainsi augmentée, ce qui agrandit la boucle.
e. C’est à ce stade que se produit effectivement l’extrusion de la boucle.
- ATP : hydrolysé
- têtes ATPase : désengagées
- porte tête-tête : ouverte
5. Le complexe revient à un état proche de l’état 1, mais avec une boucle plus grande, et peut engager un nouveau cycle de capture et de transfert.
À chaque cycle ATPase, la succession capture ➞ transfert ➞ agrandissement de la boucle se répète.
Études spécifiques des cohésines et des condensines
Biologie cellulaire et moléculaireConstituants de la celluleReproduction cellulaireMatériel génétiqueFuseauCycle cellulaireInterphasePhase G1Phase SPhase G2MitoseProphasePrométaphaseMétaphaseAnaphaseTélophaseCytokinèseAbcissionMéioseRégulation du cycle cellulaireCyclinesCDKComplexes Cyclines/CDKPoints de contrôles (checkponts)Enzymes mitotiquesMoteurs mitotiquesComplexes SMC (condensines et cohésines)BiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


