Complexe APC/C
Régulation extrinsèque
2. Point de contrôle du fuseau mitotique (SAC)
2.1 Prométaphase : activation du SAC
a. Formation de la plateforme (MPS1 et complexes BUB)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La prométaphase marque l’activation du point de contrôle du fuseau (SAC), initiée par MPS1 et les complexes BUB, qui établissent la plateforme kinétochorienne indispensable à la génération du signal inhibiteur.
Vue d'ensemble du SAC
1. Le SAC (Spindle Assembly Checkpoint) agit pendant la prométaphase et la métaphase de la mitose, phases pendant lesquelles les kinétochores des chromosomes s’attachent progressivement aux microtubules du fuseau mitotique.

Le SAC empêche la séparation prématurée des chromatides sœurs en bloquant l’activité de l’APC/CCdc20 tant que tous les kinétochores ne sont pas correctement attachés et soumis à une tension bipolaire stable.
(Figure : vetopsy.fr d'après Yamaguchi et coll)
2. Cette régulation s’inscrit dans la régulation extrinsèque, contrôle exercé par des signaux externes au complexe, assurant son activation ou son inhibition en fonction de l’état mitotique qui inclut :
- la phosphorylation des sous-unités de l’APC/C et l’inhibition par EMI1,
- d’autres signaux mitotiques modulant l’activité du complexe.
(Figure : vetopsy.fr d'après Fischer et coll)
3. Le SAC repose sur un réseau de protéines recrutées de manière hiérarchique sur les kinétochores non attachés, qui coopèrent pour :
- détecter l’absence de microtubules,
- amplifier le signal d’alerte,
- bloquer l’activation de l’APC/CCdc20.
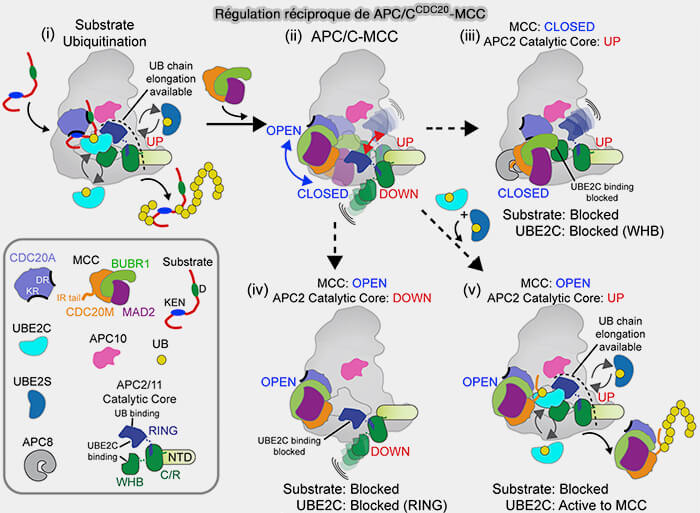
Leur organisation peut être envisagée comme une cascade d’assemblage dynamique aboutissant à la formation du MCC (Mitotic Checkpoint Complex), véritable inhibiteur du coactivateur Cdc20 par :
Prométaphase : activation du SAC (1)
Dès la rupture de l’enveloppe nucléaire, les microtubules du fuseau mitotique s’allongent vers les chromosomes, mais tous les kinétochores ne sont pas encore attachés.
(Figure : vetopsy.fr d'après Bolanos-Garcia)
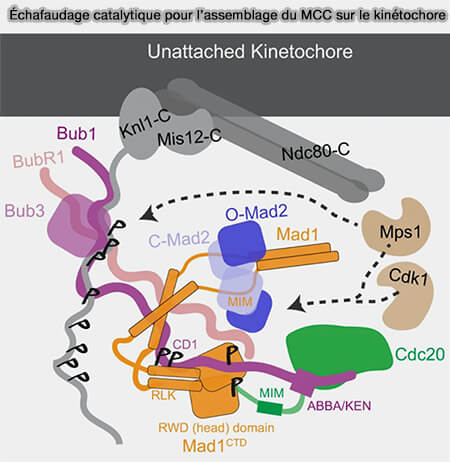
Ces kinétochores libres deviennent les sites d’activation du SAC, où s’organise une cascade multiprotéique déclenchée par la kinase MPS1.
MPS1 : kinase
initiatrice du signal
La kinase MPS1 (Monopolar spindle 1) reconnaît les kinétochores non attachés via leur interface externe, dominée par le complexe NDC80 (Hec1/Nuf2/Spc24/Spc25).
1. NDC80 forme la principale structure d’attache des microtubules au kinétochore externe (Mps1 kinase functions in mitotic spindle assembly and error correction 2025).
a. En l’absence de microtubules, le domaine CH de NDC80 est libre et permet la fixation transitoire de MPS1 à proximité de KNL1.
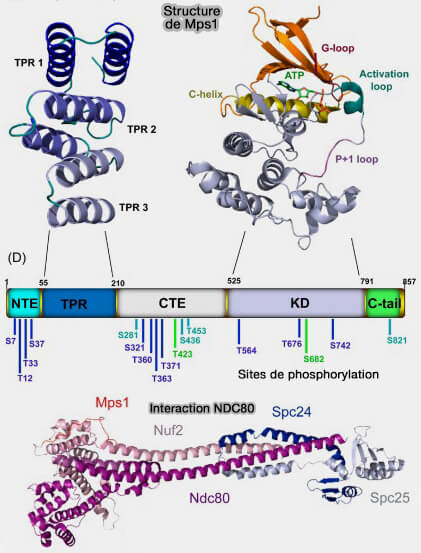
b. Cette localisation favorise l’autophosphorylation de MPS1 sur plusieurs résidus clés de sa boucle d’activation, i.e. Thr12, Ser15, Thr490 selon les espèces, conduisant à un état catalytiquement actif.
c. Ces autophosphorylations stabilisent sa conformation active et le domaine kinase phosphorylé acquiert alors une conformation ouverte qui positionne son site catalytique face aux motifs MELT de KNL1, ses principales cibles au départ.
| MPS1 | Substrat principal | Conséquence fonctionnelle |
|---|---|---|
| Autophosphorylation | MPS1 (Thr676) | Activation catalytique |
| Plateforme SAC | KNL1 (motifs MELT) |
Recrutement de Bub1/Bub3 |
| Stabilisation du SAC | Ancrage durable du complexe au kinétochore |
|
| Module MCC | Cdc20 | Maintien de l’inhibition de l’APC/C |
2. KNL1 (Kinetochore Null 1) constitue une protéine d’échafaudage majeure du kinétochore externe, servant de support au recrutement des complexes BUB impliqués dans le contrôle du fuseau.
a. Elle assure la liaison structurale entre le complexe MIS12, ancré à la couche interne du kinétochore, et les composants distaux comme NDC80, responsables de la capture des microtubules.
- Elle contient de multiples motifs MELT (Met-Glu-Leu-Thr), i.e. une douzaine chez l’Homme, qui deviennent les sites de phosphorylation primaires de MPS1, créant une série de sites d’ancrage phosphorylés pour le domaine WD40 de Bub3.
- Cette phosphorylation s’effectue de manière progressive et coopérative, chaque événement facilitant la fixation de nouveaux complexes BUB1/BUB3 et BUBR1/BUB3/
b. La phosphorylation séquentielle des motifs MELT par MPS1 transforme ainsi KNL1 en une véritable plateforme d’assemblage pour les complexes de surveillance du fuseau (A sequential multi-target Mps1 phosphorylation cascade promotes spindle checkpoint signaling 2017).
Complexes BUB : plateforme d’assemblage
Les motifs MELT phosphorylés de KNL1 (pMELT) recrutent les complexes BUB1:BUB3 et BUBR1:BUB3 par l’intermédiaire du domaine WD40 de BUB3, qui reconnaît spécifiquement les motifs pMELT créés par MPS1.
Cette double plateforme couple la phosphorylation de KNL1 à la génération du signal inhibiteur MAD1-MAD2, reliant la détection de l’attachement microtubulaire à la régulation directe de l’APC/C.
Les motifs MELT phosphorylés (pMELT) de KNL1 recrutent d’abord Bub1:Bub3
Bub3
Bub3 est une protéine WD40, i.e. adaptateur en forme de tonneau β servant de plateforme d’interaction (BUB3, beyond the Simple Role of Partner 2022).
1. Bub3 se lie aux répétitions phosphorylées de MELT (Met-Glu-Leu-Thr(P) de KNL1, la sous-unité du kinétochore externe (Bub3 reads phosphorylated MELT repeats to promote spindle assembly checkpoint signaling 2013).
a. La liaison à KNL1 se fait via la face interne du tonneau WD40 de Bub3.
- Cette surface contient plusieurs résidus basiques conservés (arginines et lysines) qui forment une poche cationique qui interagit directement avec la thréonine phosphorylée (pThr) du motif pMELT.
- Les résidus voisins (Met, Glu, Leu) stabilisent la liaison par des interactions hydrophobes et polaires complémentaires.
b. Cette interaction permet le recrutement stable du complexe BUB1:BUB3 sur les kinétochores, établissant la plateforme initiale du point de contrôle du fuseau.
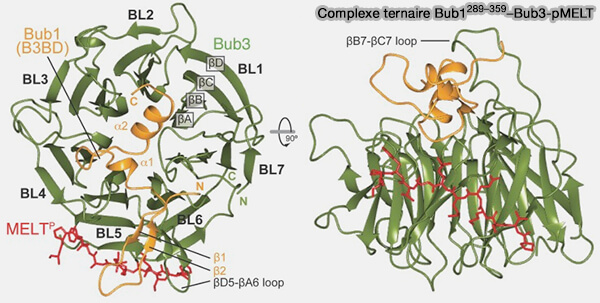
(Figure : vetopsy.fr d'après Primorac et coll)
2. Bub3 peut se lier avec Bub1 et BubR1, liaison qui implique la face externe de son motif WD et son pore central, et une séquence spécifique présente chez Bub1 et BubR1, appelée motif GLEBS (GLE2-binding sequence).
a. Le motif GLEBS adopte une conformation hélicoïdale étendue qui s’insère dans la surface concave du domaine WD40 de Bub3.
Ce module GLEBS-WD40 forme un hétérodimère stable Bub1:Bub3, ancré aux motifs pMELT de KNL1.
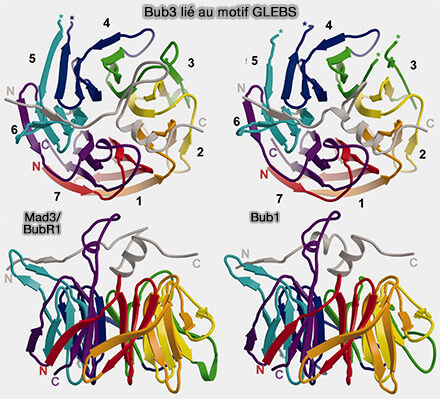
(Figure : vetopsy.fr d'après Larsen et coll)
b. Cette interaction GLEBS-WD40 (Structural analysis of Bub3 interactions in the mitotic spindle checkpoint 2007) :
- ancre Bub3 à Bub1 ou BubR1,
- stabilise la conformation du complexe,
- positionne Bub3 dans une orientation qui expose sa face concave vers KNL1, optimisant la reconnaissance du motif pMELT phosphorylé.
3. Cet ancrage dépend de MPS1 et constitue la plateforme initiale du SAC.
Bub1
Bub1 (Budding uninhibited by benzimidazoles 1) est une protéine modulaire de 1085 résidus chez l’Homme.
1. Sa structure est organisée en quatre grands domaines fonctionnels.
a. Le domaine N-terminal (1-250) contient une région coiled-coil qui :
- assure la dimérisation et la liaison avec BubR1,
- sert d’interface avec Mad1-Mad2 et contribue au positionnement du complexe sur le kinétochore externe.
b. La région centrale (250-450) porte le motif GLEBS reconnu par le domaine WD40 de Bub3.
c. La région intermédiaire (450-720) contient plusieurs sous-domaines.
- Le domaine CD1 est un domaine de liaison à Mad1, lors de phosphorylation de Bub1 par MPS1.
- Une KEN-box (K1) est le principal site d’interaction directe entre Bub1 et Cdc20.
- Cette interaction initie la capture de Cdc20 par Bub1 et sert de plateforme de présentation pour Mad1-Mad2, facilitant la formation du complexe C-Mad2-Cdc20.
- Elle joue donc un rôle catalytique dans la genèse du MCC, sans inhiber durablement Cdc20.
- Un motif ABBA (A1), dont le rôle additif et régulateur, contribue à stabiliser la liaison transitoire de Cdc20 à Bub1, renforçant l’efficacité du transfert de Cdc20 vers Mad2.
- Une KEN-box (K2), peu conservée entre espèces et qui n’interagit pas directement avec Cdc20 dans la formation du MCC, pourrait stabiliser les interactions internes du réseau Bub (Bub1 kinase acts as a signalling hub for the entire Cryptococcus neoformans spindle assembly checkpoint pathway 2022).
d. Le domaine kinase C-terminal (720-1085), homologue à celui de BubR1, mais fonctionnellement distinct.
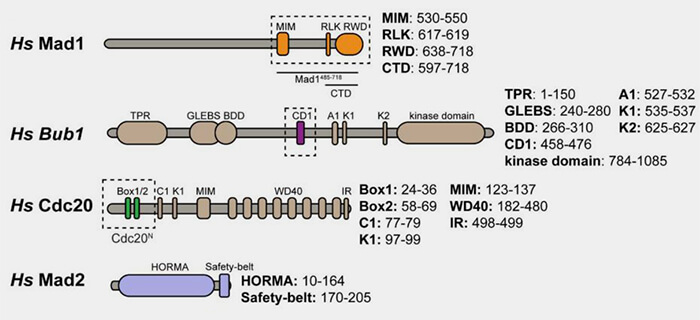
(Figure : vetopsy.fr d'après Fischer et coll)
2. Bub1 est une sérine/thréonine kinase dont les fonctions non catalytiques sont majoritaires.
a. Dans son rôle central dans l’assemblage du SAC :
- elle agit comme échafaudage pour le complexe Mad1-Mad2, en le positionnant à proximité de MPS1, facilitant la formation du MCC,
- elle participe au recrutement de BubR1:Bub3, par interaction via ses domaines coiled-coil et GLEBS, assurant la stabilisation du réseau de surveillance au kinétochore.
b. Dans son rôle catalytique modéré et contextuel, Bub1 phosphoryle l’histone H2A sur Thr120, générant un site de liaison pour Sgo1 (Shugoshin), qui protège la cohésion centromérique durant la prométaphase.
Cette activité contribue également à maintenir le SAC actif tant que la tension bipolaire sur les kinétochores n’est pas établie.
3. Une fois Bub1:Bub3 fixé sur les motifs pMELT de KNL1, la kinase MPS1 phosphoryle Bub1 sur plusieurs résidus sérine et thréonine situés dans sa région intermédiaire pour permettre le liaison avec Mad1 (
BubR1
BubR1 (Budding Uninhibited by Benzimidazoles-related 1) est le pendant fonctionnel de Bub1, mais il agit à un niveau distinct du point de contrôle du fuseau (SAC).
- Alors que Bub1 intervient en amont, en déclenchant la signalisation du SAC depuis les kinétochores non attachés, BubR1 opère en aval, au cœur du complexe inhibiteur MCC (Mitotic Checkpoint Complex), pour bloquer directement l’activité de l’APC/CCdc20.
- Bub1 active le checkpoint, tandis que BubR1 en assure l’exécution inhibitrice en recrutant Bub3 et Cdc20, formant ainsi un verrou moléculaire empêchant toute ubiquitination prématurée des substrats mitotiques.
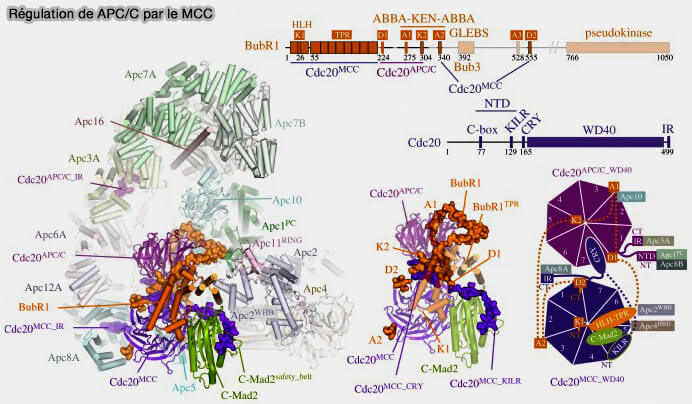
(Figure : vetopsy.fr d'après Alfieri et coll)
1. BubR1 est constitué de plusieurs domaines fonctionnels qui traduisent sa double implication dans le SAC, i.e. l’inhibition initiale de l’APC/C et sa désactivation ultérieure.
- Le domaine N-terminal contient deux KEN-box, responsables de la liaison directe à Cdc20, cœur de l’activité inhibitrice du MCC.
- Le domaine central interagit avec Bub3, via motif GLEBS, et Bub1 via son coiled-coil.
- Le domaine C-terminal possède un motif KARD (Kinase-Associated Region for PP2A Recruitment) permettant le recrutement de la phosphatase PP2A-B56, qui joue un rôle dans le silencing du SAC, i.e. levée du checkpoint.
Outre ses deux KEN-box N-terminales, BubR1 contient un D-box non canonique qui contribue à la stabilisation du MCC sans être un signal de dégradation effectif.
Ainsi, la structure modulaire de BubR1 reflète sa dualité fonctionnelle (The Molecular Biology of Spindle Assembly Checkpoint Signaling Dynamics 2015).
- Il agit d’abord comme inhibiteur de l’APC/CCdc20.
- Puis, via le recrutement de PP2A-B56, comme médiateur de la désactivation contrôlée du checkpoint.
2. BubR1 forme avec Bub3 un complexe hétérodimérique stable (BubR1:Bub3) recruté sur les motifs MELT phosphorylés de KNL1.
Il joue un rôle central dans la formation du MCC (Mitotic Checkpoint Complex), principal inhibiteur de l’APC/CCdc20, tout en participant à la désactivation progressive du SAC lorsque la tension est rétablie.
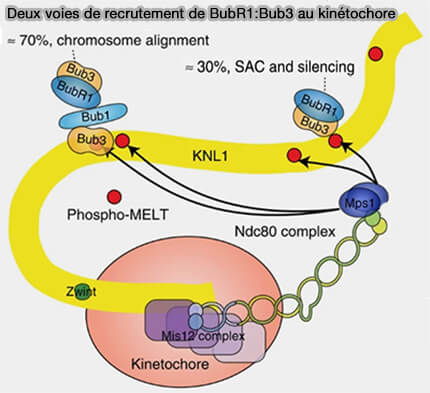
(Figure : vetopsy.fr d'après Zhang et coll)
3. BubR1:Bub3 est recruté au kinétochore par deux voies (Two functionally distinct kinetochore pools of BubR1 ensure accurate chromosome segregation 2016).
a. La voie indirecte, environ 70 % des complexes, est dépendante de Bub1, i.e. Bub1:Bub3 ancré sur pMELT recrute BubR1:Bub3.
- Bub1 et BubR1 possèdent un domaine coiled-coil N-terminal qui leur permet de s’homodimériser ou s’hétérodimériser.
- Cette interaction coiled-coil Bub1-BubR1 stabilise temporairement BubR1 au kinétochore en proximité immédiate de Bub1:Bub3 déjà fixé sur KNL1.
- Une fois cette association formée, BubR1 reste lié via Bub3 à KNL1, même si Bub1 se dissocie ensuite.
b. La voie directe, par liaison de BubR1:Bub3 aux motifs pMELT de KNL1, représente environ 30 % des complexes.
c. Cette double voie assure la robustesse du signal SAC même en cas de perte partielle de Bub1 et l’ensemble des complexes Bub1:Bub3 et BubR1:Bub3 constitue une plateforme intégrée reliant la phosphorylation de KNL1 à la génération du signal inhibiteur vers l’APC/CCdc20.
Prométaphase : activation du SAC :
2. Structure de Mad1, Mad2 et leur interaction
Sur la plateforme formée par BUB1 au niveau de KNL1, le complexe MAD1-MAD2 constitue le cœur du mécanisme de conversion du signal du SAC, transformant l’absence d’attachement en signal inhibiteur.


