Complexe APC/C
Régulation extrinsèque
2. Point de contrôle du fuseau mitotique (SAC)
2.1. Prométaphase : activation du SAC
d. MCC : complexe inhibiteur du coactivateur Cdc20
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le complexe MCC (Mitotic Checkpoint Complex), formé de C-Mad2, Cdc20, BubR1 et Bub3, constitue l’inhibiteur central de l’APC/C, assurant le blocage temporaire de la ségrégation chromosomique tant que le fuseau n’est pas stabilisé.
MCC : complexe inhibiteur du coactivateur Cdc20
La forme active du point de contrôle est le MCC (Mitotic Checkpoint Complex), constitué de Mad2, BubR1, Bub3 et Cdc20 qui se fixe sur l’APC/C et inhibe sa fonction ubiquitine-ligase.
1. Une fois formé au niveau du kinétochore, le complexe C-Mad2-Cdc20, souvent noté pre-MCC ou MCC-intermédiaire, n’est pas stable à long terme et quitte le kinétochore pour le cytoplasme.
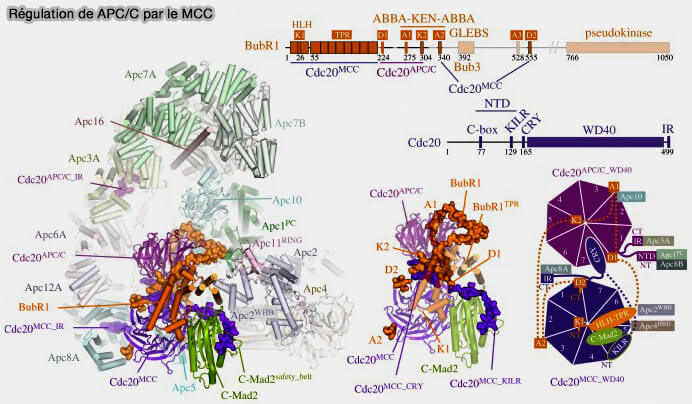
(Figure : vetopsy.fr d'après Alfieri et coll)
Mécanisme
Une fois libéré, le complexe C-Mad2-Cdc20, souvent désigné comme pré-MCC ou MCC intermédiaire, diffuse dans le cytosol où il rencontre le dimère BubR1:Bub3, déjà constitué mais non encore intégré au complexe inhibiteur (Visualizing the complex functions and mechanisms of the anaphase promoting complex/cyclosome (APC/C) 2017).
1. BubR1 a déjà formé un hétérodimère stable avec Bub3 via son motif GLEBS, semblable à celui de Bub1, impliqué dans la reconnaissance initiale des motifs pMELT de KNL1.
Bub3 ne lie pas Cdc20 directement et stabilise la conformation de BubR1 et oriente son interaction vers le complexe C-Mad2-Cdc20, qui sert de plateforme de recrutement.
À ce stade, Cdc20 est encore partiellement actif et n’est pas complètement bloqué, mais l’association de BubR1 transforme cette pré-forme en MCC complet, apte à inhiber l’APC/CCdc20.
2. BubR1 contient dans sa région N-terminale deux KEN-box (KEN1 et KEN2) et une région pseudo-substrat D-box-like qui imitent les motifs des substrats naturels de l’APC/C, comme la sécurine ou la cycline B.
Cdc20 reconnaît ces KEN-box, établissant une interaction de type leurre qui occupe le site de reconnaissance des substrats réels : c’est le mécanisme central d’inhibition de l’APC/C.
3. C-Mad2 maintient Cdc20 verrouillé, empêchant sa libération grâce à son interaction avec le motif domaine MIM (Mad2-interacting motif),) situé dans la région N-terminale de Cdc20.
4. La formation du complexe C-Mad2-Cdc20-BubR1-Bub3 devient le MCC (Mitotic Checkpoint Complex) pleinement fonctionnel dans le cytoplasme.

À ce stade, Cdc20 est totalement neutralisé et ne peut plus recruter de substrats ubiquitinables.
Ce MCC cytosolique devient alors apte à se fixer sur l’APC/C, où il bloque directement la fonction ubiquitine-ligase du complexe.
- Cette interaction établit le lien fonctionnel entre la surveillance du fuseau et la régulation catalytique de l’APC/C, assurant que la dégradation des substrats mitotiques n’intervienne qu’après satisfaction du checkpoint.
Fixation du MCC sur l’APC/C et
inhibition de l’activité ubiquitine-ligase
Une fois formé dans le cytoplasme, le Mitotic Checkpoint Complex (MCC), composé de C-Mad2, Cdc20, BubR1 et Bub3, se lie à l’APC/C (Anaphase-Promoting Complex/Cyclosome) formant un complexe quaternaire stable qui neutralise son activité catalytique.
Ce verrouillage empêche l’ubiquitination de la sécurine et de la cycline B, retardant la transition vers l’anaphase tant que le fuseau n’est pas correctement attaché.
Ancrage structural du MCC sur l’APC/C
1. Le MCC se fixe sur l’APC/C via la sous-unité APC8 au sein du module TPR (tetratricopeptide repeat), i.e. interface qui stabilise le complexe inhibiteur et oriente Cdc20 vers une position bloquée.
Cette interface stabilise l’association du MCC et oriente Cdc20 dans une position contrainte, empêchant son alignement normal avec le cœur catalytique APC2-APC11.
a. C-Mad2 interagit directement avec la région MIM (Mad2-interacting motif) du Cdc20, masquant les sites de reconnaissance des substrats porteurs de D-box ou de KEN-box.
Cette interaction immobilise le coactivateur et empêche son accès à la cavité de liaison des substrats sur l’APC/C.
b. BubR1, via ses deux KEN-box, agit comme leurre compétitif et imite les substrats naturels de l’APC/C et s’interpose entre Cdc20 et le cœur catalytique APC2-APC11, bloquant la transmission du signal d'ubiquitination.
c. Bub3, associé à BubR1 par le motif GLEBS, se positionne à la base du module TPR, consolidant la structure globale du complexe inhibiteur et renforçant sa stabilité.
2. Ainsi, l’ensemble des interactions entre C-Mad2, BubR1, Bub3 et Cdc20 crée une architecture d’inhibition multiple.
Le coactivateur est à la fois masqué, désaligné et compétitivement bloqué, assurant la paralysie complète de l’activité ubiquitine-ligase de l’APC/C tant que le point de contrôle du fuseau reste actif.
Configuration inhibée de l’APC/C et rôle des sous-unités associées
1. Ce processus produit un état “ fermé ” d'APC/C (Cryo-EM of Mitotic Checkpoint Complex-Bound APC/C Reveals Reciprocal and Conformational Regulation of Ubiquitin Ligation 2016).
a. Le bras catalytique APC2-APC11, où se fixent les E2, i.e. UBE2C ou UBE2S, reste inactif.
- La conformation CRL-up nécessaire à l’ubiquitination ne peut plus se former.
- Les substrats typiques, i.e. sécurine, cycline B ne peuvent plus s’engager dans le canal catalytique.
b. Ce verrouillage est purement stérique, i.e. l’enzyme n’est pas dénaturée, mais mécaniquement empêchée d’opérer.
C’est la raison pour laquelle le relâchement du SAC, lorsque les kinétochores sont tous attachés, permet une réactivation rapide de l’APC/C (
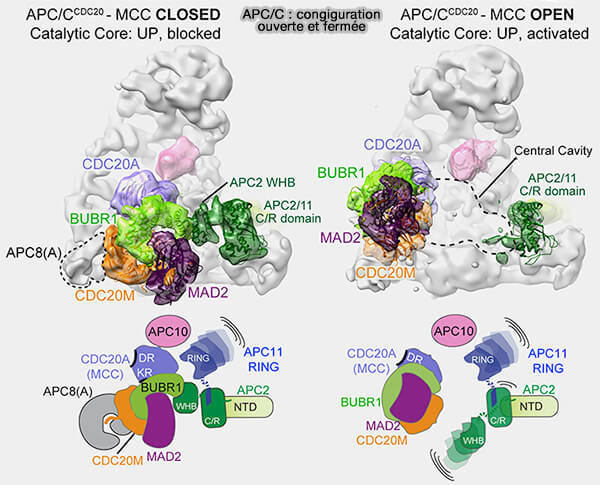
(Figure : vetopsy.fr d'après Yamaguchi et coll)
3. Certaines sous-unités de l’APC/C jouent un rôle déterminant dans la stabilisation et la régulation du complexe MCC.
a. L’ensemble APC2-APC4/5 forme le noyau mécanique de la plateforme, reliant le module TPR au module catalytique APC2-APC11 et contrôlant la transition entre états actif et inhibé.
- APC4, au contact de la région N-terminale de Cdc20, contribue à verrouiller la conformation fermée du complexe, limitant l’accès des substrats aux sites catalytiques.
- APC5, associé à APC4, agit comme pivot structurel, stabilisant la configuration inhibée et coordonnant la bascule mécanique du bras catalytique.
b. APC3, riche en répétitions TPR, interagit avec BubR1 et participe à l’ancrage du MCC sur la plateforme.
c. APC15 joue un rôle plus dynamique en stabilisant temporairement BubR1 et facilite la dissociation du MCC une fois le SAC levé.
d. APC1, dont la boucle N-terminale est phosphorylée par le complexe cycline B/CDK1, régule la dynamique de fixation et de détachement du MCC, assurant la synchronisation entre activation et désactivation de l’APC/C.

Cette configuration verrouille l’APC/C dans un état inactif, incapable d’amorcer l’ubiquitination des substrats.
4. Chaque kinétochore non attaché fonctionne comme une unité de signalisation autonome, générant en continu des complexes MCC.
- La conversion continue d’O-Mad2 en C-Mad2 maintient un flux constant de MCC cytosoliques, suffisants pour inhiber la totalité de l’APC/C dans la cellule.
- Ainsi, même un seul chromosome non attaché suffit à bloquer la progression mitotique.
Le SAC est alors pleinement actif et inhibe la dégradation de la sécurine et de la cycline B, bloquant toute entrée prématurée en anaphase.


