Complexe APC/C :
Mécanisme
2. Mécanisme catalytique des enzymes E2 Ube2C et Ube2S
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les enzymes E2 Ube2C et Ube2S agissent de manière séquentielle au sein de l’APC/C : la première amorce la monoubiquitination du substrat, la seconde prolonge la chaîne K11 polyubiquitine assurant sa dégradation.
Association des enzymes E2~Ub au complexe APC/C
Dans le cycle général de l’ubiquitination, l’expression " transfert de l’ubiquitine à l’enzyme E3 " prête souvent à confusion.
- En effet, ce n’est pas la ligase E3 qui catalyse le transfert, mais l’enzyme E2, dont le groupement thioester réagit avec la fonction amine d’une lysine du substrat pour former la première liaison isopeptidique.
- L'association fonctionnelle entre l’enzyme de conjugaison E2~Ub et la ligase E rend le complexe catalytiquement compétent, l’APC/C assurant la précision structurale et la coordination spatiale du processus d’ubiquitination.
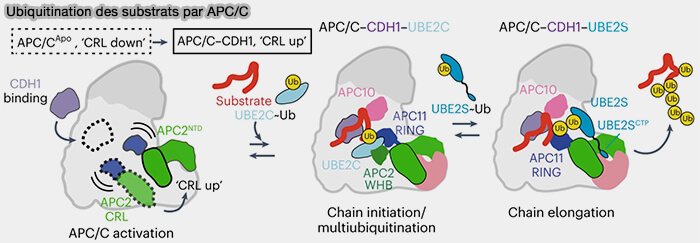
(Figure : vetopsy.fr d'après Bodrug et coll)
L’activité catalytique de l’APC/C dépend de l’action séquentielle de deux enzymes (
- Ube2C (UBCH10) qui initie la réaction par la mono-ubiquitination du substrat,
- Ube2S qui prolonge la chaîne polyubiquitine, principalement par des liaisons K11.
Ube2C (enzyme d’amorçage)
Vue d'ensemble
L'enzyme d’amorçage Ube2C (UBCH10) catalyse le transfert de la première ubiquitine activée sur une lysine accessible du substrat, souvent située à proximité du dégron reconnu.
Cette étape correspond à la monoubiquitination ou à la formation d’une courte chaîne (1 à 3 ubiquitines), indispensable pour créer un site d’ancrage initial.
1. Ube2C positionne E2~Ub, i.e. l’UB " donneur ", face à la lysine du substrat, en entrant en interaction simultanément avec :
- le domaine RING d’APC11, via son domaine UBC,
- le bras WHB C-terminal d’APC2.
Son activité est favorisée par la conformation " ouverte " du complexe APC/C induite par la liaison du coactivateur, Cdc20 ou Cdh1.
Remarque : Ube2C présente une affinité élevée pour les substrats porteurs de D-box, typiques de la métaphase, comme la sécurine et la cycline B1.
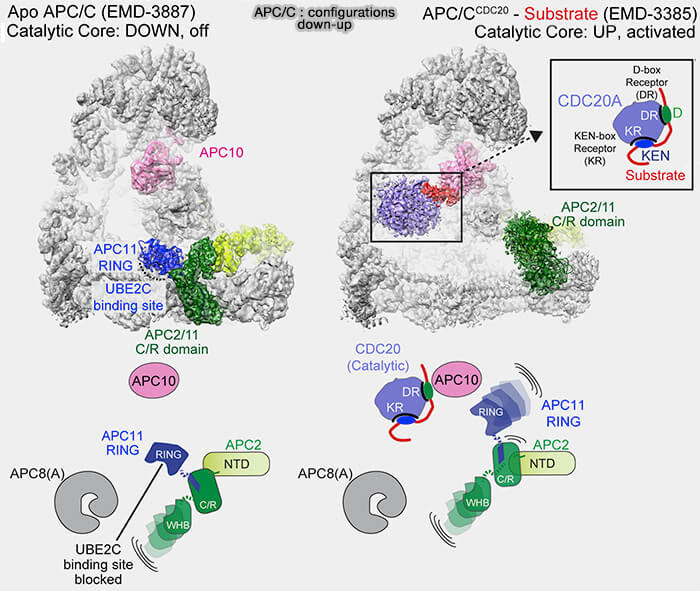
(Figure : vetopsy.fr d'après Yamaguchi et coll)
2. Le module catalytique (CRL) de l’APC/ bascule vers le haut (CRL-down ➞ CRL-up), ce qui rapproche APC11-RING/APC2-WHB du substrat recruté par Cdc20/Cdh1, étape clef pour l’attaque nucléophile du groupe ε-amine de la lysine (Time-resolved cryo-EM (TR-EM) analysis of substrate polyubiquitination by the RING E3 anaphase-promoting complex/cyclosome (APC/C) 2023).
(Figure : vetopsy.fr d'après Bodrug et coll)
Mécanisme
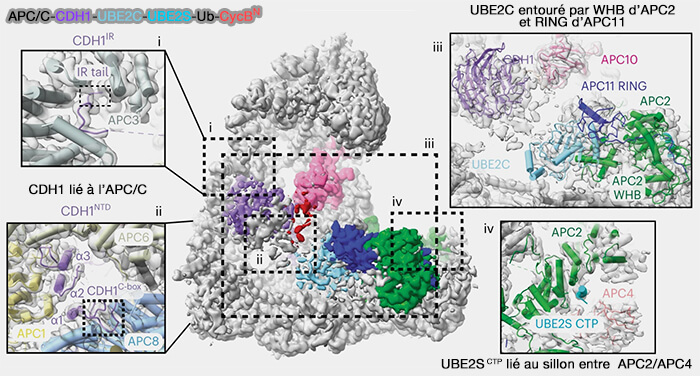
Dans la conformation active CRL-up, le module APC2-APC11 adopte une géométrie en " pince " dans laquelle le domaine RING d’APC11 et le domaine WHB d’APC2 forment un site d’accueil bilatéral pour l’enzyme Ube2C~Ub.
Ube2C s’insère littéralement entre ces deux domaines, stabilisée par des contacts hydrophobes et électrostatiques qui maintiennent son orientation catalytique optimale.
1 L’interface principale repose sur le contact direct du domaine catalytique UBC d’Ube2C avec le RING d’APC11, suivant un mode d’interaction typique des ligases E3.
a. Les résidus Cys114 (site actif) et Phe63-Leu65 d’Ube2C forment une poche d’interaction hydrophobe qui s’aligne contre la surface RING.
- APC11 stabilise cette interaction via des résidus Cys53-His55-Cys56, coordonnant un ion Zn++ qui rigidifie le motif catalytique RING-E2.
- Le groupement thioester E2~Ub est ainsi positionné de manière à projeter l’ubiquitine activée vers la lysine du substrat.
b. Ce contact RING-UBC est transitoire mais précis : il permet le transfert d’ubiquitine sans immobiliser l’E2, garantissant une rotation libre du complexe Ube2C~Ub autour de la cystéine active.
(Figure : vetopsy.fr d'après Yamaguchi et coll)
2. Le bras WHB d’APC2, replié vers le RING d'APC11, forme le second point d’appui pour Ube2C.
- Son extrémité C-terminale contient des résidus acides (Asp-Glu) qui établissent des liaisons ioniques avec des régions basiques d’Ube2C.
Cette interaction bloque littéralement l’enzyme entre les deux domaines, tout en maintenant une souplesse rotationnelle indispensable pour l’attaque nucléophile.
3. Cette disposition crée un couloir réactionnel reliant :
- le bras WHB d’APC2, qui agit comme un levier positionnant l’E2,
- le RING d’APC11, qui interagit directement avec le domaine UBC d’Ube2C.

Le bras catalytique (APC2CCD-APC2WHB-APC11RING) s’oriente vers le substrat recruté par Cdc20 ou Cdh1, permettant à la cystéine active d’Ube2C~Ub d’être alignée avec la lysine cible du substrat.
Dynamique fonctionnelle
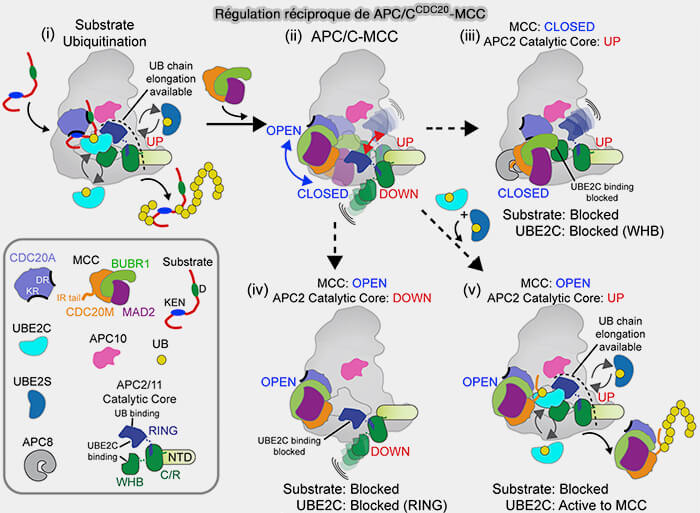
1. Lorsque la réaction de transfert s’achève, le bras WHB d’APC2 recule légèrement (≈ 15-20 Å), ouvrant la pince catalytique et entraînant la libération progressive d’Ube2C après l’amorçage de la chaîne (1 à 3 ubiquitines).
- Le retrait du bras WHB et la fermeture partielle du module APC2-APC11 réduisent l’affinité du domaine RING d’APC11 pour Ube2C.
- Ils orientent la surface catalytique de la position " ouverte " favorable à Ube2C, à une position " fermée ", optimale pour l’engagement d’Ube2S, dont le peptide C-terminal (CTP) peut alors s’ancrer sur l’interface APC2-APC4/5.
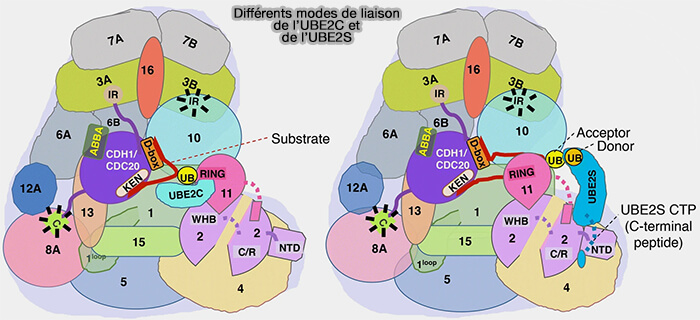
(Figure : vetopsy.fr d'après Bansal et Tiwari)
2. Ce mécanisme de bascule (“swinging-arm mechanism”) assure la continuité du processus catalytique et prépare le remplacement d’Ube2C par Ube2S (Mechanism of polyubiquitination by human Anaphase Promoting Complex: RING repurposing for ubiquitin chain assembly 2014).
Remarque : Ube2C retourne dans le pool cytosolique et est rechargée par l’enzyme E1 (UBA1/UBE1).
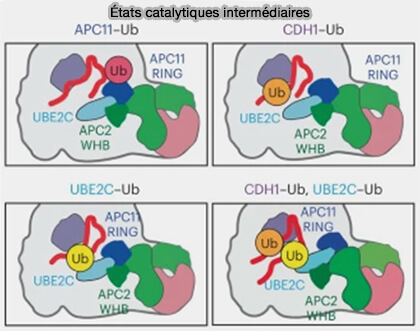
(Figure : vetopsy.fr d'après Bodrug et coll)
3. Plusieurs états catalytiques intermédiaires peuvent être capturés lors de la phase d’amorçage assurée par Ube2C (Time-resolved cryo-EM (TR-EM) analysis of substrate polyubiquitination by the RING E3 anaphase-promoting complex/cyclosome (APC/C) 2023).
a. Une succession de liaisons ubiquitine transitoires accompagnent la mise en place de la conformation active du complexe.
- sur un exosite du domaine RING d’APC11, distinct du site catalytique principal, i.e. liaison temporaire qui participe à la stabilisation du complexe E2~Ub-RING avant le transfert effectif,
- sur le coactivateur CDH1, soulignant son action non seulement comme adaptateur de substrat, mais aussi comme récepteur transitoire d’ubiquitine, renforçant ainsi la cohésion du complexe catalytique,
- simultanément sur CDH1 et à Ube2C, ce qui traduit la phase de transition où l’ubiquitine donneuse bascule vers la lysine du substrat.
b. L’apparition d’une di-ubiquitine associée aux zones CDH1-Ube2C reflète la fin du transfert et le début de la phase d’élongation, annonçant l’intervention d’Ube2S.
c. La présence de ces ubiquitines précoces stabilise la conformation CRL-up du module catalytique APC2-APC11, favorisant l’alignement du substrat et de l’enzyme E2~Ub et préparant ainsi la transition vers la phase d’élongation catalysée par Ube2S.

(Figure : vetopsy.fr d'après Bodrug et coll)
Ube2S (enzyme d'élongation)
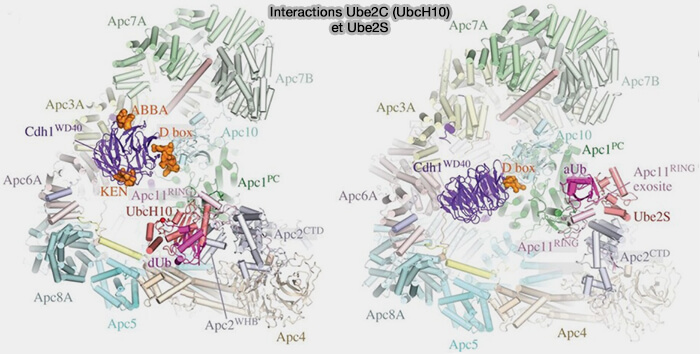
(Figure : vetopsy.fr d'après Alfieri et coll)
Vue d'ensemble
Une fois la chaîne amorcée, Ube2S prend le relais d'Ube2C pour assurer l’élongation processive des chaînes polyubiquitine (Ubiquitin chain-elongating enzyme UBE2S activates the RING E3 ligase APC/C for substrate priming 2020).
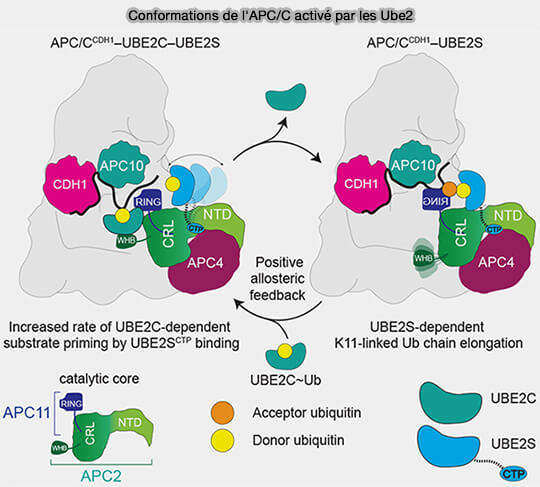
(Figure : vetopsy.fr d'après Martinez-Chacin et coll)
Contrairement à Ube2C, Ube2S ne peut pas amorcer la réaction car son site catalytique n’est pas adapté à un substrat protéique, mais possède, en revanche, une spécificité stricte pour les liaisons K11 typiques des chaînes polyubiquitine générées par l’APC.
1. Ube2C possède une interface large et hydrophobe qui lui permet d’interagir efficacement avec le substrat recruté par Cdc20/Cdh1 et de positionner sa cystéine active (Cys114) face à une lysine libre du substrat.
Sa géométrie " substrat-E2~Ub " directe est adaptée à la monoubiquitination.
2. Ube2S, au contraire, présente une surface catalytique plus lisse et moins complémentaire, optimisée non pas pour un substrat protéique, mais pour une ubiquitine déjà fixéee.
- Ube2S agit dans une géométrie " Ub-E2~Ub ", où sa cystéine active est alignée non avec une lysine du substrat, mais avec la lysine 11 d’une ubiquitine déjà liée, i.e. elle est structurée pour étendre une chaîne, et non pour l’amorcer.
- En outre, le site catalytique d’Ube2S contient une poche de reconnaissance spécifique pour le motif hydrophobe Ile44-Val70 de l’ubiquitine accepteur, orientant sa Lys11 vers la cystéine active, i.e. cette orientation exclut les autres lysines, i.e. K48, K63…), d’où la stricte spécificité de liaison K11.
Mécanisme
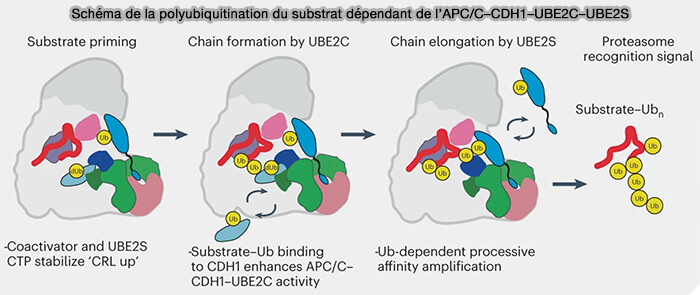
(Figure : vetopsy.fr d'après Bodrug et coll)
1. Ube2S s'associe au domaine RING d’APC11, comme Ube2C, mais pas au bras WHB d’APC2 (Ubiquitin chain-elongating enzyme UBE2S activates the RING E3 ligase APC/C for substrate priming 2020).
- Des contacts hydrophobes stabilisent l’alignement du groupement thioester E2~Ub avec la lysine K11 de l’ubiquitine accepteur déjà liée au substrat.
- Des ponts salins secondaires assurent une orientation catalytique fixe pendant la phase d’élongation.
2. En revanche, Ube2S établit une interface spécifique grâce à son peptide C-terminal (CTP).
- Ce CTP, constitué des résidus 154-163, est riche en acides aminés hydrophobes et acides, qui s’insèrent dans une rainure formée à l’interface APC2-APC4/5, près de la base du bras WHB (Mechanisms for the temporal regulation of substrate ubiquitination by the anaphase-promoting complex/cyclosome 2019).
- Cette interaction constitue un ancrage mécanique et impose un angle catalytique qui aligne la Lys11 de l’ubiquitine acceptrice avec le thioester de l’ubiquitine donneuse, favorisant exclusivement la formation de liaisons isopeptidiques K11.

(Figure : vetopsy.fr d'après Bansal et Tiwari)
3. Ces interactions aboutissent à une géométrie catalytique " fermée " où la cystéine active d’Ube2S et la lysine K11 de l’ubiquitine accepteur sont distantes d’environ 3,4 Å, permettant un transfert rapide et répétitif.
- Cette conformation, stabilisée par la double interaction RING-CTP, maintient Ube2S solidement arrimée à l’APC/C et limite la dissociation de l’enzyme après chaque transfert d’ubiquitine.
- Elle favorise ainsi la formation de chaînes K11 uniformes, marque distinctive des substrats APC/C-dépendants, tout en induisant une rotation du bras WHB d’APC2 d’environ 20°, marquant la transition entre les phases d’amorçage et d’élongation.
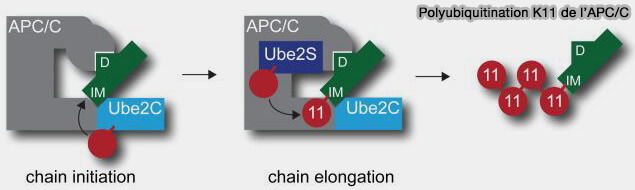
(Figure : vetopsy.fr d'après Wickliffe et coll)
4. Cette coopération hiérarchisée entre Ube2C (amorçage) et Ube2S (élongation) confère à l’APC/C sa remarquable processivité et sa capacité à générer des chaînes polyubiquitine K11 de longueur variable mais à topologie constante, garantissant une dégradation efficace et irréversible des protéines mitotiques.
Ces chaînes K11 seront ensuite reconnues par le protéasome 26S, assurant une dégradation rapide et irréversible des protéines mitotiques.
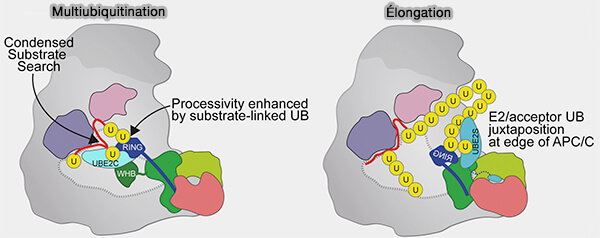
(Figure : vetopsy.fr d'après Brown et coll)


