Modifications post-traductionnelles des protéines
Ubiquitination : mono et polyubiquitination
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La mono- et la polyubiquitination reposent sur la capacité de l’ubiquitine à former des chaînes de topologies variées, déterminant le destin fonctionnel des protéines cibles.
L’ubiquitination (ou ubiquitinylation) est une modification post-traductionnelle consistant en la fixation covalente d’une ou plusieurs molécules d’ubiquitine sur une protéine cible.
Elle conduit :
- soit à une monoubiquitination, lorsqu’une seule ubiquitine est attachée au substrat,
- soit à une polyubiquitination, lorsque plusieurs ubiquitines s’enchaînent sur un même site ou sur différents résidus lysine du substrat.
Monoubiquitination
La monoubiquitination correspond à la conjugaison d’une seule molécule d’ubiquitine sur un résidu lysine du substrat.
1. Contrairement à la polyubiquitination, elle ne cible pas la protéine pour la dégradation protéasomale, mais contrôle de nombreux processus non protéolytiques, notamment :
- la régulation transcriptionnelle par modification des histones H2A et H2B,
- la réparation de l’ADN, via la monoubiquitination de PCNA (Proliferating Cell Nuclear Antigen),
- la signalisation membranaire et l’endocytose, par marquage transitoire de récepteurs tels qu’EGFR ou Notch.
2. La monoubiquitination fait intervenir le même ensemble enzymatique, i.e. E1, E2, E3 que la polyubiquitination, mais le processus est arrêté après la première conjugaison, souvent par absence de lysines accessibles sur l’ubiquitine liée ou par la spécificité du complexe E3.
- La balance entre monoubiquitination et désubiquitination, assurée par les DUB (désubiquitinases), détermine la durée du signal.
- Ce mécanisme constitue ainsi un modulateur fin de la dynamique des complexes protéiques plutôt qu’un signal de dégradation.
Types de liaisons dans la polyubiquitination
La polyubiquitination peut s’effectuer selon deux modes distincts :
- par liaison linéaire canonique, reliant l’extrémité C-terminale d’une ubiquitine à l’extrémité N-terminale de la suivante,
- par liaisons isopeptidiques impliquant les résidus lysines internes de l’ubiquitine.
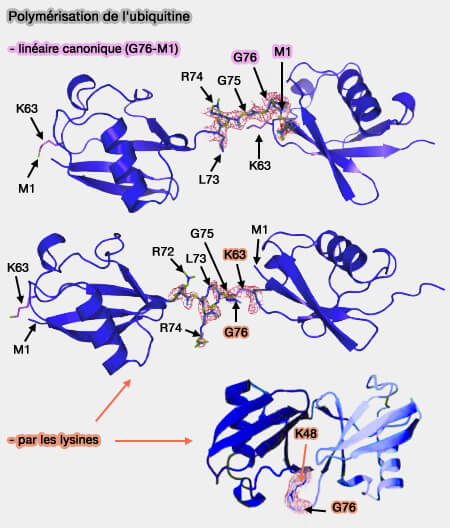
(Figure : vetopsy.fr d'après Komander)
Polyubiquitination par liaison peptidique canonique linéaire
1. L'ubiquitine peut se polymériser en formant une liaison peptidique canonique linéaire entre :
- la glycine76 C-terminale d'une ubiquitine,
- la méthionine1 de la suivante (Molecular discrimination of structurally equivalent Lys 63-linked and linear polyubiquitin chains 2009).
2. Ce mode d’assemblage, catalysé notamment par le complexe LUBAC, produit des chaînes linéaires M1 jouant un rôle clé dans la signalisation NF-κB.
Polyubiquitination par liaisons avec les différentes lysines
1. L’ubiquitination peut aussi se répéter sur les lysines (K) des ubiquitines déjà liées au substrat, créant des chaînes d’ubiquitine polymériques.
(Figure : vetopsy.fr d'après Ikeda)
a. Les résidus impliqués sont :
- K48 et K63, principalement,
- mais aussi sur K6, K11, K27, K29 ou K33, donnant naissance à des chaînes atypiques.
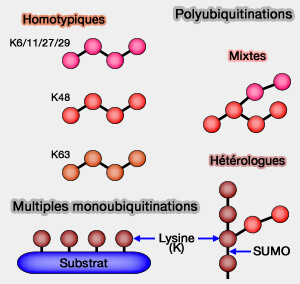
b. Ces chaînes peuvent être (Atypical ubiquitin chains : new molecular signals 2008) :
- des chaînes homotypiques, lorsqu’elles utilisent la même lysine à chaque liaison, comme les chaînes K48 ou K63 homogènes,
- hétérotypiques, combinant plusieurs lysines comme les . chaînes mixtes K48/K29 formant des structures ramifiées) ;
- hybrides, associant l’ubiquitine à d’autres BL-like comme SUMO.
2. De plus, plusieurs mono-ubiquitinations indépendantes sur un même substrat peuvent fonctionner comme une polyubiquitination équivalente, générant un signal fonctionnel similaire.
Conséquences structurales et fonctionnelles
La polyubiquitination confère à l'ubiquitine une plasticité structurale remarquable, conditionnant les fonctions de la chaîne selon sa topologie.
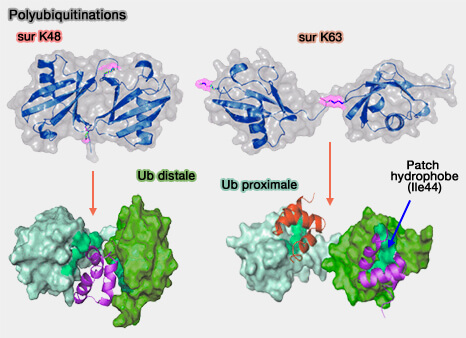
1. La polyubiquitination sur K48 aboutit à la dégradation du substrat.
- Les chaînes K48, compactes et hydrophobes, sont le signal canonique de dégradation par le protéasome 26S.
- Elles sont reconnues par des domaines UBA spécifiques, tels que ceux de HR23a (RAD23A) ou MUD1, qui s’insèrent entre deux ubiquitines empilées.
- D’autres domaines, comme PLIC-1, peuvent interagir de manière indépendante avec chaque ubiquitine.
2. Les chaînes K63, à structure linéaire et étendue, participent principalement à des fonctions non protéolytiques :
- signalisation intracellulaire, comme l’ubiquitination K63 de TRAF6, essentielle à l’activation de la voie NF-κB,
- réparation de l’ADN, comme la modification K63 de RAP80, nécessaire au recrutement du complexe BRCA1 sur les cassures double brin,
- trafic membranaire, comme l’ubiquitination K63 d'EGFR, qui régule son adressage endosomal ;
- réponse immunitaire, comme la polyubiquitination K63 de MAVS, indispensable à l’activation de TBK1 et à la production d’interférons antiviraux.
(Figure : vetopsy.fr d'après Ikeda)
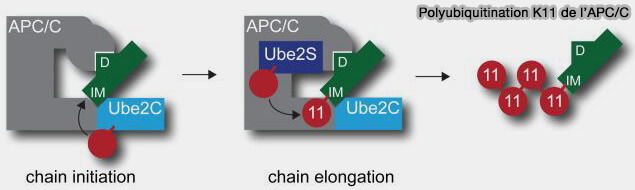
3. Les chaînes K11 sont formées par une liaison isopeptidique entre le carboxyle terminal (Gly76) d’une ubiquitine et le groupe ε-amine de la Lys11 d’une autre ubiquitine. (K11-linked ubiquitin chains as novel regulators of cell division 2010).
- Elles adoptent une conformation compacte et tordue, intermédiaire entre les chaînes K48 (fermées) et K63 (ouvertes).
- Les surfaces hydrophobes d’interaction (Ile44 patch) alternent entre exposition et masquage, modulant la reconnaissance par les récepteurs d’ubiquitine.
(Figure : vetopsy.fr d'après Wickliffe et coll)
a. Cette architecture donne aux chaînes K11 une plasticité conformationnelle et elles peuvent être dynamiquement reconfigurées selon les partenaires, i.e. E2, E3, DUB, protéasome 26S.
b. Elles sont spécifiques de la voie APC/C qui utilise Ube2C pour initier la mono-ubiquitination, puis Ube2S pour allonger des chaînes K11 homogènes sur ses substrats.
Les chaînes K11 formées par APC/C-Ube2S assurent la dégradation ordonnée des substrats mitotiques, i.e. sécurine, cycline B1, Plk1 et la sortie contrôlée de mitose.
4. Certains domaines UBD, tels que les domaines UIM, présents notamment dans Rpn10, se fixent indifféremment sur plusieurs types de chaînes.
Cette polyvalence leur permet d’intégrer différents signaux d’ubiquitination dans des réseaux complexes de régulation cellulaire.
Conséquences globales
L’aptitude de l’ubiquitine à s’auto-assembler en chaînes de topologie variable constitue la base de la diversité fonctionnelle de cette modification post-traductionnelle.
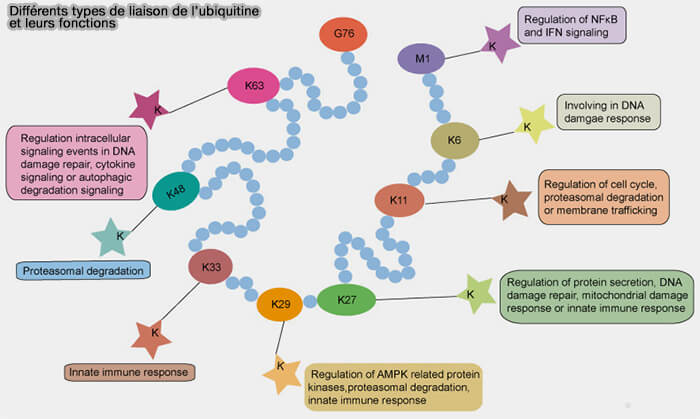
(Figure : vetopsy.fr d'après Yang et coll)
Selon la nature du lien et la longueur de la chaîne, l’ubiquitination peut :
- diriger la protéine vers le protéasome, comme p53 dégradée après polyubiquitination en K48 par la ligase MDM2,
- moduler ses interactions avec d’autres partenaires, comme RIP1 dont la chaîne K63 régule l’activation du complexe NF-κB,
- réguler sa localisation subcellulaire, comme EGFR monoubiquitylé pour son internalisation endosomale,
- activer des voies de signalisation intracellulaire, comme PCNA monoubiquitylé sur K164 pour la réparation de l’ADN.


