Modifications post-traductionnelles des protéines
Ubiquitination : mécanismes
Activation de l’ubiquitine par l’enzyme E1
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

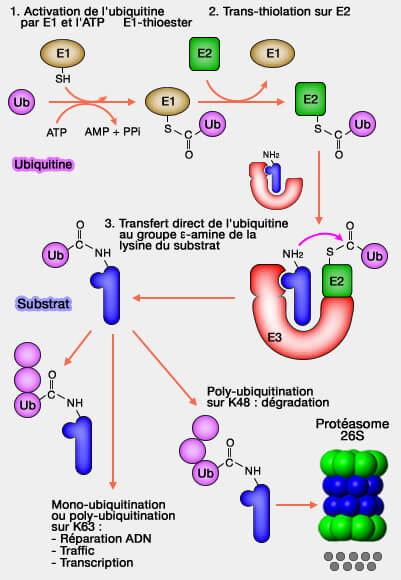
L’ubiquitination repose sur une cascade enzymatique à trois niveaux, E1, E2 et E3, dont la première étape, catalysée par l’enzyme E1, active l’ubiquitine par une réaction ATP-dépendante.
L’ubiquitine doit, pour se fixer sur la protéine cible, processus appelé ubiquitination ou ubiquitinylation, recourir à une succession coordonnée d’enzymes spécifiques agissant de manière séquentielle.
- L'enzyme d’activation (E1) active l’ubiquitine par une réaction ATP-dépendante pour former un intermédiaire thioester (E1~Ub).
- L'enzyme de conjugaison (E2) reçoit ensuite l’ubiquitine activée depuis E1 pour générer le complexe E2~Ub.
- L'enzyme ligase (E3) reçoit le complexe E2~Ub, reconnaît le substrat, oriente les partenaires et catalyse la formation de la liaison isopeptidique reliant l’ubiquitine à la protéine cible.
Ces trois étapes s’enchaînent de manière ordonnée pour aboutir à la formation d’un pont isopeptidique entre la glycine C-terminale (G76) de l’ubiquitine et une lysine du substrat, assurant ainsi la fixation covalente du signal ubiquitine.
E1 (ubiquitin-activating enzyme)
Principes généraux
L'enzyme d'activation E1 (E1 ubiquitin-activating enzyme), aussi appelée UBA1 ou UBE1, initie la cascade en activant l’ubiquitine de manière ATP-dépendante.
1. Elle se lie à l'ATP-Mg++ et à l'ubiquitine ce qui conduit successivement à (
(Figure : vetopsy.fr)
a. l'adénylylation (ou AMPylation) de l'extrémité C-terminale de l'ubiquitine,
b. puis, à la formation d’une liaison thioester à haute énergie entre l’ubiquitine et la cystéine de E1 (Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signalling pathways 2009).
2. On ne connait qu'une E1 chez la levure (Uba1) et 2 chez l'homme (UBA1 et UBA6).
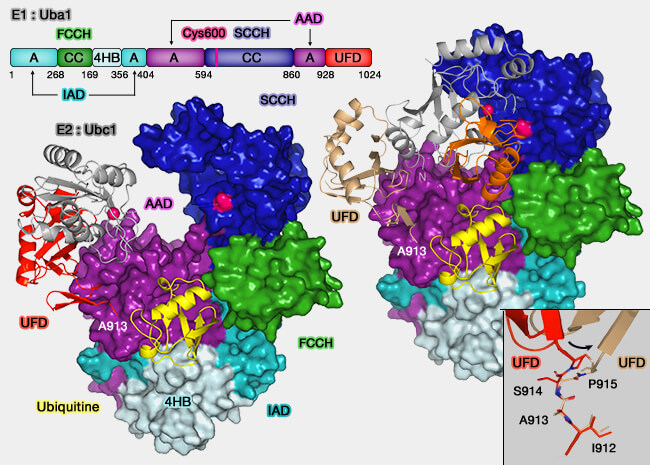
Structure de l'E1
Les E1 sont composées de 4 domaines fonctionnels (Two Mutations Impair the Stability and Function of Ubiquitin-Activating Enzyme (E1) 2012).
1. Les deux domaines d'adénylylation sont composés par 2 motifs homologues à celui des bactéries Moeb/Thif.
a. Ils forment le centre catalytique où l’ubiquitine et l’ATP-Mg++ sont alignés, permettant l’adénylylation du résidu Gly76 en position C-terminale de l’ubiquitine.
- L'AAD (Active Adenylation Domain) est catalytiquement compétent (logement pour l’ATP et del’Ub).
- L'IAD (Inactive Adenylation Domain) stabilise et orchestre la fermeture/ouverture du site.
b. Cette étape génère Ub-AMP et PPi et elle prépare l’attaque nucléophile de la cystéine catalytique portée par le module FCCH/SCCH.
2. Les deux demi-domaines catalytiques comprenant la cystéine du site actif (Crystal Structure of a Fragment of Mouse Ubiquitin-activating Enzyme 2005) :
a. FCCH (First and Second Catalytic Cysteine Half-domains) et SCCH (Second Catalytic Cysteine Half-domaines s’assemblent pour présenter la Cys catalytique à l'Ub-AMP.
L’attaque forme l’intermédiaire thioester E1~Ub (liaison à haute énergie).
b. Des réarrangements conformationnels, type swinging arm/crossover loop, rapprochent la Cys du centre d’adénylylation et reconfigurent la poche pour la suite du cycle, la trans-thiolation vers E2 (Structural basis for transthiolation intermediates in the ubiquitin pathway 2024).
3. Un faisceau de quatre hélices, qui suit immédiatement FCCH, rigidifie l’édifice et transmet les changements d’état (ouvert/fermé) entre les modules d’adénylylation et le site catalytique.
Ce couplage allostérique est crucial pour synchroniser l’adénylylation, la formation du thioester E1~Ub, puis la remise de l’ubiquitine à E2.
4. Un domaine UFD (Ubiquitin Fold Domain) d'une centaine de résidus, i.e. 950-1058 chez UbE1, a deux rôles (Basis for a ubiquitin-like protein thioester switch toggling E1-E2 affinity 2007) :
a. Il participe au thioester switch qui module l’affinité E1-E2 selon l’état du site thioester, i.e. chargé versus transféré.
b. Il forme l’interface de recrutement d’E2 (
- Les E3 reconnaissent à leur tour les E2 via ce domaine UBC, domaine de conjugaison à l’ubiquitine contenant la cystéine catalytique.
- Les extensions N- et C-terminales des E2 contribuent à leur spécialisation et à la sélectivité de l’interaction avec E1, qui dépend de la chimie du site catalytique et de la conformation des domaines UFD et FCCH (Determinants of chemoselectivity in ubiquitination by the J2 family of ubiquitin-conjugating enzymes 2024).
Remarque : le domaine UFD est souvent impliqué dans la liaison avec les domaines UBL (A Ubiquitin Shuttle DC-UbP/UBTD2 Reconciles Protein Ubiquitination and Deubiquitination via Linking UbE1 and USP5 Enzymes 2014).

L’ensemble de ces interactions structurales entre le domaine UFD d’E1, le domaine UBC d’E2 et les extensions terminales qui déterminent leur compatibilité chimique, illustre la précision de l’architecture enzymatique nécessaire au transfert de l’ubiquitine..
(Figure : vetopsy.fr d'après Lee sous Open Archive)
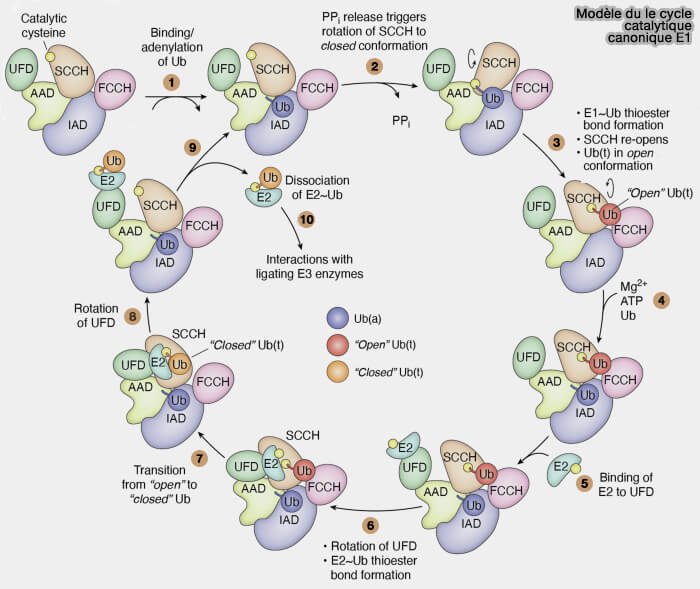
Poches de liaison à l’ubiquitine et états conformationnels.
Les enzymes E1 présentent une organisation modulaire hautement dynamique, permettant la succession coordonnée des étapes d’adénylylation, de formation du thioester et de transfert vers l’enzyme E2.

Vous pouvez lire : Molecular choreography of E1 enzymes in ubiquitin-like protein cascades: New insights into dynamics and specificity (2025) et Structural basis for transthiolation intermediates in the ubiquitin pathway (2024).
1. L’ubiquitine s’ancre successivement dans plusieurs poches distinctes au sein d’E1 :
- une première, d’affinité élevée, qui oriente son extrémité C-terminale lors de l’adénylylation,
- une seconde, transitoire, qui positionne la Gly76 pour la formation de la liaison thioester. C
Ces repositionnements successifs garantissent un transfert précis de l’ubiquitine activée sans relargage prématuré.
2. Le basculement entre les états " ouvert " et " fermé " d’E1 conditionne la catalyse.
- Dans l’état ouvert, les domaines catalytiques sont espacés, favorisant la capture de l’ubiquitine et de l’ATP.
- Le passage à l’état fermé rapproche les domaines FCCH et SCCH, positionnant la cystéine catalytique pour la formation du thioester.
Ces mouvements sont stabilisés par des interactions inter-domaines et par des réarrangements du faisceau hélicoïdal central.
3. Au cours du cycle, l’E1 adopte des états ouvert/fermé corrélés à :
- l’entrée/positionnement de l’Ub et de l’ATP dans le site d’adénylylation (IAD/AAD),
- la migration de la queue C-terminale de l’Ub pour l’attaque de la Cys (FCCH/SCCH),
- la présentation de l’Ub activée à E2 au niveau de l’UFD.
4. Cette alternance structurale, en orchestrant le séquencement précis des étapes catalytiques, assure la spécificité et l’efficacité du transfert de l’ubiquitine dans le système ubiquitine-protéasome.
(Figure : vetopsy.fr d'après Straton et coll)


