Complexe APC/C
Structure : module central et module TPR
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le complexe APC/C (Anaphase-Promoting Complex/Cyclosome), E3 ubiquitine ligase de type RING apparentée aux ligases CRL-like, contrôle la transition mitotique et repose sur une architecture modulaire organisée autour d’un module central rigide et d’une arche TPR latérale flexible.
Le complexe APC/C ou complexe de promotion de l'anaphase garantit la progression ordonnée de la mitose et la ségrégation correcte des chromosomes par la dégradation séquentielle :
- des cyclines A et B,
- des sécurines, garantissant la progression ordonnée de la mitose et la ségrégation correcte des chromosomes.
Organisation modulaire et composants du complexe APC/C
Le complexe APC/C présente une architecture modulaire composée de 14 sous-unités distinctes chez les métazoaires (13 chez la levure) permettant la reconnaissance fine de ses substrats et leur ubiquitination dépendante du protéasome 26S (
Dans certains articles, vous trouverez un nombre de 19 sous-unités car 4 d'entre elles, i.e. APC3, APC6, APC7 et APC8 sont présentes sous forme de dimères et il existe une petite sous-unité CDC26 (Intricate Regulatory Mechanisms of the Anaphase-Promoting Complex/Cyclosome and Its Role in Chromatin Regulation 2019).
Les sous-unités APC/C sont organisées fonctionnellement et structurellement en quatre modules :
- le module central (APC1, 4, 5 et 15),
- le module TPR (APC3, 6, 7, 8 et APC12, 13, 16 et CDC26),
- le module de reconnaissance (APC10 et coactivateurs),
- le module catalytique (APC2, 11).
Dans certains articles, le classement des modules peut différer.
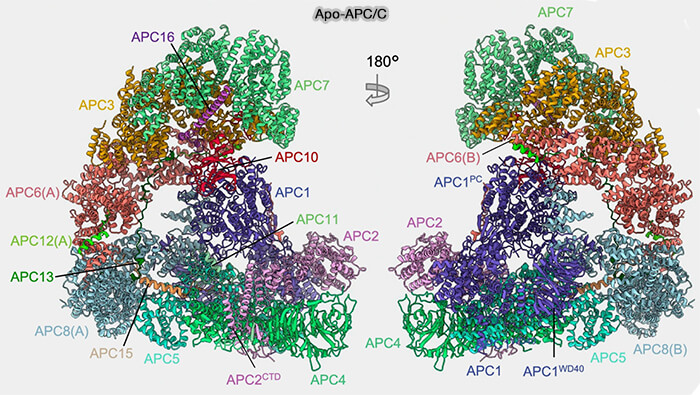
(Figure : vetopsy.fr d'après Höfler et Coll)

Vous pouvez lire : Cryo-EM structures of apo-APC/C and APC/CCDH1:EMI1complexes provide insights into APC/C regulation (2024) et Atomic structure of the APC/C and its mechanism of protein ubiquitination (2015)
Module central (APC1, 4, 5 et 15)
Le module central forme la charpente architecturale de l’APC/C.
- Composé d’APC1, APC4, APC5 et APC15, il stabilise la structure tridimensionnelle du complexe et coordonne l’assemblage spatial des autres modules fonctionnels.
- Il relie la base du bras TPR au cœur catalytique.
APC4 et APC5
APC4 et APC5 forment un hétérodimère stable qui agit comme charnière entre les modules TPR et catalytique (Atomic-Resolution Structures of the APC/C Subunits APC4 and the APC5 N-Terminal Domain 2015).

(Figure : vetopsy.fr d'après Cronin et coll)
1. APC4 présente une architecture mixte, avec un domaine WD40 interrompu par un long domaine α-hélicoïdal, conférant une flexibilité torsionnelle importante.
2. APC5, dont la région N-terminale adopte un pli α-hélicoïdal, s’enroule partiellement autour d’APC4 pour stabiliser la jonction et relier mécaniquement la plateforme TPR à APC2, la sous-unité cullin-like du bras catalytique.
3. Cette charnière APC4-APC5 établit un contact direct avec APC2, prolongeant l’architecture du complexe vers le module catalytique et assurant la transmission mécanique des mouvements de la plateforme TPR jusqu’au bras APC2-APC11 (
APC1
1. APC1, la plus grande sous-unité APC/C, fournit un point d’ancrage aux autres sous-unités APC.
Son orientation contrôle la position et la flexibilité du module catalytique d’APC2 et APC11 et est essentielle pour la régulation de l’activité d’ubiquitination de l’APC/C.
a. À son extrémité C-terminale, APC1 possède onze répétitions Protéasome-Cyclosome (PC), qui interagissent avec :
- le module TPR,
- APC10.
Remarque : le motif PC ne se retrouve ailleurs que dans les sous-unités Rpn1 et Rpn2 de la sous-unité régulatrice 19S du protéasome.
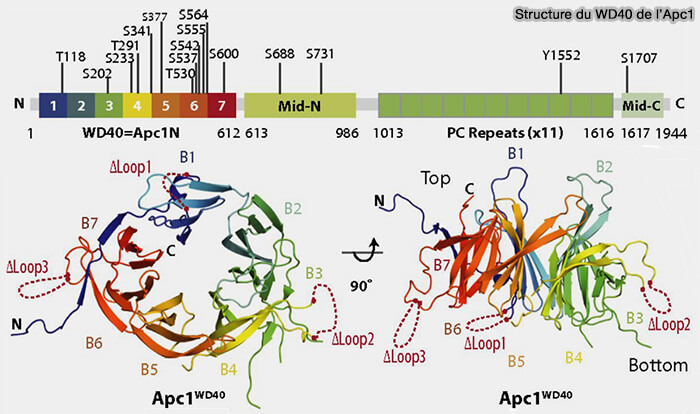
(Figure : vetopsy.fr d'après Li et coll)
b. À son extrémité N-terminale, son domaine WD40 est nécessaire pour promouvoir l’affinité de liaison de Ube2C/UBCH10 (WD40 domain of Apc1 is critical for the coactivator-induced allosteric transition that stimulates APC/C catalytic activity 2016).
APC1 interagit également avec le domaine N-terminal du coactivateur Cdh1.
2. APC1, de manière dépendante de la phosphorylation, régule également l’engagement de Cdc20 dans le complexe (
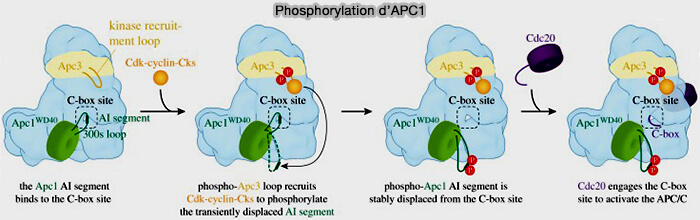
(Figure : vetopsy.fr d'après Alfieri et coll)
APC15
1. APC15 est une petite sous-unité périphérique située sur la face interne du bras TPR du complexe APC/C.
- Elle se lie principalement à APC8 et APC5, à proximité du site d’ancrage du coactivateur Cdc20.
- Cette position stratégique lui permet d’influencer les interactions entre le coactivateur Cdc20, le module catalytique (APC2-APC11) et le MCC (Mitotic Checkpoint Complex).
2. APC15 n’est pas nécessaire pour l’assemblage APC/C, mais est une sous-unité régulatrice essentielle du complexe APC/C, indispensable à la désactivation du point de contrôle du fuseau.
a. Elle favorise l’autoubiquitination de la sous-unité Cdc20M inhibitrice au sein du MCC (Mitotic Checkpoint Complex), entraînant sa dissociation et la réactivation du complexe complexe APC/CCdc20A (
Elle favorise la rotation du module APC2-APC11 vers la configuration CRL-up, rapprochant le RING du site E2~Ub, ce qui permet l’autoubiquitination de Cdc20M, celui du MCC, entraînant sa dissociation et la réactivation du complexe APC/CCdc20A.
b. Son absence provoque une accumulation d’APC/C-MCC stables, un retard de l’anaphase, et une dérégulation des cycles ubiquitination/désubiquitination de Cdc20.

Le module central assure la cohésion mécanique de l’ensemble et la transmission allostérique entre la reconnaissance du substrat et la catalyse d’ubiquitination.
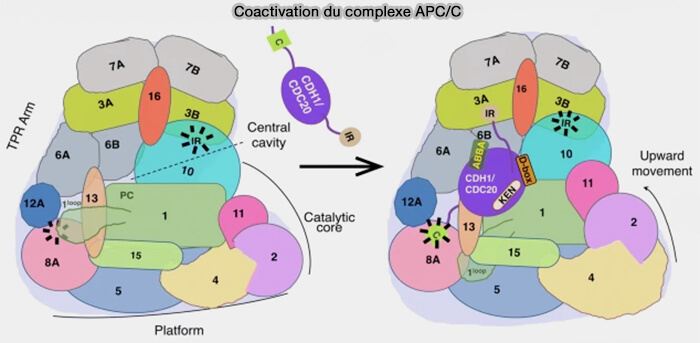
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Module TPR
Sous-unités principales (APC3, 6, 7 et 8)
Structure
Le module TPR (Tetratricopeptide Repeat) constitue la grande arche latérale du complexe APC/C.
Formé par les sous-unités APC3, APC6, APC7 et APC8, il sert de plateforme d’ancrage pour les coactivateurs, les sous-unités adaptatrices et le module catalytique, assurant la cohésion de l’ensemble.
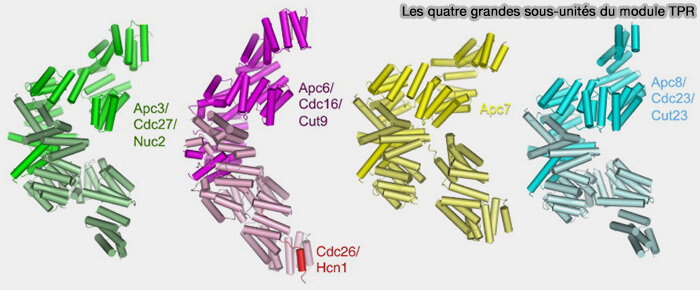
(Figure : vetopsy.fr d'après Zhang et coll)
APC3, APC6, APC7, APC8, hautement homologues, composées presque entièrement de 14 à 16 répétitions tétratricopeptide (TPR : tetratricopeptide repeat), s’associent chacune pour former des homodimères (The Four Canonical TPR Subunits of Human APC/C Form Related Homo-Dimeric Structures and Stack in Parallel to Form a TPR Suprahelix 2013).
- Elles sont empilées en parallèle.
- La présence des TPR dans plusieurs complexes protéiques de fonctions diverses telles que l’APC/C indique un rôle dans la médiation des interactions protéine-protéine et l’assemblage de complexes multiprotéiques.
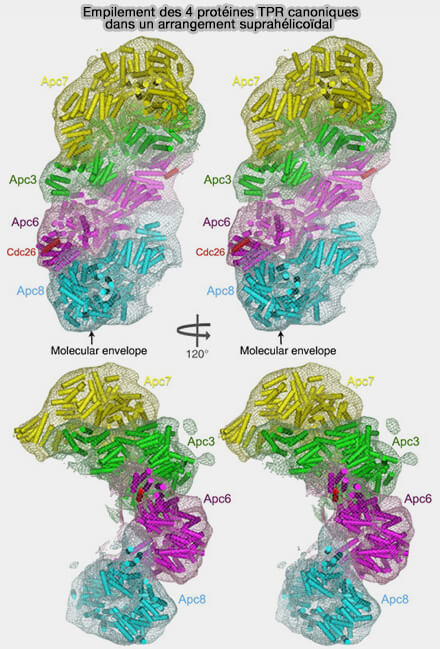
(Figure : vetopsy.fr d'après Zhang et coll)
1. Les extrémités N-terminales de ces sous-unités, grâce aux motifs TPR qui s’enroulent, forment une superhélice tandis que leurs extrémités C-terminales se déploient vers les courbures convexes et concaves du complexe.
Cette super-hélice allongée, de 700 Å de long, sert de plateforme de fixation pour d’autres sous-unités.
2. La plupart des sous-unités adaptatrices TPR du complexe (comme APC3, APC6, APC7) interagissent entre elles et avec leurs partenaires via des queues C-terminales contenant un motif IR comme celui des coactivateurs.
Ces motifs s’insèrent dans des poches hydrophobes situées à l’extrémité des domaines TPR, assurant la cohésion de la plateforme et l’ancrage de sous-unités périphériques, notamment les coactivateurs.
Rôles des sous-unités
Les sous-unités TPR ont des rôles distincts.
1. APC7 se situe à l’extrémité externe de la plateforme.
Elle initie l’arc TPR et interagit avec APC3, assurant la stabilisation de l’assemblage latéral.
2. APC3 forme la portion médiane et la plus exposée de l’arche et c'est sur ses poches IR qu’interagissent les queues IR pour stabiliser le module de reconnaissance du substrat.
- la queue IR du coactivateur (Cdc20 ou Cdh1) sur APC3A,
- la queue IR d’APC10 sur APC3B.
Ces interactions bilatérales sont activées par phosphorylation (
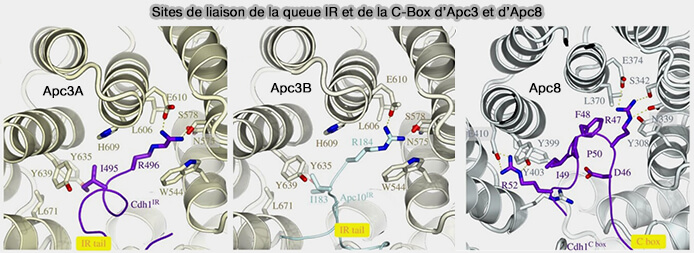
(Figure : vetopsy.fr d'après Alfieri et coll)
3. APC6 occupe la base interne de la plateforme.
Elle relie APC3 à APC8 et contribue à la courbure de la super-hélice, conférant une flexibilité structurale à l’ensemble.
4. APC8 s’insère à la jonction entre la plateforme TPR et le module catalytique.
- Elle interagit avec APC5 et Cdc26, formant un pont structurel entre le cœur du complexe et l’arche TPR.
- Elle stabilise aussi l’ancrage du coactivateur via son motif C-box, l'autre partie du coactivateur étant ancrée sur APC3A par une queue IR.
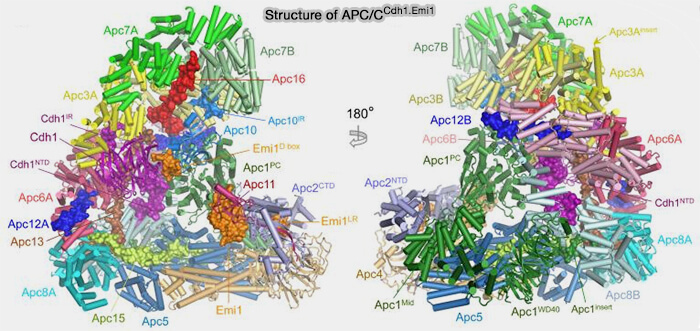
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Sous-unités secondaires (APC12, 13 , 16 et CDC26
Cet arc latéral formé des quatre grandes sous-unités sert de plateforme de fixation pour d’autres sous-unités et coactivateurs, jouant un rôle central dans la stabilité et la régulation du complexe.
1. APC12 et APC13 stabilisent les interfaces TPR-TPR par des interactions hydrophobes.
2. APC16 se fixe sur APC6 et APC8 et stabilise l’association entre le module TPR et le module catalytique (APC2-APC11).
3. CDC26 (Cell Division Cycle 26) est une petite protéine intégrée de manière stable au sein du module de base de l’APC/C, en interaction avec APC3, APC6 et APC8.
- Elle stabilise le cœur de l’anneau TPR (tetratricopeptide repeat), qui forme l’ossature du complexe.
- Son rôle est essentiellement structural et de repliement : elle aide à l’assemblage correct du module TPR et à la stabilité de l’ensemble APC/C.
Module de reconnaissance (APC10) et catalytique (APC2/11)
L’architecture interne du complexe se complète par les modules de reconnaissance et catalytique, qui assurent la fonction enzymatique proprement dite du complexe APC.


