Complexe APC/C
Régulation intrinsèque
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La régulation intrinsèque de l’APC/C repose sur ses mécanismes internes d’autoubiquitination et de rétrocontrôle, assurant la désactivation séquentielle des coactivateurs et la réinitialisation du complexe après mitose.
Vue d'ensemble de la régulation intrinsèque
La régulation intrinsèque de l’APC/C correspond à l’ensemble des processus internes qui ajustent son activité une fois les signaux mitotiques extrinsèques levés.
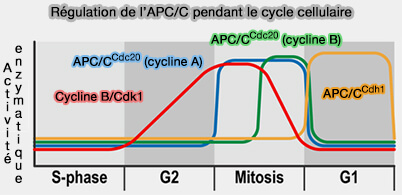
(Figure : vetopsy.fr d'après Zhang et coll)
1. Cette étape ne dépend plus des kinétochores ou des phosphorylations cycliques, mais de mécanismes internes destinés à :
- interrompre son activité catalytique lorsque la ségrégation chromosomique est achevée,
- éliminer les coactivateurs devenus inutiles et assurer leur désactivation séquentielle,
- rétablir un état inactif stable en fin de mitose, garantissant la stabilisation du complexe et sa préparation pour un nouveau cycle cellulaire.

Ces processus constituent le bouclage interne du cycle du complexe APC/C.
2. Cette régulation complète la régulation extrinsèque, contrôle exercé par des signaux externes au complexe, assurant son activation ou son inhibition en fonction de l’état mitotique qui inclut :
- la phosphorylation des sous-unités de l’APC/C et l’inhibition par EMI1,
- le point de contrôle du fuseau mitotique (SAC),
- d’autres signaux mitotiques modulant l’activité du complexe.
Autoubiquitination et régulation du complexe APC/C
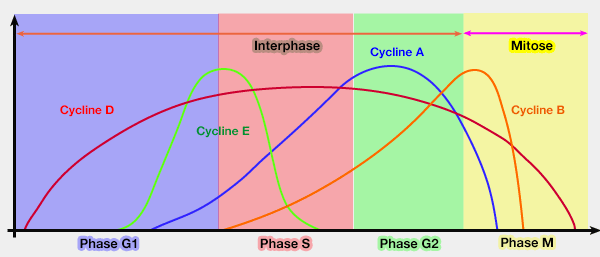
(Figure : vetopsy.fr)
APC/CCdc20
Vue d'ensemble
1. Le complexe APC/CCdc20 a pour fonction principale d’ubiquitiner la sécurine et les cyclines B, entraînant leur dégradation par le protéasome 26S.
- La dégradation de la sécurine active la séparase, provoquant la séparation des chromatides sœurs.
- La dégradation des cyclines B abolit l’activité cycline B/CDK1, condition essentielle à la sortie de mitose et à la réinitialisation du cycle cellulaire.
Ainsi, APC/CCdc20 orchestre la transition anaphase-télophase en coordonnant la dissolution de la cohésion chromosomique et la désactivation du moteur mitotique.
2. L’APC/C possède la capacité de polyubiquitiner son propre coactivateur Cdc20, mécanisme d’autorégulation permettant de limiter la durée de son activité assurant la terminaison de l’activité APC/CCdc20 en fin d’anaphase.
Ce processus participe à la transition vers APC/CCdh1 en libérant la place pour le second coactivateur.
3. Cdc20 existe dans deux états distincts, qui peuvent coexister pendant un bref intervalle de la transition prométaphase/métaphase (Intricate Regulatory Mechanisms of the Anaphase-Promoting Complex/Cyclosome and Its Role in Chromatin Regulation 2021 et Cryo-EM of Mitotic Checkpoint Complex-Bound APC/C Reveals Reciprocal and Conformational Regulation of Ubiquitin Ligation 2016).
- Cdc20 lié au MCC (Cdc20M), incorporé au sein du MCC (MAD2-BUBR1-BUB3-Cdc20), inhibe l’activité de l’APC/C tant que le point de contrôle du fuseau (SAC) est actif.
- Cdc20 libre ou activé (Cdc20A) est lié à la plateforme TPR de l’APC/C, qui assure la reconnaissance et l’ubiquitination des substrats mitotiques une fois le checkpoint levé.
Leur devenir successif illustre la logique d’autorégulation du complexe : une fois libéré du MCC, Cdc20 s’associe seul à l’APC/C pour former le complexe catalytique actif APC/CCdc20.
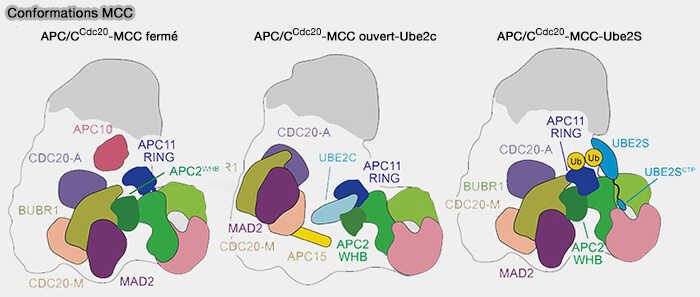
(Figure : vetopsy.fr d'après Bodrug et coll)
Remarque essentielle : les représentations schématiques du complexe APC/C dans la littérature, notamment dans les deux articles précédents, peuvent prêter à confusion, car elles condensent dans une même image plusieurs états transitoires du complexe observés par cryo-EM.
- Ces figures ne montrent pas des conformations stables coexistantes, mais une succession d’étapes dynamiques d'inhibition, de désassemblage du MCC, puis d'activation catalytique.
- Ainsi, la présence simultanée de Cdc20M et Cdc20A, ou de composants du MCC (Mad2, BubR1) encore associés à l’APC/C, ne traduit pas une double occupation réelle des sites, mais une superposition moyenne de sous-populations moléculaires.
- Ces états sont brièvement coexistants lors de la levée du checkpoint, rendant les schémas parfois difficiles à interpréter si l’on ne garde pas à l’esprit leur nature instantanée et transitoire.
Évolution de l'APC/CCdc20
Cdc20M
Tant que le SAC est actif, le MCC se fixe à l’APC/C et bloque son activité catalytique.
Pour dissocier ce complexe inhibiteur, l’APC/C utilise une réaction d’autoubiquitination dirigée contre le Cdc20M contenu dans le MCC (Visualizing the complex functions and mechanisms of the anaphase promoting complex/cyclosome (APC/C) 2017).
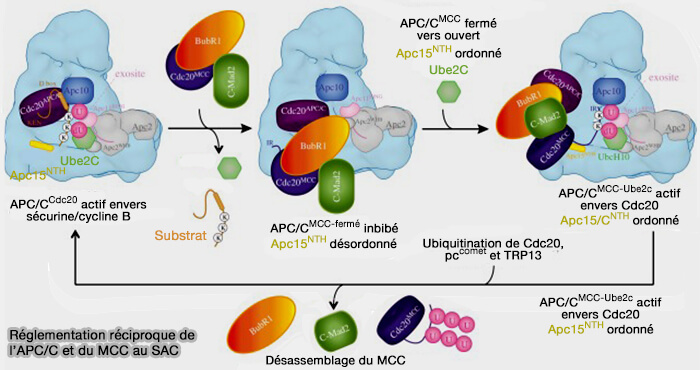
(Figure : vetopsy.fr d'après Alfieri et coll)
1. La petite sous-unité APC15 joue un rôle déclencheur essentiel en favorisant la réorientation du module catalytique APC2-APC11 vers Cdc20M pour sa polyubiquitination (APC15 mediates CDC20 auto-ubiquitylation by APC/CMCC and MCC disassembly 2012).
a. Elle favorise la dissociation de Mad2 et de BubR1 du complexe APC/C, en modifiant localement la position d’APC8 et d’APC5 vers la configuration CRL-up, approchant le domaine RING du site E2~Ub.
- Cette action permet à Cdc20 de devenir substrat du complexe, i.e. autoubiquitination, ce qui libère définitivement le site catalytique et met fin à l’inhibition du MCC.
- APC15 contribue aussi à la discrimination entre les Cdc20 liés à des substrats valides, i.e. Cdc20A, et ceux intégrés au MCC, i.e. Cdc20M.
b. Elle empêche la libération prématurée d’APC/C avant la satisfaction complète du checkpoint (Control of APC/C-dependent ubiquitin chain elongation by reversible phosphorylation 2016)
Son absence provoque une accumulation d’APC/C-MCC stables, un retard de l’anaphase, et une dérégulation des cycles ubiquitination/désubiquitination de Cdc20.
2. Cette autoubiquitination est catalysée par le module APC2-APC11 en coopération avec les E2 Ube2C et Ube2S, favorisant la formation de chaînes polyubiquitine Lys11 (UBE2S drives elongation of K11-linked ubiquitin chains by the Anaphase-Promoting Complex 2011).
- Les ubiquitines ajoutées masquent les surfaces du domaine WD40 de Cdc20 impliquées dans la liaison à la plateforme TPR (APC3, APC6, APC8).
- Cette surcharge stérique perturbe les interactions de Cdc20 avec Mad2 et BubR1.
- BurR1, Bub3 et Mad2 se détachent secondairement, à la suite de la perte d’interactions structurales provoquée par la modification de Cdc20, provoquant une désorganisation progressive du MCC.
3. L’intervention de p31comet et de TRIP13 (AAA+-ATPase) complète le processus en dissociant activement le MCC, libérant Cdc20-Ub dans le cytosol.
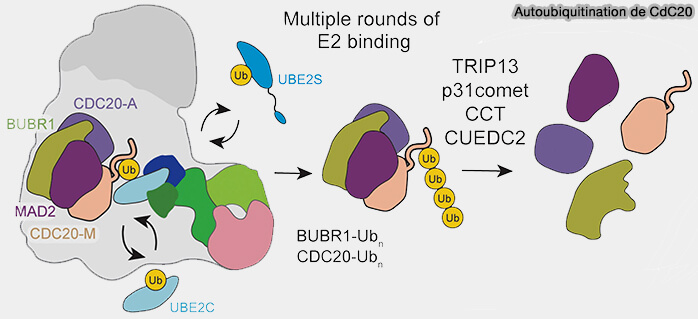
(Figure : vetopsy.fr d'après Bodrug et coll)
d. Cdc20M, désormais ubiquitiné, est dégradé par le protéasome 26S (The APC/C maintains the spindle assembly checkpoint by targeting Cdc20 for destruction 2008).
Cette élimination constitue la fin du checkpoint et permet la réactivation du complexe.
Cdc20A
1. La disparition de Cdc20M libère les sites d’interaction de la plateforme TPR.
a. Un nouveau Cdc20, appelé Cdc20A, s’y associe alors pour former le complexe catalytique actif.
Cdc20A reconnaît les substrats mitotiques via leurs motifs D-box et KEN-box, et recrute les E2 Ube2C (initiation) et Ube2S (élongation Lys11) pour la dégradation de la sécurine et des cyclines B par le protéasome 26S.
b. À cette étape, l’APC/CCdc20A est pleinement actif et conduit la transition anaphase-télophase.
2. Lorsque la dégradation de la sécurine et des cyclines B est accomplie, Cdc20A reste transitoirement associé au complexe.
L’APC/C conserve alors une activité résiduelle qui permet son autoubiquitination tardive.
- Le module catalytique APC2-APC11, encore actif, marque Cdc20A par des chaînes Lys11.
- Cette modification déclenche la dissociation de Cdc20A et sa dégradation par le protéasome.
Cette étape met fin à l’activité d’APC/CCdc20 et prépare le relais vers l'APC/CCdh1, actif en phase G1 (

L’autoubiquitination de Cdc20 marque la clôture fonctionnelle de l'anaphase.
APC/CCdh1
Une fois la mitose achevée, Cdh1 devient le principal coactivateur en phase G1.
L’APC/CCdh1 maintient une activité ubiquitine-ligase transitoire destinée à éliminer les substrats mitotiques résiduels, tels que la cycline B, la geminine ou Skp2, assurant la stabilisation de l’état post-mitotique et la prévention d’une réactivation prématurée des CDK.
La régulation intrinsèque du complexe s’étend ainsi à la phase suivante, contrôlant également la désactivation progressive de Cdh1.
1. À mesure que la phase S approche, la cycline E/CDK2 et SCFβ-TrCP favorisent la phosphorylation et la dégradation de Cdh1, entraînant l’inactivation progressive d’APC/CCdh1.

La dégradation par le complexe SCFβ-TrCP est étudiée dans un chapitre spécifique.
2. Ce rétrocontrôle croisé entre APC/C et SCF assure la succession ordonnée des systèmes ubiquitine-ligases au cours du cycle cellulaire :
- APC/CCdc20 gouverne la sortie de mitose,
- APC/CCdh1 prend le relais en G1,
- puis SCF devient prédominant à l’entrée en phase S.
La réinitialisation du complexe dépend :
- de la chute de l’activité CDK1/cycline B,
- de la déphosphorylation progressive des sous-unités de l’APC/C, qui repose principalement sur PP2A-B55 et PP1,
- de la disponibilité de Cdh1, dont l’activation nécessite l’absence de phosphorylations inhibitrices.
Remarque : chez la levure, ce processus implique Cdc14, i.e. phosphatase du MEN/FEAR et l’inhibiteur pseudosubstrat Acm1, qui empêchent l’activation prématurée d’APC/CCdh1.
Conclusion
La régulation intrinsèque de l’APC/C repose sur une boucle d’autorégulation complète :
- activation contrôlée (phosphorylation mitotique),
- autoubiquitination limitante (dégradation de Cdc20),
- transition vers Cdh1,
- désactivation cyclique et relais SCF.
Ce système garantit une séquence temporelle précise d’activation et d’inactivation du complexe, assurant la fidélité de la mitose et la préparation ordonnée du cycle suivant.

Par la combinaison de ses régulations extrinsèques et intrinsèques, le complexe APC/C assure la coordination temporelle de la mitose et la remise à zéro du cycle cellulaire..
Rôle physiologique et implications pathologiques
1. L’APC/C assure la fidélité chromosomique et la stabilité du cycle cellulaire.
Sa dérégulation conduit à :
- une instabilité génomique par dégradation anormale des régulateurs du cycle,
- une aneuploïdie liée à un défaut du SAC,
- des phénotypes tumoraux, notamment par mutation de Cdc20, Cdh1, ou altération de la régulation des substrats.
2. L’APC/C est ainsi une cible thérapeutique potentielle dans les cancers caractérisés par une hyperprolifération mitotique, i.e. inhibiteurs de Cdc20 ou de l’interaction APC11-E2 en développement expérimental.


