Complexe APC/C
Régulation extrinsèque
2. Point de contrôle du fuseau mitotique (SAC)
2.2. Métaphase et anaphase : levée et extinction du SAC
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La levée du SAC réactive l’APC/CCdc20, entraînant la dégradation de la sécurine et de la cycline B et la séparation définitive des chromatides sœurs.
Métaphase : maintien et levée du checkpoint
Inactivation de MPS1
1. Pendant la métaphase, certains kinétochores sont déjà attachés, d’autres encore libres ou sous tension insuffisante et le maintien du checkpoint repose sur un cycle continu d’activation et de désactivation locale.
a. Le SAC reste partiellement actif, car un seul kinétochore non attaché suffit à maintenir le blocage de l’APC/CCdc20.
- MPS1 et Aurora B demeurent actives sur les kinétochores périphériques, réactivant le signal tant que la tension n’est pas homogène.
- Le flux cytosolique du complexe C-Mad2-Cdc20 et de MCC continue d’être produit, assurant une inhibition complète de l’APC/C.
b. Ce renouvellement constant du MCC garantit que la transition en anaphase ne puisse se produire qu’après attachement bipolaire de tous les chromosomes.
- Tant que le kinétochore n’est pas attaché ou mal orienté, le complexe NDC80 présente son domaine CH (calponin-homology) libre.
- Ce domaine continue à recruter et à maintenir les phosphorylations de MPS1 sur les motifs pMELT de KNL1, Bub1 et BubR1, ainsi que Mad1, favorisant le maintien du complexe Mad1-C-Mad2.
c. L’activité de MPS1 est donc maximale en absence de tension, soutenue par Aurora B.
2. À mesure que les microtubules capturent les kinétochores et que les chromosomes s’alignent sur la plaque équatoriale, les deux kinétochores de chaque paire de chromatides sœurs sont sous tension égale et s’attachent correctement à des microtubules issus de pôles opposés (
a. La traction exercée par le fuseau mitotique génère une tension qui induit un glissement moléculaire au sein du complexe KMN (KNL1–MIS12–NDC80).
- Ce glissement éloigne le domaine CH de NDC80 du site de liaison de MPS1.
- Comme les microtubules se fixent sur ce même domaine CH de NDC80, cette interaction empêche MPS1 de s’y attacher.
b. MPS1 se détache du kinétochore.
- Elle n’a plus accès à ses substrats, i.e. KNL1, Bub1, ni au réseau d’activation, i.e. Aurora B.
- L’enzyme devient alors instable et inactive, car son autophosphorylation n’est plus entretenue et son activité chute.
c. La tension n’inactive donc pas directement MPS1, mais l’exclut mécaniquement du kinétochore en modifiant la géométrie du complexe d’ancrage.
Hors du kinétochore, MPS1 s’autodéphosphoryle lentement, un processus spontané qui restaure la conformation fermée et inerte de la kinase.
d. Ce mécanisme garantit que l’activité de MPS1 reste confinée aux kinétochores non attachés et s’éteint dès l’établissement d’une tension bipolaire stable.
(Figure : vetopsy.fr d'après Yamaguchi et coll)
Rôles des phosphatases
1. Une fois MPS1 détachée, les phosphatases entrent en jeu (Spatial separation of phosphatase and kinase activity within the Bub complex is required for proper mitosis 2022).
a. PP1 et PP2A-B56 deviennent dominantes.
- PP1 est recrutée sur KNL1 (motif RVSF/SILK) et déphosphoryle les motifs MELT, provoquant la dissociation de Bub1:Bub3 et BubR1:Bub3.
- PP2A-B56, associée à Bub3 via son domaine KARD, complète la déphosphorylation du réseau BUB.

Ces actions suppriment les sites d’ancrage de Mad1-C-Mad2 et éteignent le signal du SAC.
b. La déphosphorylation de la plateforme KNL1-BUB entraîne la disparition locale du signal de recrutement du complexe Mad1-C-Mad2.
2. La suppression des sites phospho-dépendants de Bub1 abolit le point d’ancrage de Mad1 sur le kinétochore.
a. À ce stade, Mad1 perd sa localisation kinétochorienne, mais le complexe Mad1-C-Mad2 reste intact et est simplement relocalisé dans le cytosol, détaché de la structure du kinétochore.
Une fois hors du kinétochore, le complexe Mad1-C-Mad2 n’est plus stabilisé par MPS1 ni par les tensions locales.
b. Le C-Mad2 se désolidarise spontanément du coiled-coil de Mad1, dont la structure repliée n’offre plus de surface favorable.
3. Le C-Mad2 libre diffuse alors dans le cytosol, toujours sous sa conformation fermée.
Le SAC cesse d’être alimenté, mais les MCC déjà formés dans le cytosol sont encore présents et continuent à inhiber l’APC/C.
Rôles de p31comet et de TRIP13
Une fois la source de Mad1-C-Mad2 épuisée, il faut éliminer les MCC résiduels.
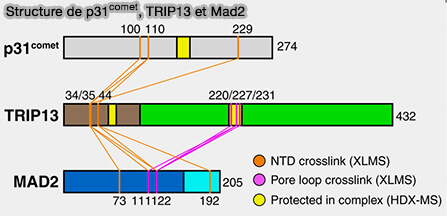
(Figure : vetopsy.fr d'après Rosenberg et Corbett)
1. p31comet est une petite protéine, d'environ 280 résidus, structurellement homologue à Mad2, mais non convertible, i.e. elle reste toujours fermée, i.e. C.
a. Elle reconnaît spécifiquement la conformation fermée C-Mad2, que celle-ci soit :
- liée à Mad1 (dans le complexe Mad1-C-Mad2),
- associée à Cdc20 (dans le MCC).
b. L’interaction a lieu via la même surface β-sandwich utilisée par Mad2 pour ses homodimérisations O-C.
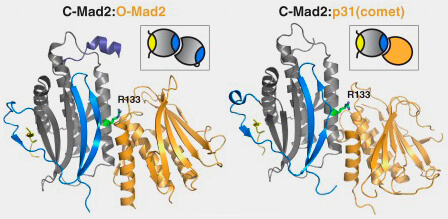
(Figure : vetopsy.fr d'après Rosenberg et Corbett)
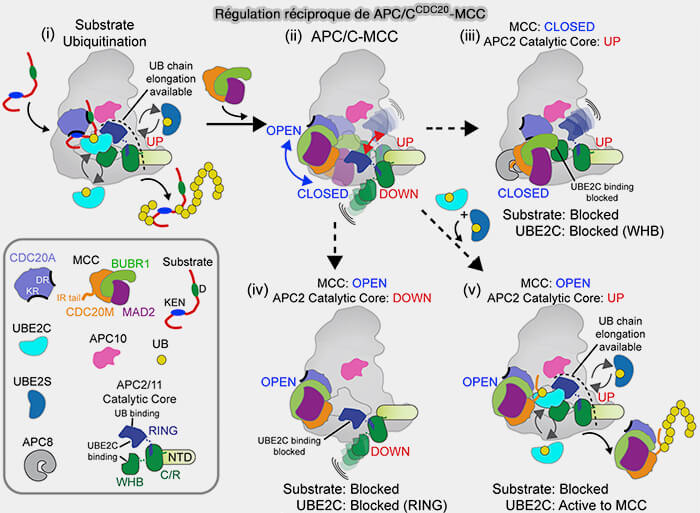
2. p31comet se fixe donc à la place d’un O-Mad2, mimant la dimérisation O-C, mais sans permettre la conversion inverse.
Ce contact crée un dimère hétérotypique p31-C-Mad2 extrêmement stable, qui :
- empêche toute association de C-Mad2 avec Mad1 ou Cdc20 supplémentaires,
- bloque la conversion allostérique des autres O-Mad2,
- marque la C-Mad2 pour sa reconversion en forme ouverte (O-Mad2) par TRIP13.
c. Elle se fixe sur la surface externe de C-Mad2, sans perturber immédiatement le contact avec Cdc20.
Cette reconnaissance ne détache pas Mad1-C-Mad2 du kinétochore.
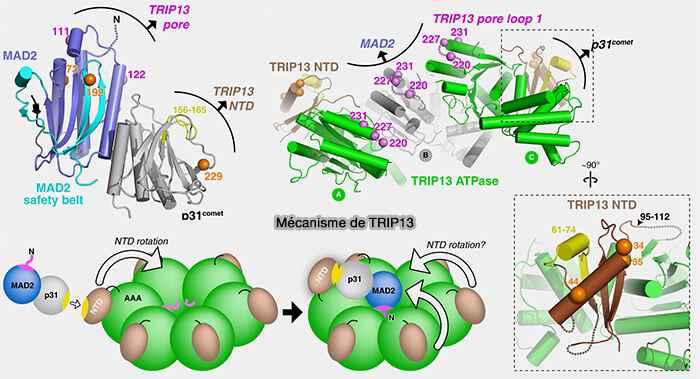
(Figure : vetopsy.fr d'après Ye et coll)
2. p31comet sert d'adaptateur et recrute l’ATPase TRIP13, une ATPase de la famille AAA+, qui alimente mécaniquement la reconversion de C-Mad2 en O-Mad2 par hydrolyse de l’ATP (TRIP13 Regulates Both the Activation and Inactivation of the Spindle-Assembly Checkpoint 2016).
a. En hydrolysant l’ATP, TRIP13 exerce une contrainte mécanique sur le dimère p31-C-Mad2, forçant C-Mad2 à ouvrir sa " safety-belt " et à reprendre sa conformation ouverte, i.e. O-Mad2 (The AAA+ ATPase TRIP13 remodels HORMA domains through N‐terminal engagement and unfolding 2017).
Cette reconversion C-Mad2/O-Mad2 rompt le lien du complexe C-Mad2-Cdc20 par le domaine MIM.

La reconversion C-Mad2/O-Mad2 est irréversible à ce stade et conduit à la libération de Cdc20 et à la désactivation complète du SAC.
Remarque : ce processus lié à p31comet et TRIP13 transforme également le C-Mad2 libéré par les phosphatases de l'étape précédente en O-Mad2.
Il est non fonctionnel sur les O-Mad2.
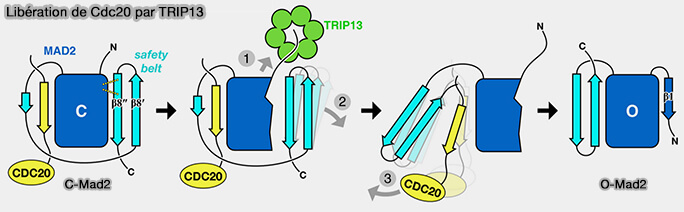
(Figure : vetopsy.fr d'après Ye et coll)
4. Enfin, Mad1, désormais inactif, se retire du kinétochore.
- Mad1 reste sous forme de dimère coiled-coil libre, sans C-Mad2 associé.
- Il demeure dans cet état replié et inactif jusqu’à la prophase suivante, où il sera de nouveau phosphorylé (par MPS1 et Aurora B) et réengagé dans la formation du complexe Mad1-C-Mad2 au début du nouveau cycle mitotique.

Ce mécanisme recycle les composants du SAC et assure un arrêt net du signal inhibiteur.
Anaphase : extinction complète du checkpoint
Une fois le signal inhibiteur du SAC désactivé, Cdc20 se réassocie à l’APC/C sous une conformation ouverte, réactivant l'APC/CCdc20 qui active sa fonction ubiquitine-ligase et amorce les événements irréversibles de l’anaphase et de la sortie de mitose.
1. APC/CCdc20 polyubiquitine la sécurine, inhibiteur direct de la séparase.
- La dégradation de la sécurine libère la séparase, qui clive la sous-unité Scc1 de la cohésine, rompant le lien physique entre les chromatides sœurs.
- Ce clivage provoque la migration des chromatides vers les pôles opposés, marquant le début de l’anaphase.
2. Parallèlement, l’APC/CCdc20 cible la cycline B pour son ubiquitination et sa dégradation.
- La disparition de la cycline B abaisse rapidement l’activité du complexe cycline B/CDK1, entraînant la déphosphorylation de nombreuses cibles mitotiques et la réorganisation du cytosquelette.
- Cette baisse d’activité CDK1 favorise aussi la transition d’APC/CCdc20 vers APC/CCdh1, nécessaire à la sortie complète de mitose.

Le SAC est alors totalement inactif, et la cellule progresse en anaphase et engage la phase de désactivation du système avant la télophase.
3. Une fois les signaux mitotiques levés et le SAC désactivé, l’activité de l’APC/C devient autonomement régulée.
Sa désactivation progressive et le remplacement de Cdc20 par Cdh1 marquent la transition entre :
- la régulation extrinsèque, dépendante des signaux mitotiques,
- la régulation intrinsèque, assurée par des mécanismes internes de rétrocontrôle et d’autoubiquitination qui stabilisent la sortie de mitose et réinitialisent le complexe pour le cycle suivant.


