Complexe APC/C
Régulation extrinsèque
2. Point de contrôle du fuseau mitotique (SAC)
2.1 Prométaphase : activation du SAC
c. Mad1-Mad2 : genèse du pre-MCC
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Sur les kinétochores non attachés, le complexe Mad1-Mad2 catalyse la conversion de Mad2 et initie la formation du pre-MCC, premier complexe inhibiteur du point de contrôle du fuseau.
Mad1-Mad2 et genèse du complexe inhibiteur du SAC (pre-MCC)
Vue d'ensemble
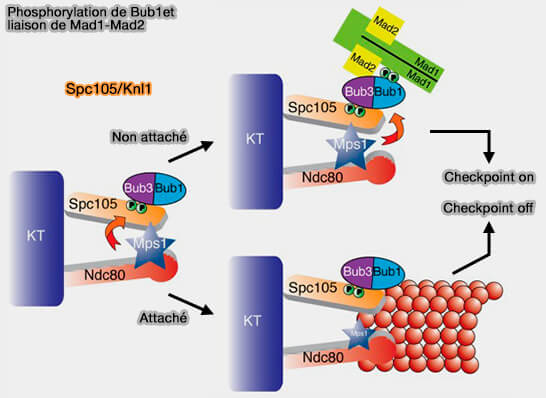
1. La phosphorylation de Bub1 est indispensable à son rôle d’échafaudage pour le recrutement du complexe Mad1-Mad2 (Molecular mechanism of Mad1 kinetochore targeting by phosphorylated Bub1 2021).
(Figure : vetopsy.fr d'après London et Biggins)
a. Une fois Bub1:Bub3, par l'interaction WD40-GLEBS, fixé sur les motifs pMELT de KNL1, la kinase MPS1 et Cdk1 phosphoryle Bub1 sur plusieurs résidus sérine et thréonine situés dans sa région intermédiaire, i.e. CD1.
- Ces phosphorylations confèrent à Bub1 un état de haute affinité pour le motif RLK (Arg-Leu-Lys) situé dans la région C-terminale de Mad1.
- L’interaction Bub1 phosphorylé-Mad1 s’établit ainsi par reconnaissance de ce motif RLK autour du résidu Thr461 et de sérines voisines, assurant le recrutement stable du complexe Mad1-Mad2 au kinétochore (Mad1 kinetochore recruitment by Mps1-mediated phosphorylation of Bub1 signals the spindle checkpoint 2014)..
b. Parallèlement, MPS1 phosphoryle directement Mad1 sur des résidus voisins du motif RLK, stabilisant sa conformation et renforçant la cohésion du complexe Mad1-Mad2 au kinétochore et favorisant la conversion de Mad2 vers sa forme fermée (C-Mad2), capable de recruter Cdc20.

Ce double niveau de phosphorylation de Bub1 et de Mad1 établit le pont fonctionnel entre KNL1 et le complexe Mad1-Mad2, marquant l’étape déterminante de la genèse du pré-MCC.
(Figure : vetopsy.fr d'après Fischer et coll)
2. L’interaction entre Bub1 phosphorylé et le complexe Mad1-Mad2 se déroule sur la face interne du kinétochore, et Bub1:Bub3 positionne MAD1-MAD2 à proximité des répétitions MELT, ce qui favorise la conversion O-MAD2/C-MAD2 et l’amorçage du MCC (Bub1 positions Mad1 close to KNL1 MELT repeats to promote checkpoint signalling 2017).
- Lors du recrutement de MAD1-C-MAD2, par BUB1, le coiled-coil de Mad1 adopte alors une conformation étirée, projetant le domaine C-terminal (portant C-Mad2) hors de la surface du kinétochore.
- Cette extension expose le site de dimérisation de Mad2 et permet la capture d’O-Mad2 cytosolique.
Remarque : un complexe Bub1:Bub3:Cdc20 peut être observé qui représente un intermédiaire transitoire du processus d’assemblage du SAC.
- Bub1, via son motif ABBA, recrute Cdc20 sur la plateforme KNL1-Bub1-Bub3, facilitant sa capture par C-Mad2 pour former le pre-MCC (C-Mad2-Cdc20).
- Ce rôle de facteur d'ancrage, i.e. tethering, favorise la conversion du signal généré par le complexe Mad1-Mad2.
(Figure : vetopsy.fr d'après Fischer et coll)
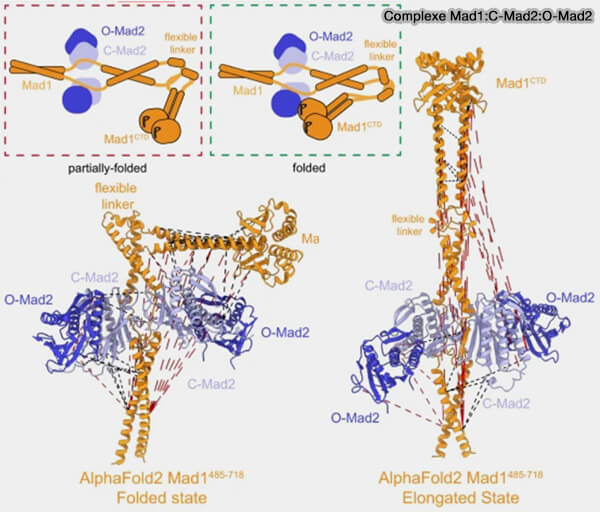
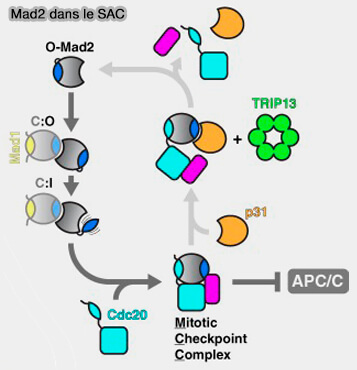
3. Lors de l'assemblage MCC, O-Mad2 est recruté par une interaction transitoire avec la C-Mad2 déjà liée à Mad1, i.e. forme catalytique interface O-C spécifique (Basis of catalytic assembly of the mitotic checkpoint complex 2017).
a. La forme O-Mad2 est flexible et existe libre dans le cytoplasme.
b. Lorsqu’elle entre en contact avec le complexe Mad1-C-Mad2, elle se fixe par dimérisation transitoire sur la C-Mad2 liée à Mad1 pour former un dimère O-C hétérotypique spécifique.
- Cette interaction se fait via le domaine C-terminal (αC et β8-β9 loop) des deux molécules.
- Cette dimérisation oriente O-Mad2 dans la configuration adéquate pour initier son repliement.
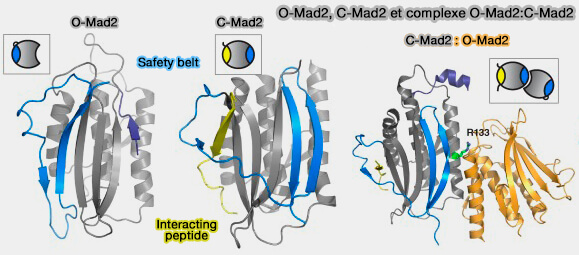
c. Dans cet état amorcé, O-Mad2 acquiert alors la capacité de se lier au MIM de Cdc20 et de fermer sa " safety-belt " , ce qui le transforme en C-Mad2.
Cette interaction est soutenue par le motif KILR au centre du MIM qui reconnaît O-Mad2 (
(Figure : vetopsy.fr d'après Mapelli et coll)
d. Cette conversion est auto-amplifiée, i.e. chaque C-Mad2 nouvellement formé peut convertir d’autres molécules O-MAD2 libres dans le cytoplasme, amplifiant le signal inhibiteur.
Le complexe MAD1-MAD2 constitue donc le convertisseur allostérique du SAC, assurant la transmission du signal d’attachement du kinétochore vers le blocage fonctionnel de l’APC/C.
Modèle
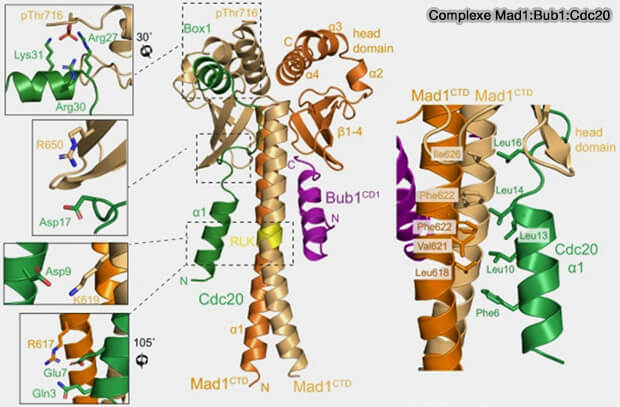
Mad1 est phosphorylé par MPS1, ce qui favorise l'interaction avec le Cdc20 (
1 La phosphorylation de Mad1 sur Thr716 (pThr716) sur un site unique du dimère régule son interaction avec Cdc20 (Juxtaposition of Bub1 and Cdc20 on phosphorylated Mad1 during catalytic mitotic checkpoint complex assembly 2022).
a. L'extrémité N-terminale de Cdc20 (Cdc20N), en particulier son motif Box1, est proposé pour interagir avec Mad1CTD de manière dépendante de la phosphorylation .
b. Les régions de Mad1CTD qui interagissent avec Cdc20N comprennent :
- le motif RLK,
- la région coiled-coil,
- le premier β-brin du domaine de la tête.
c. Comme pour Bub1, une seule copie de Cdc20N liée à l'homodimère pMAD1CTD.
2. Cdc20 et Bub1 partagent une interface de liaison comparable sur Mad1CTD, mais au lieu de se concurrencer, les deux protéines s'y lient simultanément, formant un complexe tripartite.
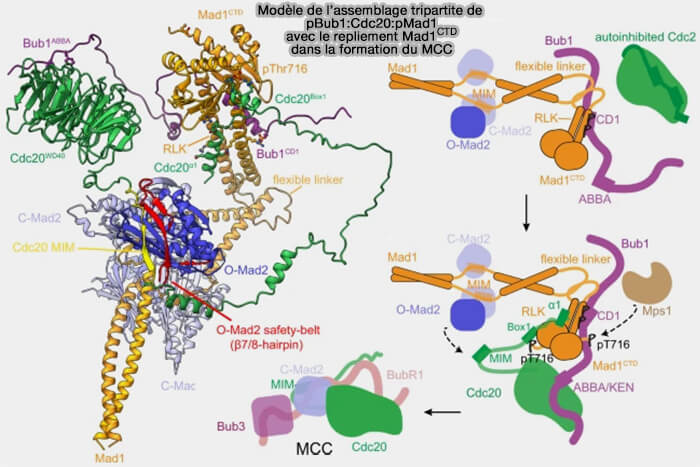
(Figure : vetopsy.fr d'après Fischer et coll)
3. Ce modèle décrit comment cet assemblage positionnerait Cdc20MIM à proximité de O-Mad2 pour leur interaction.
a. Le détachement de la " safety-belt " (β7/8 épingle à cheveux) concomitant à la conversion O-Mad2 à C-Mad2 piégerait le Cdc20MIM au sein de C-Mad2.
- La configuration de Cdc20 dans le contexte de l'échafaudage MCC oriente antparallèlement Cdc20MIM au brin β6 d'O-Mad2, avec lequel il se combine comme un feuillet β antiparallèle dans le complexe C-Mad2:Cdc20.
- Ainsi, la proximité et l'orientation optimale du Cdc20MIM par rapport à O-Mad2, facilitée par l'assemblage du MCC, contribueraient à catalyser la formation de C-Mad2:Cdc20.
Remarque : C-Mad2 dans le complexe C-Mad2-Cdc20 n'est plus lié à Mad1-C-Mad2 et bien que la réaction précédente se déroule au niveau du kinétochore, le nouveau complexe C-Mad2-Cdc20 est libéré immédiatement dans le cytosol.
b. En outre, l'orientation parallèle de Bub1CD1 et Cdc20N par rapport à Mad1CTD, positionne de manière optimale l'interaction Bub1ABBA, située en position C-terminal à Bub1CD1, et le domaine C-terminal WD40 de Cdc20 (Cdc20 WD40) pour leur interaction.
(Figure : vetopsy.fr d'après Mapelli et coll)
c. Ce double ancrage de Cdc20N à pMAD1CTD et de Cdc20 WD40 à Bub1ABBA est un mécanisme plausible pour :
- soulager à la fois l'autoinhibition du Cdc20, autoinhibition due à l'interaction de ses extrémités N- et C-terminales,
- favoriser l'accessibilité du Cdc20MIM pour le piégeage de la " safety-belt " de Mad2.

Le complexe C-Mad2-Cdc20 est aussi appelé pre-MCC ou MCC-intermédiaire et forme le premier complexe inhibiteur partiellement assemblé.
3. Ce complexe quitte le kinétochore pour le cytosol, où il recrute BubR1:Bub3 et devient le MCC complet (C-Mad2-Cdc20-BubR1-Bub3).
- En effet, aucune interaction stable ne le relie de manière durable à Mad1, Bub1, KNL1 ou NDC80.
- Il ne présente aucune interface persistante avec le kinétochore, ce qui explique sa détachement rapide après formation.


