Enzymes
ATPases
Protéines AAA et AAA+
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Protéases (peptidases ou enzymes protéolytiques)
- Phosphatases
- Estérases
- Lipases
- Phospholipases
- ATPases
- Vue d'ensemble et classification des ATPases
- ATPases à moteur rotatif : F/V/A ATpases
- P-ATPases
- Vue d'ensemble et classification des P-ATPases
- P4-ATPases
- Protéines AAA et AAA+
- Transporteurs ABC
- E-ATPases
- GTPases
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La famille des protéines AAA (ATPases Associated with diverse cellular Activities) ou AAA+ possèdent un domaine AAA à activité ATPasique.
Vue d'ensemble
1. Comme leur nom l'indique, les protéines AAA ou AAA+ interviennent dans divers processus en utilisant l'énergie de l'hydrolyse de l'ATP qui génère une force mécanique pour (Evolutionary Relationships and Structural Mechanisms of AAA+ Proteins 2006) :
- participer à l'assemblage ou au désassemblage de complexes macromoléculaires,
- opérer des changements conformationnels de leur substrat qui conduiront à sa dégradation, son désassemblage ou son repliement.

Vous pouvez lire : Fundamental Characteristics of AAA+ Protein Family Structure and Function (2016) et The AAA+ superfamily of functionally diverse proteins (2008).
2. Les protéines AAA ou AAA+ représentent l'un des plus grands groupes ubiquitaires et fonctionnellement divers au sein de la vaste famille des NTPases (NTP : nucléosides triphosphates) à P-loop.
Elles possèdent des motifs de Walker en forme d'anneaux, ici formant, le plus souvent, des complexes hexamériques.
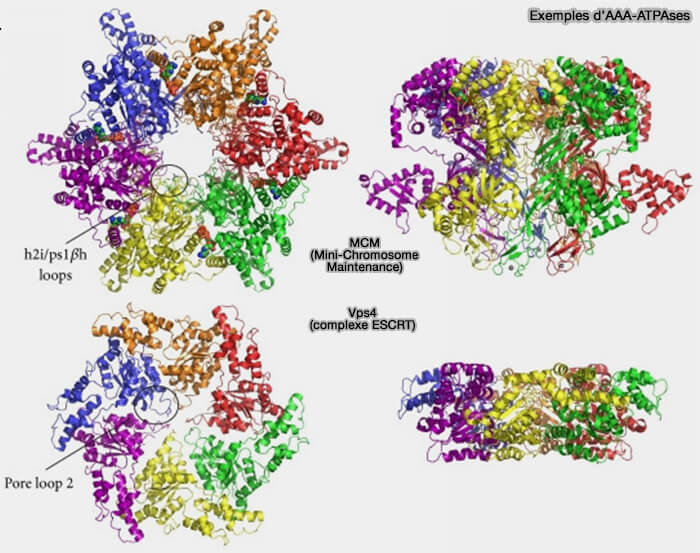
(Figure : vetopsy.fr d'après Miller et Enemark)
Remarque préliminaire importante : les termes AAA et AAA+ sont souvent synonymes dans les articles scientifiques, le domaine AAA étant aussi quelquefois appelé AAA+.
a. Si l'on veut affiner, les protéines AAA+ sont des protéines évoluées des AAA qui possèdent, en plus du domaine AAA, des domaines supplémentaires et des fonctions étendues qui leur confèrent une plus grande diversité fonctionnelle.
b. En outre, elles sont caractérisées par :
- la diversité organisationnelle de leur assemblage oligomérique en complexes protéiques,
- l'hétérogénéité des résidus d'acides aminés qui définissent la clé des motifs interagissant avec les nucléotides,
- des fonctions liées aux acides nucléiques, i.e. hélicase pour le remodelage, contrôle de la transcription, réparation de l'ADN…
c. Ces adaptations influencent :
- la vitesse de la liaison et de l'hydrolyse de l'ATP,
- la stabilité des complexes,
- la spécificité pour les substrats et les mécanismes par lesquels les changements de formation sont couplés à l'intérieur des AAA.
Dans vetopsy.fr, nous pourrons employer indistinctement les deux termes.
2. Les AAA+ ont subi une divergence considérable avant et depuis l’apparition du dernier ancêtre commun lors de l'évolution, i.e. archaeae, bactéries et eucaryotes (Evolutionary history and higher order classification of AAA+ ATPases 2004 et Classification of AAA+ proteins 2006).
a. La classification est donc difficile et on trouve sept grands clades qui sont visibles sur des figures de Fundamental Characteristics of AAA+ Protein Family Structure and Function (2016).
b. D'autres scientifiques les répartissent en cinq grands groupes (
- le groupe AAA élargi,
- le groupe HEC, i.e. hélicases et clamp loaders, chargeur de clamp en français, i.e. complexe protéique spécialisé qui joue un rôle essentiel dans la réplication de l’ADN,
- le groupe PACT, i.e. protéase, chélatase, activateurs transcriptionnels et transporteur comme la dynéine,
- le groupe ExeA,
- le groupe STAND (Signal Transduction ATPases with Numerous Domains), présent que chez les bactéries.
Structure générale des protéines AAA+
La famille AAA+, sous-ensemble de la superfamille des protéines P-loop, possède un pli α/β distinct.

Le domaine AAA ou AAA+, caractéristique des protéines AAA et étudié dans un chapitre spécifique, n'existe pas dans les autres NTPases.
1. Les protéines AAA et AAA+ présentent le plus souvent une structure hexamérique en anneau qui est la forme active typique pour beaucoup d'entre elles, qui permet un mécanisme coopératif d’hydrolyse de l’ATP et d’interaction avec leurs substrats.
Certaines sous-unités peuvent ne pas présenter d'activité catalytique comme dans la dynéine par exemple (
Remarque : toutefois, d'autres oligomères peuvent exister, dimère, trimère, pentamère, heptamère, octomère et dodécamère quand deux anneaux héxamériques sont empilés comme dans le cas du protéasome ou des Clp (Caseinolytic protease) comme ClpA, ClpC ou la famille ClpB/Hsp100 (Both ATPase Domains of ClpA Are Critical for Processing of Stable Protein Structures 2009).
2. Cet anneau, qui peut être fermé, ouvert ou spiralé selon le nucléotide (ATP/ADP), peut expliquer leur rôle de moteur moléculaire, comme dans le cas des 6 sous-unités Rpt du régulateur 19S du protéasome 26S (AAA+ Proteases: ATP-Fueled Machines of Protein Destruction 2011).
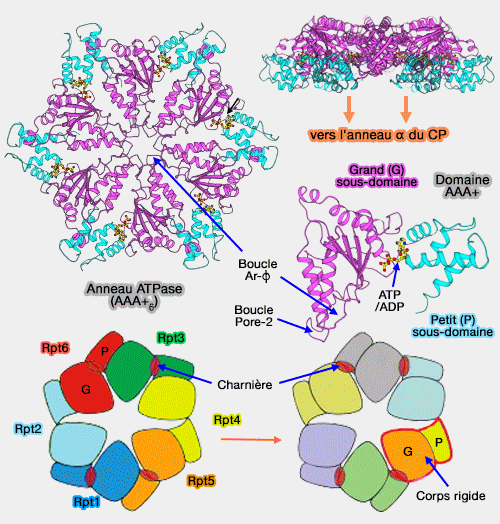
(Figure : vetopsy.fr d'après Zhang et Glynn)
a. Le site de liaison de l'ATP se retrouve entre le petit domaine d'une unité et le grand domaine de l'unité suivante.
b. La liaison du nucléotide modifie la rotation entre les grands et les petits domaines d'une sous-unité, et explique le mécanisme permettant de relier le cycle de l'ATP aux changements conformationnels dans l'anneau hexamérique.
c. Ce mécanisme permet :
- la translocation du substrat dans le protéasome,
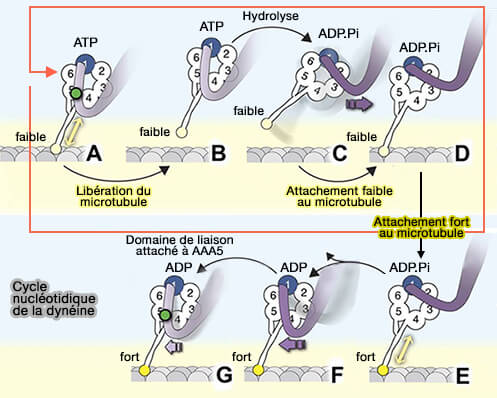
- la translocation des E-hook des tubulines dans la fission des microtubules,
- la fermeture de la poche nucléotidique entre AA1 et AA2 dans l'anneau de la dynéine qui se transmet au domaine de liaison des microtubules (MTBD),
2. Citons comme autres exemples de protéines AAA dans vetopsy.fr :
(Figure : vetopsy.fr d'après Toropowa et coll)
- Vps4 du complexe ESCRT,
- NSF/Sec18 (N-éthylmaléimide Sensitive Fusion protein), impliquée dans le désassemblage du complexe SNARE,
- fidgetin, la spastine et la katanine qui interviennent dans la fission des microtubules,
- les protéases AAA mitochondriales…
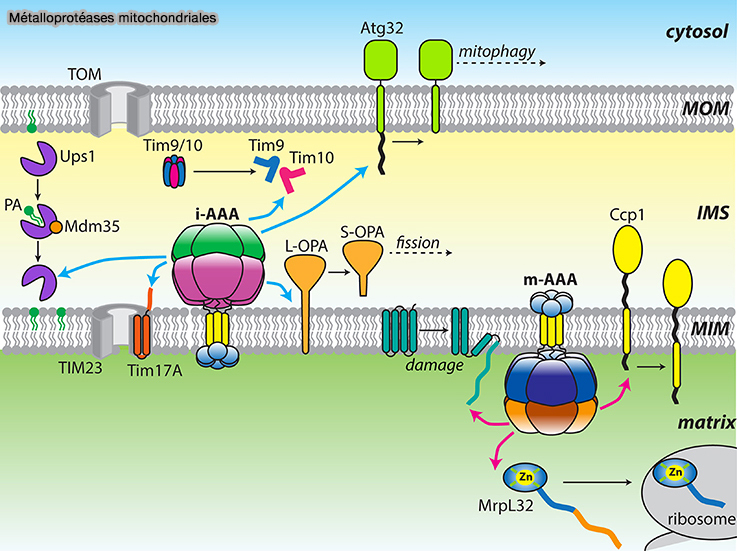
(Figure : vetopsy.fr d'après Glynn et coll)
Fonctions des protéines AAA+
Les protéines AAA et AAA+ jouent un rôle essentiel dans de nombreux processus cellulaires mécaniquement exigeants pour pouvoir remodeler ou déplacer des macromolécules :
- remodelage et dégradation des protéines,
- assemblage/désassemblage de complexes macromoléculaires,
- maintenance et qualité des protéines,
- transport et translocation de protéines à travers des membranes,
- réplication, réparation et recombinaison de l’ADN,
- signalisation et régulation cellulaire…
Les fonctions sont nombreuses et résumées sur la figure ci-dessous.
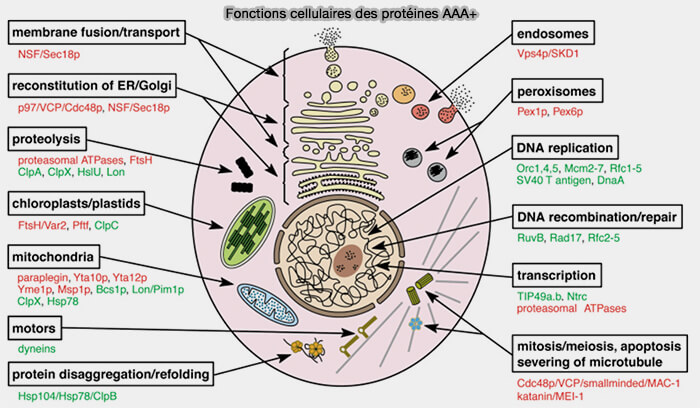
(Figure : vetopsy.fr d'après Ogura et Wilkinson)


