Enzymes :
Groupe des hydrolases (EC 3)
Protéases (peptidases ou enzymes protéolytiques)
Vue d'ensemble et classification
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

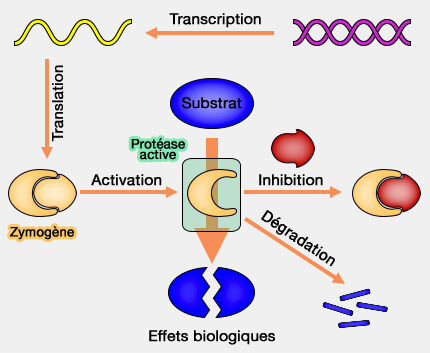
Les protéases (peptidases ou enzymes protéolytiques), classées parmi les hydrolases, assurent, en grande partie, la dégradation des protéines (protéolyse).
(Figure : vetopsy.fr d'après Gbdivers et Webridge)
Les autres processus peuvent être la digestion intra-moléculaire, ainsi que la protéolyse par des températures élevées ou par des pH bas.

La base de données MEROPS est une ressource d'information inépuisable sur les peptidases et les protéines qui les inhibent.
Classification
des protéases
Les protéases peuvent être classées selon plusieurs critères.
Selon la position de la
coupure de la chaîne
peptidique
1. Les exopeptidases (ou exoprotéases) clivent l'extrémité de la protéine.
- Les aminopeptidases coupent la liaison entre le premier et le second acide aminé, libérant l'acide aminé N-terminal.
- Les carboxypeptidases coupent entre la liaison entre l'avant-dernier et le dernier acide aminé de la chaîne, libérant l'acide aminé C-terminal.
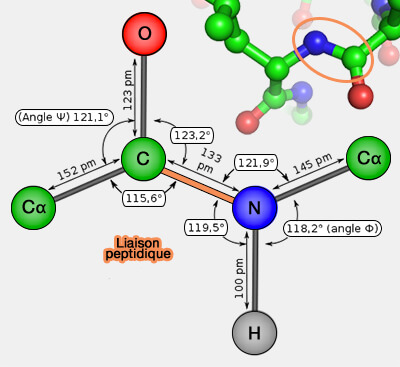
2. Les endopeptidases (ou endoprotéases) clivent une liaison à l'intérieur de la chaîne protéique.
Une isopeptidase coupe une liaison isopeptidique, i.e. liaison peptidique qui se trouve dans la chaine principale de la protéine.
Selon leur mécanismes d'action et la nature de leur résidu catalytique
Les protéases sont classées, suivant leur description chronologique (New families of carboxyl peptidases: serine-carboxyl peptidases and glutamic peptidases 2011).
1. Les protéases à acide aspartique - A - (1993),
2. Les protéases à cystéine - C -, aussi appelées protéases à thiol (1993) : (
(Figure : vetopsy.fr)
3. Les protéases à sérine - S - (1993),
4. Les métalloprotéases - M -, utilisant un cation bivalent (1993),
- le zinc, $\ce{Zn++}$, en général (
rôle dans la désubiquitination),
- le cobalt, $\ce{Co++}$ ou le manganèse, $\ce{Mn++}$ (
rôle dans la voie de signalisation Wnt ou rôle dans la voie de signalisation BMP).
5. Les protéases à thréonine - T - (1997),
6. Les protéases à acide glutamique - G - (2004),
7. Les protéases à asparagine - N -, utilisant une asparagine pour effectuer une réaction d'élimination qui n'utilise pas de molécule d'eau (2011).
Certaines protéases ont évolué à partir d'un ancêtre commun et forment une superfamille évolutive qui contiennent des familles utilisant différents nucléophiles dans leur triade catalytique (PA clan).


