Constituants cellulaires
Cytosquelette : microtubules
Nucléation centrosomale : vue d'ensemble et molécules
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La nucléation centrosomale repose sur le recrutement, l’ancrage et l’activation du γ-TuRC et de ses cofacteurs péricentriolaires dans le PCM, où le centrosome impose la polarité et organise un réseau microtubulaire radial efficace.
Principes généraux de la nucléation centrosomale
Le complexe γ-TuRC devient pleinement nucléant uniquement lorsqu’il est recruté et stabilisé dans le matériel péricentriolaire (PCM).
Le centrosome constitue ainsi le principal plateau d’activation du complexe dans les cellules animales.
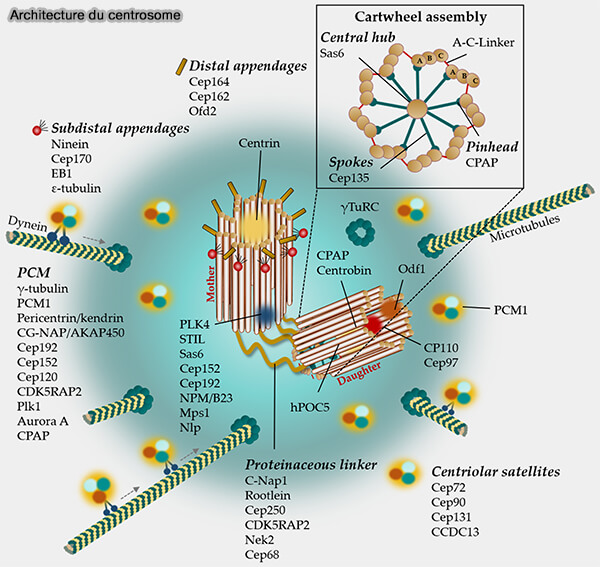
(Figure : vetopsy.fr d'après Bühler et Stolz)
1. Le PCM forme un échafaudage matriciel riche en cofacteurs qui (
- concentrent les γ-TuRC,
- stabilisent leur conformation fermée,
- orientent systématiquement les extrémités (-) vers le centre du centrosome,
- permettent une nucléation radiale efficace.
2. Le recrutement repose principalement sur trois acteurs (Self-assembly of pericentriolar material in interphase cells lacking centrioles 2022) :
- NEDD1,
- CDK5RAP2,
- la péricentrine (PCNT) qui sert de charpente fibreuse indispensable à la concentration des γ-TuRC.
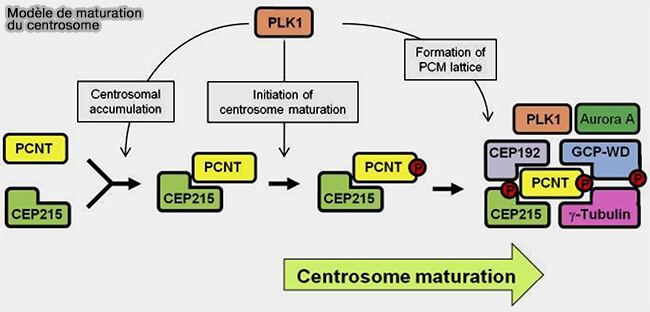
(Figure : vetopsy.fr d'après Lee et Rhee)
Facteurs de ciblage et d’ancrage
NEDD1 (GCP-WD)
NEDD1 (GCP-WD) est la protéine de ciblage essentielle au positionnement du γ-TuRC au centrosome.
Elle ancre les complexes γ-TuRC dans le matériel péricentriolaire (PCM), ce qui fixe précisément leurs sites d’action et garantit une nucléation localisée des microtubules.

Vous pouvez lire : Structure of the microtubule-anchoring factor NEDD1 bound to the γ-tubulin ring complex (2025).
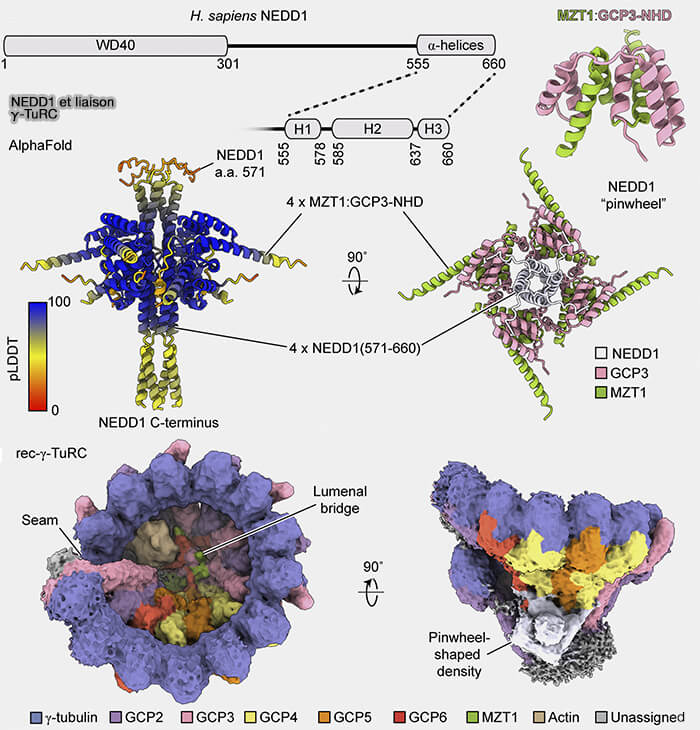
(Figure : vetopsy.fr d'après Muñoz-Hernandez et coll)
Ancrage de NEDD1 au γ-TuRC
1. Le domaine WD40 en forme de propeller de NEDD1 adopte une architecture en " pinwheel ” (roue à palettes) atypique, distincte des propellers WD40 classiques par une asymétrie marquée de ses lames et une polarisation fonctionnelle de sa surface concave.
a. Le " pinwheel ” présente :
- une lame 1 élargie, enrichie en résidus chargés, formant un point d’accroche initial pour GCP3,
- une lame 4 plus rigide, optimisée pour l’association stable avec GCP6,
- une inclinaison structurale vers le bas du γ-TuRC, i.e. tilt global, en contraste avec les WD40 classiques plus plans et symétriques.
b. Cette géométrie spécialisée permet au domaine WD40 de s’insérer contre une surface latérale asymétrique du γ-TuRC, centrée sur le module GCP3-GCP6 et stabilisée par MZT1, qui verrouille l’orientation de GCP3.
Elle oriente NEDD1 dans une configuration favorable à l’ancrage au PCM.
2. L’ajustement fin le long des feuillets β du pinwheel génère une interface étroite mais hautement complémentaire, limitant la flexibilité latérale du γ-TuRC et favorisant son état « ouvert-actif ».
Cette triade MZT1-GCP3-GCP6 constitue le véritable noyau d’interaction reconnu par NEDD1, corrigeant les modèles antérieurs qui supposaient une liaison globale aux GCP canoniques.
Remarque : même s’il n’existe qu’un seul GCP6, la cryo-EM montre que trois modules MZT1-GCP3 et une crête latérale élargie associée au flanc GCP6 génèrent quatre signatures structurales compatibles avec le pinwheel de NEDD1, expliquant la fixation de quatre molécules de NEDD1 sur un même γ-TuRC.
4. Ces interactions souples mais multivalentes créent un réseau d’ancrage élastique, maintenant le γ-TuRC capturé dans le PCM, tout en lui permettant une réorientation mineure pour aligner le tube de γ-tubuline avec les protofilaments naissants.
Ancrage de NEDD1 au PCM (centrosome)
La queue C-terminale intrinsèquement désordonnée de NEDD1 constitue le module central d’ancrage du γ-TuRC au centrosome, en s’associant à deux plateformes majeures du PCM, i.e. PCNT (péricentrine) et CDK5RAP2.
- Cette région flexible assure une fixation multivalente sur la charpente fibreuse fournie par PCNT, stabilisant mécaniquement les complexes γ-TuRC dans la matrice péricentriolaire.
- En parallèle, l’interaction avec CDK5RAP2 via son domaine CM1 renforce l’attachement fonctionnel et consolide l’orientation active du γ-TuRC au voisinage immédiat des centrioles, garantissant une nucléation efficace, focalisée et strictement contrôlée.
Rôle organisationnel de NEDD1
En interphase, NEDD1 recrute et concentre les complexes γ-TuRC dans le PCM interne, au voisinage immédiat des centrioles, ce qui organise un réseau de nucléation radial dense et relativement stable, de type aster.
1. Sa distribution multivalente sur quatre sites structuraux du γ-TuRC maintient une forte densité locale de complexes nucléants, garantissant la formation d’asters homogènes et orientés.
2. L'absence de NEDD1 reflète la perte simultanée d’un ancrage directionnel et d’une concentration locale suffisante de γ-TuRC.
- Le γ-TuRC se dissocie en fraction diffusible,
- Les microtubules émergent de sites ectopiques faibles ou non organisés,
- La cellule perd la radialité caractéristique de son réseau microtubulaire.
CDK5RAP2 (CEP215)
CDK5RAP2 (CEP215), protéine d’environ 2150 résidus, agit comme stabilisateur et activateur du γ-TuRC recruté au centrosome, en coopération directe avec NEDD1.
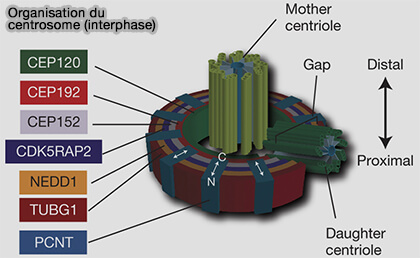
(Figure : vetopsy.fr d'après Lawo et coll)
Contrairement à Spc72 de la levure, présent en quatre copies fixes, CDK5RAP2 s’accumule en quantités variables au sein du PCM, formant une matrice péricentriolaire dense et flexible qui ajuste dynamiquement le recrutement et l’activation du γ-TuRC selon l’état du cycle cellulaire (Structural insights into the interplay between microtubule polymerases, γ-tubulin complexes and their receptors 2025).
1. En s’associant à la queue C-terminale intrinsèquement désordonnée de NEDD1, CDK5RAP2 :
- consolide l’attachement du γ-TuRC déjà recruté, tout en amorçant sa transition vers une conformation plus compacte, prémisse de l’état fermé nucléant,
- ancre les complexes γ-TuRC dans le matériel péricentriolaire (PCM) interne, en les positionnant au sein de la zone péricentriolaire la plus dense et la plus favorable à l’émergence des microtubules, région où la concentration de fibres péricentriolaires, de facteurs activateurs et de cofacteurs du γ-TuRC crée un microenvironnement optimal pour initier la nucléation,
- renforce leur orientation productive, en orientant la face active du complexe vers le cytoplasme grâce à l’action structurante du domaine CM1,
- maintient leur proximité immédiate avec les centrioles, augmentant ainsi la capacité nucléatrice du centrosome
2. Le domaine CM1/γ-TuNA, motif hélicoïdal conservé d’environ 80-100 résidus, présent de CDK5RAP2/CEP215 et CDK5RAP2-like/myomégaline à l'appareil de Golgi agit comme module allostérique capable d’imposer au γ-TuRC une géométrie productive proche de la configuration optimale à 13 spokes.
a. CM1 exerce une action locale de verrouillage sur les interfaces GCP, favorisant la transition de l’état ouvert flexible vers un anneau fermé, rigide et nucléant :
- en renforçant la conformation fermée à 13 positions actives,
- en augmentant l’affinité du γ-TuRC pour les dimères d'αβ-tubuline,
- en stabilisant un état " pré-nucléant " à faible énergie, compatible avec l'engagement initial des protofilaments.
b. CM1 stabilise également les spokes GCP4, GCP5 et GCP6, en renforçant leurs interfaces latérales et en favorisant la fermeture locale de l’anneau, ce qui consolide la cohésion du module catalytique et sécurise les 13 positions productives indispensables à la nucléation.
Remarque : les régions distales décrites comme " CM2-like ” dans certains articles sur CDK5RAP2 ne correspondent pas à un motif structuré ni à un module fonctionnel équivalent au CM2 de la drosophile.

Cette coopération NEDD1-CDK5RAP2 constitue un double verrou : NEDD1 positionne, CDK5RAP2 active et stabilise.
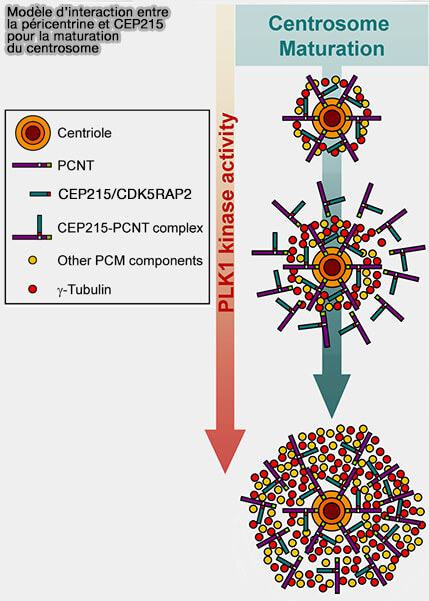
(Figure : vetopsy.fr d'après Kim et Rhee)
3. CDK5RAP2 est un acteur clef de la transition interphase ➞ mitose par sa phosphorylation par Plk1 et le complexe cycline B/CDK1 (MPF) qui provoque :
- l'expansion volumique du PCM,
- le recrutement massif de γ-TuRC supplémentaires,
- une augmentation de la densité et de la capacité nucléante du centrosome, couplée à l’action de NEDD1.
Péricentrine
(PCNT)
La péricentrine (PCNT), d'environ 3336 résidus, constitue une charpente fibreuse indispensable à la concentration des γ-TuRC.
Son domaine PACT (Pericentrin-AKAP450 Centrosomal Targeting domain) C-terminal de 80 à 100 résidus, selon les espèces, 3230-3336 environ, ancre PCNT au centrosome.
1. Elle sert de plateforme de liaison pour (Importance of the CEP215-Pericentrin Interaction for Centrosome Maturation during Mitosis 2014) :
- CDK5RAP/CEP215, interaction centrée sur les résidus 1500-2100.
- NEDD1 (GCP-WD), interaction centrée sur les résidus 2200-3000.
La queue C-terminale intrinsèquement désordonnée de NEDD1 s’engage dans les fibres coiled-coil centrales de PCNT (en amont du domaine PACT), créant un ancrage multivalent qui maintient les γ-TuRC dans le cœur du PCM.
CDK5RAP2, lui-même recruté par CEP192, via des segments péricentriolaires compatibles, s’assemble sur ces mêmes fibres, consolidant l’arrimage des complexes nucléants par son domaine CM1.
2. La nature fibrillaire et radiale de PCNT forme une armature interne qui contraint la distribution de NEDD1-γ-TuRC en un maillage dense, optimisant la densité de sites nucléants tout en préservant une orientation radiale vers le cytoplasme.
- Elle stabilise la localisation centrale des γ-TuRC au plus près des centrioles.
- En limitant la diffusion latérale des complexes, PCNT garantit que la nucléation reste centrée, cohérente et mécaniquement robuste.
3. Sa phosphorylation dépendante de Plk1 déclenche un recrutement extensif du γ-TuRC, amplifiant la densité des sites nucléants.
Cette expansion est essentielle à la formation d’asters mitotiques très denses, nécessaires à la construction du fuseau bipolaire.
Organisation et maturation du γ-TuRC au centrosome
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


