Constituants cellulaires
Cytosquelette : microtubules
Nucléation : γ-TuRC (γ-tubulin ring complex)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le γ-TuRC est un complexe annulaire asymétrique dont la géométrie, fondée sur la γ-tubuline et les GCP, sert de gabarit initial à la nucléation des microtubules.
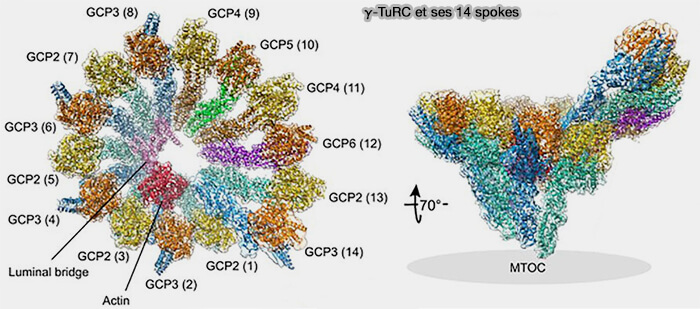
Vue d'ensemble du γ-TuRC
Le γ-TuRC forme un gabarit annulaire pré-organisé, géométriquement équivalent à l’extrémité (-) d’un microtubule, ce qui permet d’abaisser drastiquement la barrière énergétique associée à la formation des premiers protofilaments (Molecular insight into how γ-TuRC makes microtubules 2021).
1. Le γ-TuRC impose la géométrie du polymère en alignant asymétriquement 14 spokes, mais seulement 13 positions correctement alignées pour accueillir un protofilament.
(Figure : vetopsy.fr d'après Sulimenko et coll)
a. Le γ-TuRC impose la géométrie caractéristique du polymère en :
- orientant les dimères α/β de tubuline selon la polarité native du microtubule,
- imitant via la γ-tubuline la courbure de l’extrémité naissante,
- stabilisant les premiers contacts longitudinaux, étape limitante de la nucléation.
b. Cette organisation protège :
- l’extrémité (-), naturellement instable si elle n’est pas ancrée,
- la zone initiale de nucléation, permettant à l’extrémité (+) d’être immédiatement disponible pour la polymérisation.
2. La forme annulaire reproduit fidèlement la géométrie du cylindre microtubulaire permettant une croissance rapide de l’extrémité (+) dès que le noyau initial est formé.
Structure du γ-TuRC
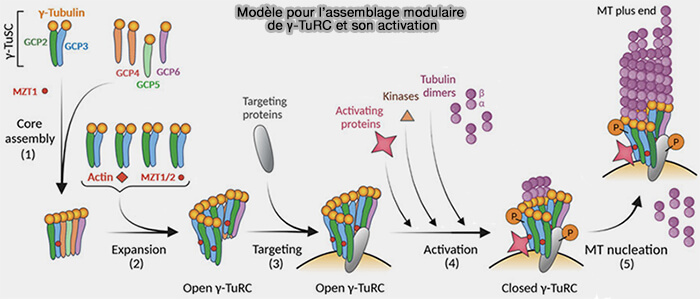
La capacité nucléatrice du γ-TuRC repose sur une architecture modulaire où le γ-TuSC constitue l’unité de base, ensuite complétée par des GCP structurales (GCP4, GCP5, GCP6) permettant d’obtenir le gabarit annulaire complet (Molecular insight into how γ-TuRC makes microtubules 2021).
γ-TuSC
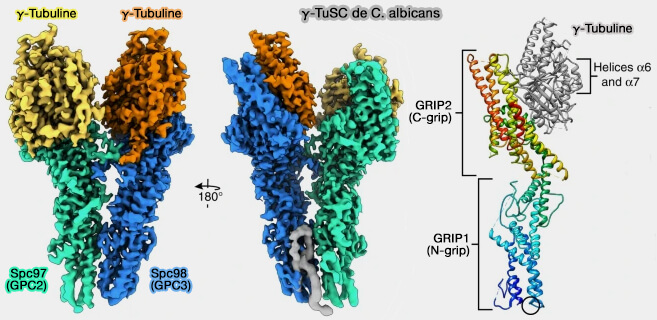
Le γ-TuSC (γ-tubulin small complex) est le module tripartite élémentaire de nucléation composé de (The cryo-EM structure of a γ-TuSC elucidates architecture and regulation of minimal microtubule nucleation systems 2020) :
- γ-tubuline, aussi appelée GCP1 (Gamma-tubulin Complex Protein1),
- GCP2,
- GCP3.
(Figure : vetopsy.fr d'après Zupa et coll)
Le γ-TuSC forme un module ouvert, souvent décrit comme un " coin " ou un " arc partiel ", capable de fixer deux molécules de γ-tubuline dans une configuration déjà préorientée.
- Le γ-TuSC mimique localement la géométrie du polymère, mais ne suffit pas à créer un anneau complet.
- Sa stabilité est faible, limitant son efficacité nucléatrice isolée.

Le γ-TuSC agit comme précurseur du γ-TuRC, complexe majeur.
γ-tubuline
La γ-tubuline appartient à la même famille que les tubulines α et β (Insights into microtubule nucleation from the crystal structure of human γ-tubulin 2005).
On ne trouve que deux isoformes chez l'homme, γ1 et γ2, qui ne diffère que de dix acides aminés, dont neuf sont situés dans les domaines C-terminaux des molécules (aa 389-451).
Elle possède des caractéristiques structurales et fonctionnelles uniques qui la rendent indispensable à la nucléation plutôt qu’à la polymérisation (γ-Tubulin in microtubule nucleation and beyond 2022).
Remarque : la γ-tubuline interagit avec les composants cellulaires qui influencent l’architecture nucléaire (Non-Canonical Functions of the Gamma-Tubulin Meshwork in the Regulation of the Nuclear Architecture 2020).
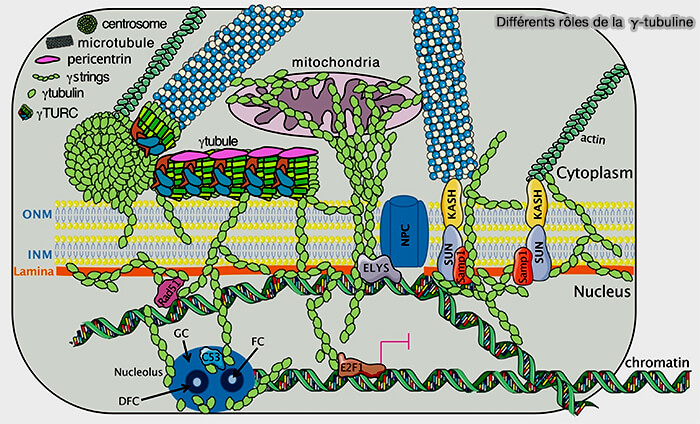
(Figure : vetopsy.fr d'après Corvaisier et Alvarado-Kristensson)
1. la γ-tubuline est un facteur d'initiation, pas de polymérisation.
La γ-tubuline fixe un GTP quasi non hydrolysé, ce qui verrouille son domaine N-terminal dans une conformation peu flexible,
- L’absence de cycle hydrolytique évite toute déformation, condition essentielle pour servir de support géométrique constant au gabarit annulaire.
- Cette rigidité contraste avec la β-tubuline, dont la transition GTP ➞ GDP induit courbure et instabilité.
2. Ses interfaces sont adaptées pour se lier aux GCP (GCP2-6) plutôt qu’aux dimères α/β et ses surfaces latérales et longitudinales comportent plusieurs particularitées.
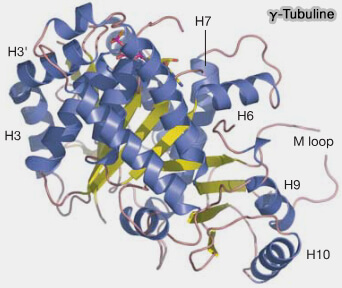
(Figure : vetopsy.fr d'après Aldaz et coll)
a. La répartition d’acides aminés est incompatible avec la formation des contacts longitudinaux β/α typiques des protofilaments.
b. La γ-tubuline ne possède pas la M-loop fonctionnelle des α/β, ce rend impossible l'interaction latérale des protofilament, i.e. la construction de la paroi tubulaire.
Sans M-loop, elle ne peut adopter la conformation permettant l’emboîtement dans le " creux " latéral d’un dimère voisin, et donc contribuer à la cohésion latérale qui stabilise un réseau de protofilaments.
c. Les surfaces latérales et terminales de la γ-tubuline comportent :
- des motifs électrostatiques optimisés pour les domaines N-grip et C-grip des GCP2-6,
- des régions reconnues spécifiquement par NEDD1 (GCP-WD), adaptateur critique pour le ciblage du γ-TuRC au centrosome,
- des interfaces compatibles avec CDK5RAP2, qui stabilise et active le γ-TuRC dans le PCM.

Ces différences expliquent pourquoi la γ-tubuline ne peut pas s’insérer dans un microtubule, ni le prolonger.
3. Dans le γ-TuRC, chaque γ-tubuline est orientée de manière à reproduire la face interne d’un protofilament, ce qui positionne les premiers dimères α/β dans une géométrie immédiatement compatible avec la polarité et la croissance du microtubule (
GCP2 et GCP3
GCP2 (Gamma-tubulin Complex Protein2) et GCP3 constituent les deux composants fondamentaux du γ-TuSC en formant, avec deux molécules de γ-tubuline, un module asymétrique indispensable à la nucléation.

Vous pouvez lire : Asymmetric Molecular Architecture of the Human γ-Tubulin Ring Complex (2020) où l'on étudie toutes les ineeractions avec les GCP.
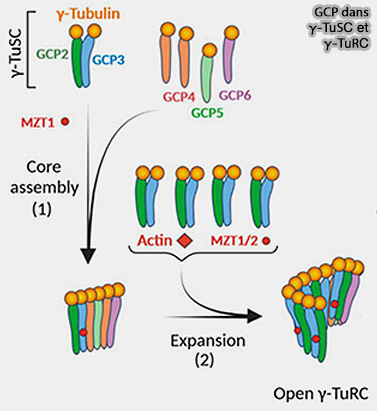
(Figure : vetopsy.fr d'après Sulimenko et coll)
1. GCP2 (Spc97 chez la levure) et GCP3 (Spc98) possèdent une architecture en forme de " pince " qui leur permet de maintenir la γ-tubuline dans une orientation rigide, compatible avec la géométrie interne d’un protofilament.
a. Chacun possède, comme les autres GCP, i.e. 4/5/6, :
- un domaine N-grip, formé d’un ensemble d’hélices α organisées en Arch-like repeats, qui stabilise la γ-tubuline au niveau de sa face latérale,
- un domaine C-grip, plus allongé, qui impose l’orientation de la γ-tubuline et assure la courbure caractéristique nécessaire à la formation de l’anneau.
b. Bien que GCP2 et GCP3 soient homologues, ils ne sont pas équivalents et l'asymétrie GCP2/GCP3 est indispensable au γ-TuSC d’adopter une géométrie compatible avec le futur γ-TuRC pour la fermeture de l'anneau et la la disposition à 13 positions.
- GCP2 stabilise une γ-tubuline dans une orientation relativement droite, contribue aux contacts longitudinaux entre modules γ-TuSC et joue un rôle d’ancrage structurel dans l’arc.
- GCP3 impose une courbure plus prononcée, essentielle pour amorcer la fermeture de l’anneau, et porte des éléments conformationnellement plus flexibles qui constitue la clé permettant la géométrie du γ-TuRC

(Figure : vetopsy.fr d'après Zupa et coll)
2. Chacune des deux GCP fixe une γ-tubuline par la coopération de leurs domaines N-grip et C-grip, qui présentent des poches chargées reconnaissant les résidus acides situés à l’extrémité de la γ-tubuline, ce qui stabilise solidement l’association.
a. Un spoke est un " rayon " structurel du γ-TuRC, composé d’un GCP et une γ-tubuline.
- Il s’agit d’une colonne radiale du gabarit, pas d’un protofilament qui est un assemblage de tubulines α/β du microtubule.
- Chaque spoke est un support permettant d'arrimer une molécule de γ-tubuline dans une orientation spécifique.
(Figure : vetopsy.fr d'après Guillet et coll)
b. Les spoke GCP2 et GCP3 verouillent la γ-tubuline dans une conformation droite, analogue à celle de la tubuline-GTP, indispensable pour accueillir les premiers dimères α/β.
Ils imposent une orientation qui reproduit la face interne d’un protofilament, abaissant la barrière énergétique d’insertion des premières tubulines.
c. Le module γ-TuRC est composé par les GCP2 (spokes 1, 3, 5, 7 et 13) et GCP3 (spokes 2, 4, 6, 8 et 14)., principalement.
Ils forment la majeure partie de l’anneau et, avec les GCP4/5/6, assurent la géométrie conduisant aux 13 positions nucléantes fonctionnelles.

La γ-tubuline occupant systématiquement la position interne et proximale, le côté γ-tubuline du noyau devient l’extrémité (-), laissant l’extrémité (+) libre pour la polymérisation.
GCP4, GCP5 et GCP6
GCP4, GCP5 et GCP6 sont des GCP non canoniques qui, contrairement à GCP2 et GCP3, n’interagissent pas directement avec les protofilaments naissants, mais assurent (Microtubule Nucleation Properties of Single Human γTuRCs Explained by Their Cryo-EM Structure 2020) :
- la fermeture de l’anneau,
- l’ajustement de la courbure,
- l’ancrage des cofacteurs d’activation du γ-TuRC.
GCP4, GCP5 et GCP6 forment un groupe de GCP non canoniques qui sont indispensables à la formation du γ-TuRC à 14 spokes.
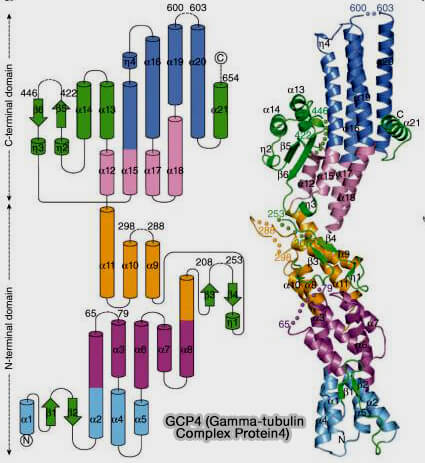
1. Dans les spokes GCP4 (9 et 11), les deux copies de GCP4 occupent des positions spécifiques où la courbure et l’angle doivent s’ajuster entre γ-TuSC et GCP5/6 (Crystal structure of γ-tubulin complex protein GCP4 provides insight into microtubule nucleation 2013).
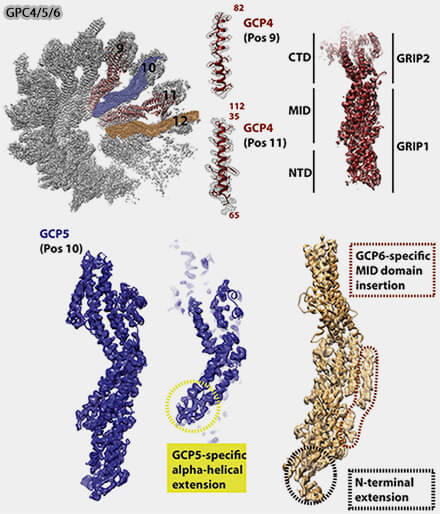
(Figure : vetopsy.fr d'après Consolati et coll)
a. GCP4 amortit la différence d’angle entre les spokes GCP2-GCP3 faiblement courbés et les spokes GCP5/6, et en particulier GCP6 à courbure plus forte et à orientation légèrement différente.
Sa structure est moins rigide que GCP5, mais plus flexible que GCP2/3, ce qui lui permet d’absorber progressivement la différence d’inclinaison entre les spokes.
b. C’est un élément de transition mécanique entre deux segments qui n’ont pas la même courbure naturelle et c'est pour cela que GCP4 se trouve en deux copies.
Sans GCP4, l’anneau ne peut pas se fermer correctement

Vous pouvez lire : Asymmetric Molecular Architecture of the Human γ-Tubulin Ring Complex (2020) où l'on étudie toutes les ineeractions avec les GCP.
2. Dans le spoke GCP5 (10), GCP5 adopte une conformation plus rigide et sert de support structurel dans la zone intermédiaire entre les positions γ-TuSC et la zone GCP6.
3. Dans le spoke GCP6 (12), GCP6 occupe une position singulière indispensable à la fermeture du cercle, car son domaine C-grip élargi assure :
- une stabilisation latérale renforcée,
- une interface d’accueil pour NEDD1 (GCP-WD), essentiel au recrutement au centrosome, et CDK5RAP2, qui renforce la capacité du γ-TuRC à initier la nucléation.
- un rôle direct dans l’activation du γ-TuRC.
Remarque : les autres spokes sont occupés par les modules γ-TuSC contenant des GCP2 (spokes 1, 3, 5, 7 et 13) et GCP3 (spokes 2, 4, 6, 8 et 14).
γ-TuRC
1. La combinaison de multiples γ-TuSC et des GCP structurales crée le γ-TuRC asymétrique à 14 spokes, mais à seulement 13 positions correctement alignées pour accueillir un protofilament.
a. Le γ-TuRC n’est pas une copie exacte du microtubule, mais un gabarit légèrement ouvert et asymétrique, conçu pour stabiliser l’extrémité (-) sans imposer une fermeture circulaire complète.
b. La 14ᵉ position est non productive, légèrement décalée, structurellement différente qiui correspond au seam du γ-TuRC, analogue au seam du microtubule, mais encore plus marqué (Assembly of the asymmetric human γ-tubulin ring complex by RUVBL1-RUVBL2 AAA ATPase 2020)
Cette " couture ” structurelle, zone où l’anneau n’est pas parfaitement fermé, est indispensable pour que l’énergie élastique ne soit pas trop élevée, et pour permettre un assemblage progressif.

(Figure : vetopsy.fr d'après Zimmermann et coll)
2. Les protofilaments naissants s’arriment aux γ-tubulines des spokes contenant GCP2 et GCP3, seuls modules dont l’orientation et l’interface sont compatibles avec la fixation du premier dimère d'αβ-tubuline.
a. La γ-tubuline fournit une surface d’interaction équivalente à celle d’une β-tubuline, ce qui permet au premier dimère α/β de s’attacher par sa sous-unité α.
Ce contact initie l’orientation longitudinale correcte du protofilament naissant.
b. Cela abaisse la barrière énergétique d’insertion des premières tubulines α/β.
3. Les spokes GCP4, GCP5 et GCP6, bien qu’eux aussi porteurs d’une γ-tubuline, assurent un rôle structurel et ne participent pas directement à la nucléation.
- D'une part, la γ-tubuline est légèrement basculée, tournée latéralement, non alignée avec l’axe longitudinal attendu d’un protofilament, ce qui inhibe l'arrimage du le premier dimère α/β.
- D'autre part, plusieurs résidus exposés sont incompatibles électrostatiquement avec α-tubuline, la surface latérale est distordue par les contraintes de courbure et l’interface imite moins bien l’état β-tubuline-GTP.
- Enfin, leur rôle mécanique impose une géométrie de stabilisation plutôt que d’amorçage.
(Figure : vetopsy.fr d'après Sulimenko et coll)
Pont luminal du γ-TuRC (actine, MZT1, MZT2)
Le γ-TuRC contient un pont luminal (lumenal bridge) formé d’un monomère d’actine et des protéines MZT1 et MZT2, indépendant des interfaces γ-tubuline/GCP qui assure :
- une rigidification globale du γ-TuRC, en constituant une poutre interne reliant plusieurs spokes,
- un maintien de la courbure optimale pour l’activation,
- une réduction des fluctuations internes,
- une augmentation de la productivité de nucléation en stabilisant l’état fermé du complexe.
1. L’actine occupe une position centrale au cœur du γ-TuRC, et bien qu'elle n’interagisse pas avec les dimères α/β, sa présence est indispensable au passage du γ-TuRC pour la nucléation en :
- rigidifiant la cavité interne et empêche l’ouverture excessive de l’anneau,
- en stabilisant la courbure nécessaire à l’arrangement asymétrique en 14 spokes et en conditionnant l’alignement des 13 sites nucléants fonctionnels en limitant la torsion interne du complexe.
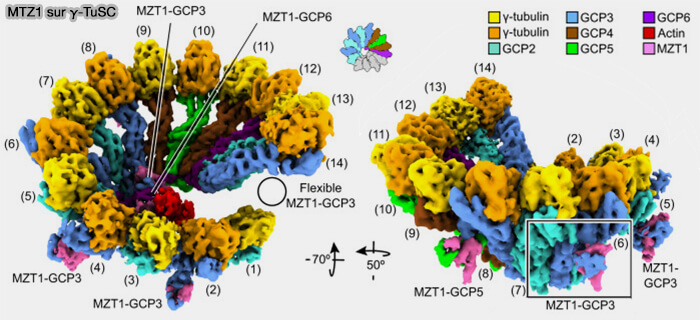
(Figure : vetopsy.fr d'après Würtz et coll)
2. MZT1 (MoZarT1), grâce à des surfaces hydrophobes, forme, avec les domaines GRIP/NHD de GCP3 et GCP6, le pont luminal hélicoïdal qui entoure l’actine au cœur du γ-TuRC (Modular assembly of the principal microtubule nucleator γ-TuRC 2022).
- Deux copies de MZT1 intégrées dans ce pont transmettent les contraintes mécaniques entre l’actine et les spokes GCP2/3,
- Des modules MZT1 supplémentaires sont présents sur la face externe du complexe.
- MZT1 participe indirectement à l’orientation correcte des γ-tubulines positionnées sur ces spokes.
3. MZT2A et MZT2B prolongent l’appui latéral fourni par MZT1 et les deux copies sont positionnés sur la face externe du γ-TuRC (MZT Proteins Form Multi-Faceted Structural Modules in the γ-Tubulin Ring Complex 2020).
- Elles stabilisent le segment du γ-TuRC en contact avec GCP4, GCP5 et GCP6.
- Elles servent également de plateforme secondaire pour le recrutement de NEDD1 (GCP-WD), facilitant l’ancrage du γ-TuRC au centrosome.
Cette organisation en deux modules distincts, i.e. MZT1 interne couplé à GCP2/3 et MZT2A/B externes associés à GCP4/5/6, conditionne leur rôle différentiel dans l’activation (
- MZT1 rigidifie la géométrie interne et transmet les contraintes nécessaires à la fermeture de l’anneau.
- MZT2 sert d’adaptateur externe pour CDK5RAP2/NEDD1 dans les différents MTOC.
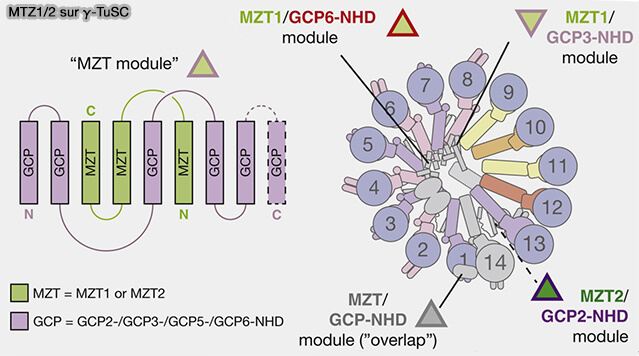
(Figure : vetopsy.fr d'après Wieczorek et coll)
Retour vers la nucléation
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


