Constituants cellulaires
Cytosquelette : microtubules
Nucléation centrosomale : maturation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La maturation du γ-TuRC combine recrutement, stabilisation péricentriolaire et activation structurale pour générer un complexe pleinement nucléant.
La maturation du γ-TuRC en complexe nucléant actif repose sur trois processus intégrés :
- son recrutement progressif dans la matrice péricentriolaire,
- son ancrage et sa stabilisation mécanique au sein du PCM,
- puis son activation allostérique et cycle-dépendante.
Recrutement du γ-TuRC au centrosome
Le recrutement du γ-TuRC suit une séquence temporelle :
- CEP192 assemble la couche interne du PCM et constitue le point d’entrée du module nucléant.
- CEP152 organise les couches externes et coordonne la maturation précoce avec Plk1, indispensable à l’expansion du PCM.
- PCNT (péricentrine) et CDK5RAP2 construisent l’armature fibreuse interne, créant des plateformes compatibles avec la fixation des facteurs de ciblage.
- NEDD1 (GCP-WD) assure le ciblage direct du γ-TuRC sur cette charpente et garantit son positionnement précis au voisinage des centrioles.
Cette séquence établit un micro-environnement péricentriolaire dense où le γ-TuRC peut être stabilisé puis activé.
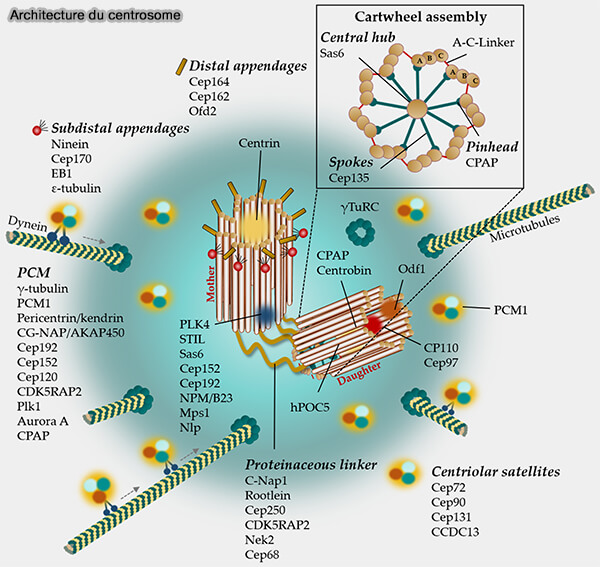
(Figure : vetopsy.fr d'après Bühler et Stolz)
Ancrage et stabilisation du γ-TuRC dans le PCM
1. L’insertion du γ-TuRC dans le réseau coiled-coil de PCNT (péricentrine) et les modules associés confèrent au complexe une stabilité mécanique indispensable à sa compétence de nucléation, imposant et verrouillant une géométrie plus proche de celle du microtubule à 13 protofilaments, ce qui lui permet d’accueillir les premiers dimères d'αβ-tubuline.
- La compression radiale exercée par la matrice referme la spirale latérale et empêche l’écartement spontané des spokes, en éliminant la tension latérale générée par le réseau coiled-coil.
- La stabilisation du seam, zone fragile de continuité imparfaite à géométrie pas parfaitement cyclique, renforce la cohésion globale de l’anneau.
La diminution de l’énergie élastique interne fait basculer le complexe dans un état mécaniquement stabilisé (low-energy state). - La rigidification de l'extrémité (-) verrouille la polarité et prépare la surface interne à l’engagement ordonné des premiers dimères α/β-tubuline.
2. L’ancrage centrosomal du γ-TuRC permet :
- une polarité strictement définie, les extrémités (-) étant positionnées au cœur du centrosome,
- la mise en place d’un réseau microtubulaire organisé et orienté,
- une production focalisée de microtubules répondant aux exigences mécaniques et de transport de la cellule,
- une activation renforcée en G2/M, favorisant la formation rapide d’asters mitotiques.
Transition structurale du γ-TuRC : état ouvert et état fermé
Le γ-TuRC adopte deux états structuraux distincts dont la transition conditionne sa capacité nucléante (Structure of the γ-tubulin ring complex-capped microtubule 2025) :
- une conformation ouverte, flexible et faiblement productive,
- une conformation fermée, rigide et pleinement compatible avec la géométrie d’un microtubule à 13 protofilaments.
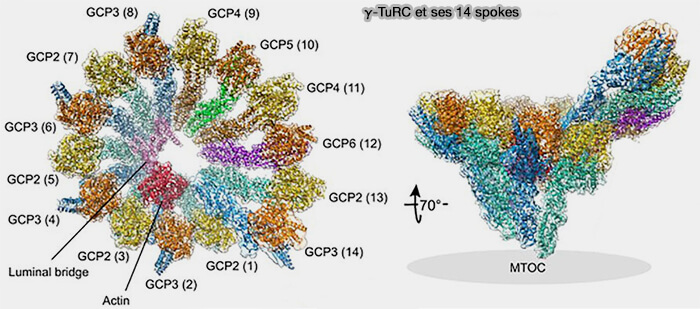
(Figure : vetopsy.fr d'après Sulimenko et coll)
1. L’état ouvert correspond à une organisation à 14 spokes, légèrement dilatée et latéralement flexible.
a. Les interfaces entre GCP canoniques (GCP2 et GCP3) et non canoniques (GCP4, GCP5 et GCP6) restent relâchées, empêchant la mise en registre correcte des γ-tubulines internes.
b. La surface générée est géométriquement incompatible avec l’engagement du premier dimère d'αβ-tubuline, ce qui rend cet état peu ou non nucléant :
- alignement imparfait des modules GCP2/GCP3,
- contacts latéraux faibles au niveau de GCP4/5/6,
- orientation interne des γ-tubulines non congruente avec les contacts longitudinaux du protofilament.
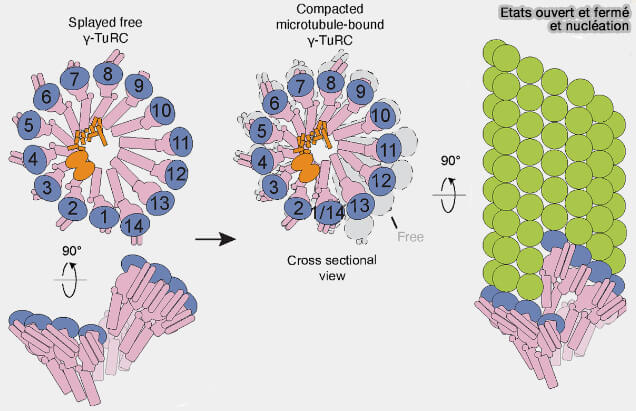
(Figure : vetopsy.fr d'après Aher et coll)
2. L’état fermé présente 13 positions parfaitement ajustées, reproduisant la géométrie d’un microtubule mature.
a. Les interfaces latérales sont rigidifiées, les GCP sont verrouillés, et les γ-tubulines internes affichent une orientation en registre fonctionnel avec l’α-tubuline du premier protofilament.
b. Cette conformation constitue un gabarit pré-nucléant énergétiquement favorable :
- symétrie interne en 13 segments actifs,
- réduction de la flexibilité latérale,
- stabilisation mécanique du seam qui agit comme un verrou géométrique empêchant la réouverture latérale de l’anneau, absorbe les contraintes résiduelles issues de la fermeture, et impose un registre unique aux γ-tubulines internes,
- alignement correct et simultanément compétent des positions nucléantes.
Activation du γ-TuRC
Cette activation peut faire intervenir plusieurs processus.
Module CM1 et cofacteurs MZT1/MZT2
1. Le domaine CM1 de CDK5RAP2 agit comme module allostérique capable d’imposer au γ-TuRC une géométrie productive proche de la configuration optimale à 13 spokes.
Il agit comme module allostérique, capable de verrouiller localement l’anneau en géométrie productive, proche de la configuration à 13 positions actives.
2. MZT1 et MZT2 stabilisent et amplifient l’action du CM1, assurant l’activation complète du γ-TuRC.
- MZT1, via le pont luminal MZT1-GCP3/GCP6 associé à l’actine, rigidifie la géométrie interne du γ-TuRC et contribue indirectement à la transition vers la conformation fermée (
pont luminal).
- MZT2 forme, sur la face externe du γ-TuRC, un module MZT2-GCP2-N-grip-CM1 qui sert d’adaptateur direct pour CDK5RAP2, permettant l’activation du γ-TuRC dans différents MTOC, y compris non centrosomaux.
3. La rigidification interne assurée par MZT1 et le verrou externe imposé par CM1 (relayé par MZT2) sont indispensables pour la transition de l’état ouvert vers l’état fermé du γ-TuRC, indispensable à la nucléation (
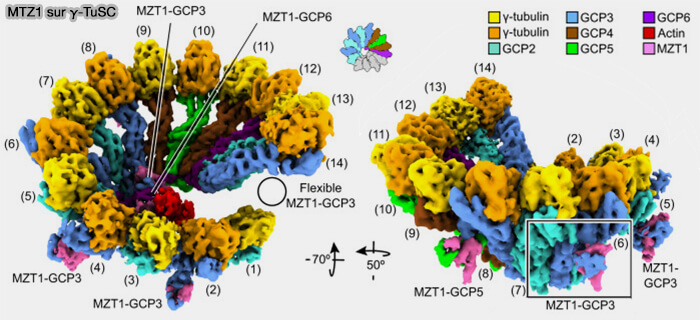
(Figure : vetopsy.fr d'après Würtz et coll)
Phosphorylation en G2/M
En G2/M, Plk1, Aurora A et le complexe cycline B/CDK1 (MPF) orchestrent une série de phosphorylations qui renforcent l’état nucléant du γ-TuRC (Plk1 phosphorylation of pericentrin initiates centrosome maturation at the onset of mitosis 2011).
- La phosphorylation des protéines d'échafaudage du matériel péricentriolaire (PCM), i.e. PCNT, CDK5RAP2, CEP192 induit une expansion de la matrice péricentriolaire, augmentant l’accessibilité et le nombre de γ-TuRC recrutés.
- La phosphorylation des zones d’interaction du γ-TuRC, en particulier GCP6 et certaines régions régulatrices de GCP5 et GCP4, rigidifie les contacts latéraux entre GCP non canoniques et stabilise la géométrie fermée.
- La phosphorylation des facteurs d’ancrage et d’activation, i.e. NEDD1 et CDK5RAP2, renforce leur affinité pour l’anneau, stabilise les interfaces activatrices et accélère sa conversion vers l’état productif.
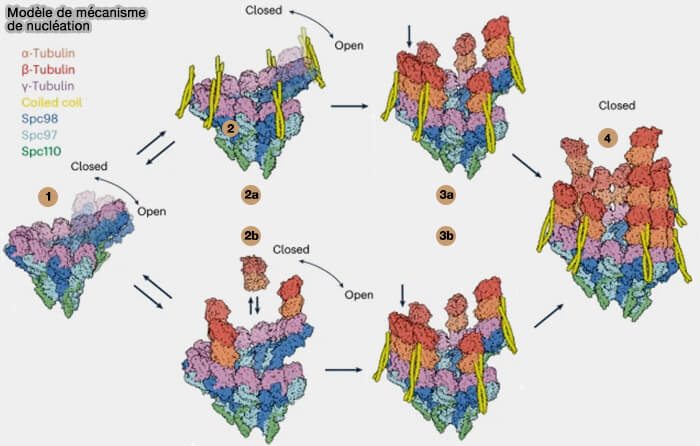
Engagement des dimères α/β-tubuline dans le γ-TuRC
L’introduction des dimères d'αβ-tubuline constitue la première étape structurale de la nucléation, immédiatement après la transition du γ-TuRC vers l’état fermé (Structural mechanisms for centrosomal recruitment and organization of the microtubule nucleator γ-TuRC 2025).
(Figure : vetopsy.fr d'après Dendooven et coll)
Le complexe fournit une géométrie préformée à 13 positions, dont la surface interne aligne les γ-tubulines de GCP2 et GCP3 dans une configuration GTP-like compatible avec la polymérisation.

Le modèle présenté est le modèle le plus accepté actuellement, mais non confirmé.
1. Chaque γ-tubuline positionnée dans un spoke GCP2/GCP3 imite la géométrie du dimère α/β et constitue un gabarit pré-aligné qui réduit l’énergie nécessaire à la nucléation.
a. Cette géométrie permet :
- la reconnaissance du dimère α/β-tubuline libre,
- un contact longitudinal γ/α qui stabilise la première tubuline α,
- un alignement latéral favorable à l’insertion de la tubuline β adjacente.
b. Lors des premières étapes de nucléation, les contacts latéraux sont transitoires et coopératifs.
Ils peuvent impliquer des interfaces hétérotypiques α-β entre dimères adjacents en cours d’engagement, avant que le B-lattice, caractérisé par des interactions latérales α/α et β/β, ne soit pleinement verrouillé (The transition state and regulation of γ-TuRC-mediated microtubule nucleation revealed by single molecule microscopy 2020).
2. À mesure que les premiers dimères α/β sont engagés :
- le spoke correspondant se rigidifie progressivement,
- la face interne du γ-TuRC stabilise plusieurs contacts longitudinaux successifs γ/αβ,
- l’association coopérative de ces premiers dimères génère un segment longitudinal initial, constituant un protofilament naissant transitoirement stabilisé, suffisant pour amorcer l’élongation du microtubule vers l’extérieur.
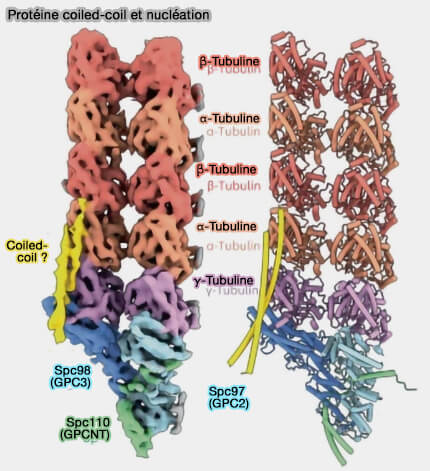
Remarque : chez la levure, une protéine coiled-coil, qui serait probablement Stu2 (XMAP215/TOG family), interagit simultanément avec Spc98 (GPC3), la γ-tubuline, et l'α/β-tubuline (Structure of the native γ-tubulin ring complex capping spindle microtubules 2024).
Son rôle principal est d’agir comme facteur d’amorçage et de stabilisation des premiers dimères α/β, en renforçant les contacts longitudinaux γ/α et en favorisant l’engagement coopératif des tubulines sur le gabarit du γ-TuRC.
(Figure : vetopsy.fr d'après Dendooven et coll)
3. La conformation fermée du γ-TuRC est essentielle en :
- empêchant la dispersion latérale des premiers dimères,
- maintenant la symétrie circulaire nécessaire pour que les 13 protofilaments émergent avec un pas identique,
- verrouillant l’orientation (-) à l’intérieur du PCM et laissant l’extrémité (+) libre pour l’élongation.
4. Toutefois, l’état fermé du γ-TuRC associé aux premiers dimères ne suffit pas à garantir une nucléation productive.
Le matériel péricentriolaire (PCM), par sulte de l’enchevêtrement coiled-coil PCNT-CDK5RAP2-CEP192, fournit des contraintes mécaniques supplémentaires :
- une compression radiale qui stabilise ce micro-noyau,
- une résonance mécanique faible-énergie (low-energy state),
- une réduction des fluctuations permettant à plusieurs dimères consécutifs de s’ajouter sans dissociation.
Retour aux microtubules
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


