Constituants cellulaires
Cytosquelette : microtubules
Nucléation non centrosomale : mécanismes généraux
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La nucléation non centrosomale repose sur des mécanismes coordonnés, impliquant les kinétochores, le gradient Ran-GTP/TPX2 et le complexe augmine, qui initient et amplifient les microtubules indépendamment du centrosome.
Vue d'ensemble de la nucléation non centrosomale
La nucléation non centrosomale désigne l’ensemble des mécanismes permettant la formation de microtubules en dehors du centrosome.
1. Elle joue un rôle déterminant dans :
- les cellules polarisées,
- les neurones (Centrosomal and acentrosomal microtubule nucleation during neuronal development 2025).
- les épithéliums,
- les ovocytes,
- pendant la mitose, lorsque la cellule doit organiser un fuseau acentrosomal.
2. Contrairement à la nucléation classique organisée par le γ-TuRC centré sur le MTOC centrosomal, ces processus reposent sur des plateformes latérales, des organisateurs membranaires ou des facteurs diffusibles qui orchestrent la construction locale du réseau.
En s’appuyant sur des plateformes spécialisées comme l'appareil de Golgi, le cortex cellulaire, les chromosomes ou les microtubules eux-mêmes, elle permet de modeler des réseaux adaptés :
- à la polarité cellulaire,
- au mouvement, cils et flagelles,
- à la division cellulaire,
- à la fonction neuronale.

(Figure : vetopsy.fr d'après Kraus et coll)
3. La cellule utilise plusieurs mécanismes de nucléation, mais ils ne sont pas équivalents et s’organisent selon une hiérarchie fonctionnelle qui dépend du type cellulaire, du cycle et du degré de polarité.
a. Le premier niveau est la nucléation centrosomale, mode principal en interphase et en mitose qui :
- fournit la densité maximale de microtubules,
- impose une polarité radiale stricte,indispensable au transport directionnel,
- rend possible la formation d’asters mitotiques et du fuseau bipolaire.
b. La cellule combine plusieurs modes non centrosomaux simultanément, mais en change la hiérarchie selon le contexte (division, migration, polarité, différenciation).
Nucléations lors du cycle cellulaire
Nucléation dépendante des kinétochores
Les kinétochores constituent un site majeur de nucléation acentrosomale en mitose, contribuant directement à l’établissement et au maintien du fuseau mitotique.
1. Les kinétochores recrutent de manière transitoire :
- les complexes γ-TuRC via NEDD1,
- TPX2 et HURP,
- XMAP215/ch-TOG.
Ce recrutement permet la formation de microtubules orientés vers l’extérieur depuis la surface du kinétochore et ces microtubules naissants peuvent ensuite :
- être capturés par les centrosomes (mécanisme « search-and-capture » amélioré),
- ou s’auto-organiser pour contribuer à la structure bipolaire du fuseau.
2. Ce mode de nucléation :
- stabilise l’attachement des microtubules kinétochoriens,
- augmente la densité microtubulaire autour des chromosomes,
- compense les déficits de nucléation centrosomale,
- contribue à la robustesse de la capture des kinétochores.
Nucléation indispensable pour un fuseau fonctionnel
Nucléation assistée par TPX2 et le gradient Ran-GTP
En mitose, un mode majeur de nucléation acentrosomale dépend du gradient Ran-GTP formé autour des chromosomes et de l’action de TPX2, qui initie localement l’assemblage microtubulaire indépendamment du centrosome.
1. TPX2 agit comme facteur nucléateur et amplificateur en :
- capturant et stabilisant les dimères d'αβ-tubuline, ce qui abaisse la barrière d’initiation,
- recrutant XMAP215/ch-TOG, principal catalyseur d’élongation,
- favorisant l’émergence de microtubules en périphérie chromosomique, zone où le gradient Ran-GTP libère TPX2 de son inhibition par importine-α/β.
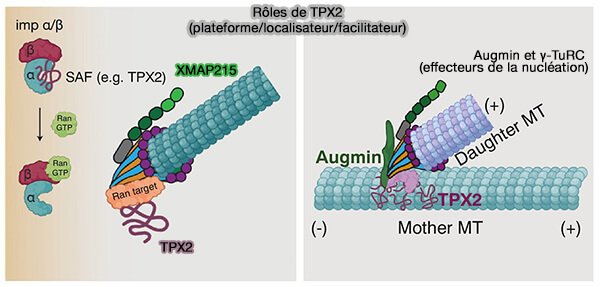
(Figure : vetopsy.fr d'après Kraus et coll)
2. La nucléation Ran-GTP/TPX2 :
- assure la formation du fuseau mitotique dans les cellules dépourvues de centrosome comme les ovocytes ou les cellules végétales,
- maintient la bipolarité du fuseau même lorsque les centrosomes sont inactifs, absents ou insuffisamment matures,
- complète la nucléation centrosomale et renforce la densité microtubulaire autour des chromosomes, condition essentielle à la capture des kinétochores et à l’assemblage mitotique.

Une double remarque s'impose.
Première remarque : PX2 apparaît dans deux contextes distincts au sein du chapitre :
- au niveau des kinétochores, comme facteur recruté localement parmi d’autres, contribuant à la nucléation et à la stabilisation initiale des microtubules.
- autour des chromosomes, comme acteur central d’un mécanisme autonome de nucléation dépendant du gradient Ran-GTP.
Cette double apparition reflète la polyvalence fonctionnelle de TPX2, et la dissociation spatiale entre une activité kinétochore-associée et une activité chromosomique diffuse.
Deuxième remarque : XMAP215/ch-TOG intervient dans plusieurs modes de nucléation acentrosomale au sein du fuseau.
- Il est recruté à la fois au niveau des kinétochores et dans les régions chromosomiques dépendantes du gradient Ran-GTP, où il agit comme catalyseur universel de l’élongation des microtubules nouvellement initiés.
- Cette présence répétée reflète son rôle transversal d’amplificateur de la croissance microtubulaire, indépendamment du site de nucléation.
Nucléation par amplification latérale (complexe augmine)
Le complexe augmine constitue un mécanisme central de nucléation non centrosomale interne au réseau microtubulaire mitotique (Molecular architecture of the augmin complex 2022).
Il ne crée pas de microtubules de novo à partir d’un site fixe mais amplifie localement un réseau existant, en augmentant rapidement la densité et la connectivité des fibres.
Structure du complexe
Le complexe augmine est organisé en deux sous-complexes fonctionnels stables, i.e. tII et TIII (The augmin complex architecture reveals structural insights into microtubule branching 2022).
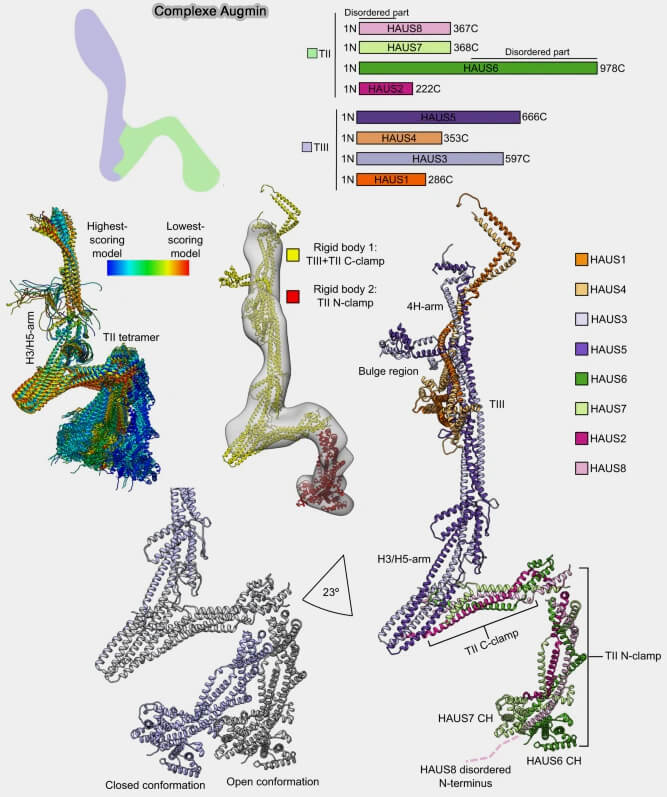
(Figure : vetopsy.fr d'après Zupa et coll)
1. Le sous-complexe TII regroupe principalement les sous-unités HAUS2, HAUS6, HAUS7 et HAUS8 et assure la liaison latérale aux microtubules existants.
a. II adopte une architecture allongée et flexible, optimisée pour une interaction latérale avec la paroi du microtubule parent, indépendamment de l’extrémité (+) ou (-).
Cette liaison latérale stabilise localement l'augmine sur le réseau existant et définit le site spatial de la nucléation secondaire, servant de point d’appui mécanique et topologique pour l’assemblage du sous-complexe TIII et le recrutement ultérieur du γ-TuRC.
b. Ainsi, TII assure la sélectivité topologique de la nucléation par ramification, en couplant la position du microtubule fils à l’orientation et à la géométrie du microtubule parent.
Remarque : le module TII adopterait au moins deux principales conformations, qualifiées d’ouverte et de fermée, qui diffèrent par l’angle d’ouverture du " clamp " TII d’environ 23°.
Ces conformations reflètent la flexibilité intrinsèque du site de liaison aux microtubules, où l’ouverture/fermeture du clamp TII module la géométrie d’interaction avec le microtubule parent et potentiellement l’orientation du γ-TuRC recruté par TIII, contribuant ainsi à l’adaptation spatiale de la nucléation par ramification.
2. Le sous-complexe TIII, composé de HAUS1, HAUS3, HAUS4 et HAUS5, forme un assemblage compact et relativement rigide, distinct du module TII, spécialisé dans les interactions protéine-protéine plutôt que dans la liaison directe aux microtubules.
TIII établit l’interface fonctionnelle avec le γ-TuRC, principalement via l’adaptateur NEDD1, permettant l’ancrage du complexe nucléateur au site défini par TII sur le microtubule parent.
Remarque : dans certains contextes mitotiques, notamment lorsque la nucléation par ramification (nucléation MT-based MT) est fortement sollicitée ou lorsque l’accessibilité du réseau microtubulaire est contrainte, des MAP adaptatrices comme EML3 peuvent fournir des plateformes alternatives de recrutement de l’augmine (The microtubule-associated protein EML3 regulates mitotic spindle assembly by recruiting the Augmin complex to spindle microtubules 2019).
Des facteurs comme TPX2 conditionnent indirectement l’efficacité de ce processus en augmentant la densité du substrat microtubulaire disponible.
Rôle dans la ramification de la nucléation
Le découplage structurel entre un module de positionnement (TII) et un module de nucléation (TIII) confère à l'augmine sa capacité à orchestrer une nucléation par ramification spatialement contrôlée et orientée.
1. Le complexe augmine agit comme un pont fonctionnel entre des microtubules préexistants et le γ-TuRC, correspondant à une nucléation par ramification (branching nucleation) distincte de la nucléation centrosomale radiale .

Vous pouvez lire : Structural insights into how augmin augments the mitotic spindle (2023), qui émet certaines critiques sur le modèle.
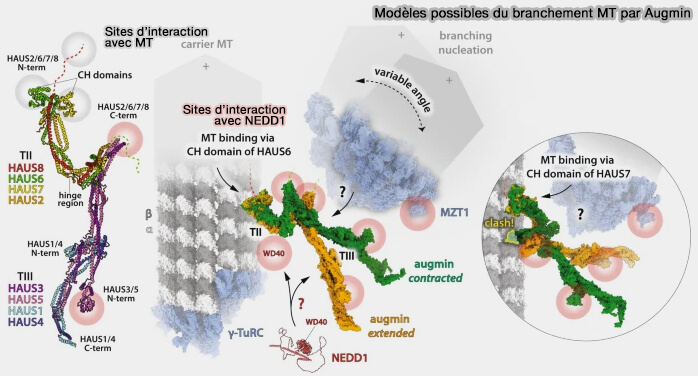
(Figure : vetopsy.fr d'après Manka)
2. La nucléation assistée par l'augmine permet au fuseau de devenir un réseau auto-renforcé, capable de maintenir sa structure malgré les forces mécaniques élevées de la métaphase :
- en augmentant rapidement la densité microtubulaire, indépendamment du nombre de centrosomes,
- en renforçant les microtubules interpolaires, essentiels à la cohésion et à la bipolarité du fuseau,
- en homogénéisant l’architecture du fuseau et en évitant une organisation exclusivement radiale centrée sur les pôles.
3. L'augmine ne remplace aucun autre mode de nucléation, mais agit en synergie avec :
- la nucléation centrosomale, qu’elle amplifie à distance du pôle,
- la nucléation chromosomique Ran-GTP/TPX2, qu’elle propage le long des microtubules nouvellement formés (Structural analysis of the role of TPX2 in branching microtubule nucleation 2017),
- la nucléation kinétochore-dépendante, qu’elle densifie localement autour des fibres en cours de stabilisation.
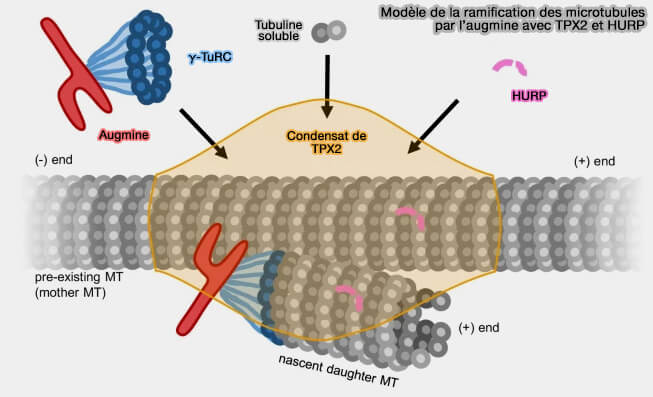
(Figure : vetopsy.fr d'après Valdez et coll)
a. Les données expérimentales montrent que l’inhibition de l'augmine entraîne :
- une diminution marquée de la densité microtubulaire du fuseau,
- un appauvrissement des microtubules interpolaires,
- des défauts de symétrie et de stabilité du fuseau,
- une augmentation des erreurs de ségrégation chromosomique.
b. Ces phénotypes ne sont pas compensés par une augmentation de l’activité centrosomale, soulignant le caractère redondant mais non substituable de l’augmine.
4. L'augmine constitue un pilier canonique de la nucléation non centrosomale et doit être considérée comme :
- un amplificateur interne du réseau mitotique,
- un mécanisme de nucléation dépendant des microtubules eux-mêmes,
- un élément clé de la transition entre un fuseau initié localement et un fuseau dense, robuste et fonctionnel.
Nucléation non centrosomale : modes spécialisés et contextuels
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


