Constituants cellulaires
Cytosquelette : microtubules
MAP : protéines associées aux microtubules
MAP déstabilisatrices
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les MAP déstabilisatrices modulent la dynamique des microtubules en induisant la courbure des protofilaments, en augmentant la fréquence des catastrophes et en favorisant la dépolymérisation ou la fragmentation contrôlée du polymère.
MAP déstabilisatrices
Les MAP associent des domaines structurés de liaison à la tubuline et des régions flexibles modulant leur affinité et leur action sur le polymère.
1. Cette organisation leur permet de maintenir la paroi microtubulaire dans un état stable malgré les fluctuations mécaniques.
- Les régions intrinsèquement désordonnées assurent une interaction multipoint amortissant les contraintes latérales.
- Les modules structurés reconnaissent des surfaces spécifiques du dimère d'αβ-tubuline, en particulier aux extrémités ou dans des segments fragilisés.
2. Cette organisation modulaire associant régions structurées et flexibles induit la courbure des protofilaments, désynchronise localement le lattice et favorise l’initiation des catastrophes, assurant une déstabilisation contrôlée du polymère en conditions dynamiques.
3. Les MAP déstabilisatrices ne reposent pas sur un mécanisme unique, mais sur des stratégies complémentaires de fragilisation du polymère microtubulaire, adaptées à des contextes cellulaires distincts.
- Certaines MAP, comme les kinésines de la famille kinésine-13, induisent une dépolymérisation terminale en stabilisant des conformations courbées des protofilaments aux extrémités des microtubules, favorisant la perte rapide des dimères α/β-tubuline sans sectionner le lattice.
- D’autres MAP, telles que la stathmine, agissent principalement en séquestrant les dimères de tubuline libre et en déstabilisant les extrémités microtubulaires, réduisant la probabilité de croissance et augmentant la fréquence des catastrophes dans des réseaux hautement dynamiques.
- Enfin, les enzymes AAA+ de coupure des microtubules (katanine, spastine et spastine) sectionnement déstabilisent le réseau par un clivage mécanique du lattice, générant de nouvelles extrémités susceptibles de se dépolymériser secondairement.
Famille kinésine-13 (exemple de KIF2C/MCAK)
Les kinésines-13 déclenchent la dépolymérisation en reconnaissant et en stabilisant des conformations courbées des protofilaments, caractéristiques des extrémités microtubulaires dépolymérisantes (Ternary complex of Kif2A-bound tandem tubulin heterodimers represents a kinesin-13-mediated microtubule depolymerization reaction intermediate 2018).
Les kinésines-13 participent à la correction fine des erreurs d’attachement au kinétochore en éliminant sélectivement les microtubules engagés dans des configurations incorrectes, par une dépolymérisation localisée aux extrémités.
1. Elles sont recrutées préférentiellement aux extrémités des microtubules soumis à des contraintes anormales, typiquement associées à des attachements syntéliques ou mérotéliques (Molecular insight into the regulation and function of MCAK 2016).
- En stabilisant ces états conformationnels incompatibles avec l’alignement longitudinal du lattice, elles empêchent la réorganisation des interfaces α/β-tubuline et abaissent la barrière énergétique de la dépolymérisation.
- Le microtubule bascule ainsi vers un état de catastrophe, permettant un remodelage local efficace du réseau.
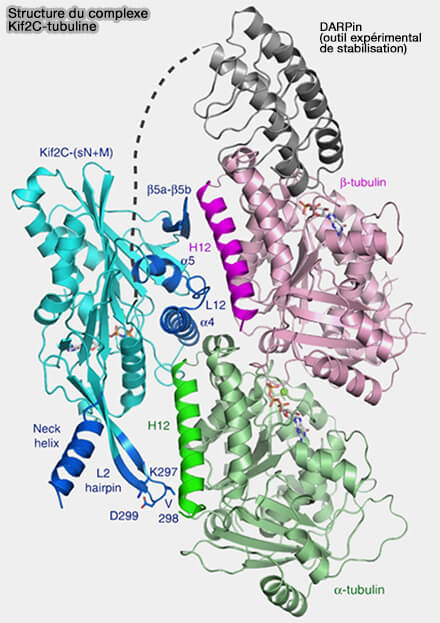
(Figure : vetopsy.fr d'après Wang et coll)
2. La spécificité des kinésines-13 pour les extrémités dépolymérisantes repose sur la reconnaissance de la géométrie courbée des dimères α/β-tubuline, typique des protofilaments en cours de dépolymérisation, et non sur une simple reconnaissance de séquence.

L'essentiel de ce chapitre est tiré de l'excellent article : Insight into microtubule disassembly by kinesin-13s from the structure of Kif2C bound to tubulin (2017).
Dans cette conformation, les interfaces longitudinales entre dimères sont partiellement ouvertes, exposant des surfaces normalement masquées dans le lattice droit.
- La tubuline adopte alors une géométrie non colinéaire, avec une rotation et un décalage relatifs de ses sous-domaines globulaires, rompant l’alignement rectiligne caractéristique du polymère stable.
- Cette réorganisation géométrique entraîne une redistribution des reliefs et des cavités de surface, ainsi qu’un réarrangement local des charges électrostatiques, produisant une configuration spatiale absente dans l’état polymérisé stable.
- Dans la structure Kif2C-tubuline, cette conformation correspond à un état GDP-tubuline présentant une déviation angulaire mesurée d’environ 14,7°, illustrant un cas de courbure fortement dépolymérisante, plus prononcé que celui observé avec d’autres MAP et compatible avec une activité de dépolymérisation active.
3. Le domaine moteur des kinésines-13 présente une surface de contact adaptée à cette géométrie incurvée, permettant une interaction stable uniquement lorsque le dimère adopte cette conformation.
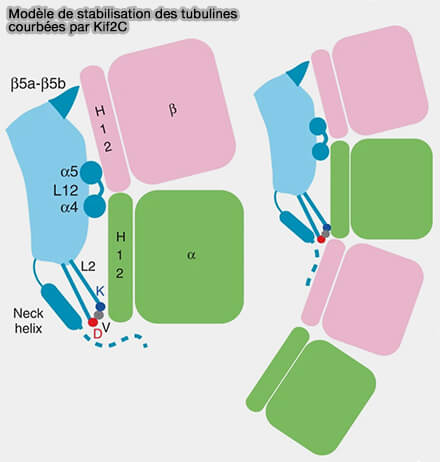
(Figure : vetopsy.fr d'après Wang et coll)
a. Cette reconnaissance repose en particulier sur des éléments structuraux spécifiques du domaine moteur des kinésines-13.
- La liaison à la tubuline courbée s’accompagne d’une rotation significative (∼25°) du motif α4-L12-α5, qui réoriente la surface de contact du moteur pour épouser la géométrie incurvée du dimère.
- La boucle L2, enrichie en motifs conservés propres aux kinésines-13 (notamment le motif KVD), cible des surfaces spécifiques de la tubuline GDP et contribue au verrouillage de cette conformation courbée.
b. Cette interaction, défavorable dans le lattice droit, devient énergétiquement favorable lorsque la courbure des protofilaments relâche les contraintes longitudinales du polymère, expliquant la préférence stricte des kinésines-13 pour les extrémités dépolymérisantes.
4. Une fois liée à l’extrémité du microtubule, la kinésine-13 stabilise activement la conformation courbée des protofilaments en s’opposant à leur réalignement longitudinal.
a. Son domaine moteur agit comme un verrou conformationnel, maintenant les dimère d'αβ-tubuline dans une géométrie incurvée incompatible avec l’état rectiligne requis pour l’intégration dans le lattice.
b. La tubuline ainsi contrainte ne peut ni se réinsérer dans le polymère existant, ni être réincorporée lors d’une tentative de sauvetage, ce qui exclut " re-capture " du protofilament par le lattice.
- Cette stabilisation est assurée par l’engagement coordonné de la boucle L2 et du segment α4-L12-α5, qui agissent comme un verrou conformationnel maintenant les dimères α/β-tubuline dans une géométrie incurvée.
- Cette géométrie est caractéristique de la tubuline à l’état GDP et est incompatible avec l’alignement rectiligne du lattice polymérisé.
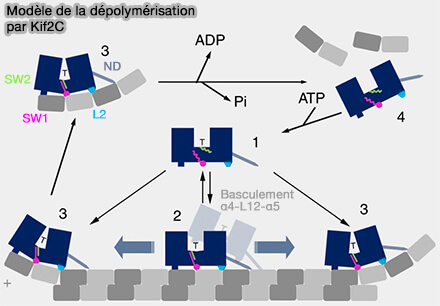
(Figure : vetopsy.fr d'après Benoit et coll)
5. Contrairement aux kinésines motrices, l’hydrolyse de l'ATP n’est pas utilisée pour un mouvement directionnel, mais en travail mécanique local appliqué à la tubuline, permettant une dépolymérisation rapide, orientée et strictement confinée aux extrémités des microtubules (Cryo-EM reveals the structural basis of microtubule depolymerization by kinesin-13s 2018).
a. La transition ATP → ADP-Pi s’accompagne d’un réarrangement interne du domaine moteur qui :
- maintient la tubuline dans un état courbé tout en fragilisant davantage les interfaces longitudinales restantes avec le polymère,
- isole mécaniquement le dimère du protofilament.
b. Après rupture complète des contacts longitudinaux, la dissociation de l’ADP diminue l’affinité de la kinésine-13 pour la tubuline libre, permettant la libération du dimère α/β-tubuline extrait et la réinitialisation du site de liaison.

Chaque cycle ATPasique favorise l’extraction successive d'un dimère α/β-tubuline à partir de l’extrémité, amplifiant la dépolymérisation.
6. Ce mécanisme décrit l’action intrinsèque de la kinésine-13 à l’extrémité du microtubule et sa localisation et son activité sont toutefois finement régulées par d’autres facteurs cellulaires, notamment :
- des plateformes de recrutement, telles que les kinétochores, i.e. Ndc80, KNL1, complexes KMN, ou les pôles du fuseau, i.e. NuMA, dynéine/dynactine,
- des contraintes mécaniques locales liées à la tension exercée sur les microtubules,
- des signaux de phosphorylation dépendants du cycle cellulaire, impliquant en particulier les kinases Aurora B, Plk1 et CDK1.
Stathmine/Op18
La stathmine/Op18 est une MAP déstabilisatrice qui module la dynamique des microtubules, lorsque la cellule doit remodeler rapidement son réseau :
- en agissant principalement sur la séquestration des dimères d'αβ-tubuline,
- et, dans certaines conditions, par une interaction directe avec les extrémités microtubulaires, favorisant la transition en catastrophe.
Séquestration des dimères α/β-tubuline
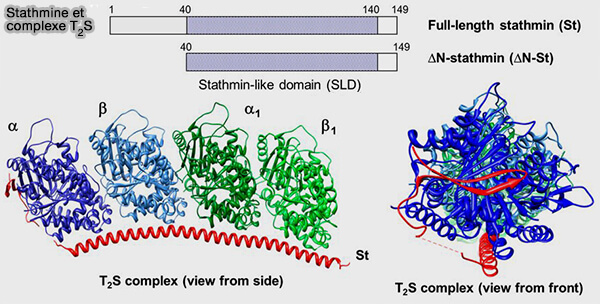
(Figure : vetopsy.fr d'après Gupta et coll)
1. La stathmine possède un domaine stathmin-like (SLD), très flexible, capable de se lier simultanément à deux dimères α/β-tubuline, formant un complexe ternaire dit " T2S ", i.e. stathmine + 2 αβ-tubulines (Mechanism for the catastrophe-promoting activity of the microtubule destabilizer Op18/stathmin 2013).
- Cette interaction masque des surfaces du dimère nécessaires aux contacts longitudinaux et latéraux, empêchant son incorporation dans le lattice microtubulaire (Op18/Stathmin Mediates Multiple Region-Specific Tubulin and Microtubule-Regulating Activities 1999).
- La formation du complexe T2S réduit ainsi la concentration effective de tubuline libre, ce qui ralentit l’alimentation des extrémités en croissance.
Certains motifs de la SLD sont essentiels pour l’interaction (Model for stathmin/OP18 binding to tubulin 2000).
2. Sur le plan dynamique, cette diminution du pool de tubuline disponible :
- abaisse la vitesse de polymérisation,
- fragilise la coiffe GTP,
- augmente indirectement la probabilité de catastrophe, sans action directe sur le lattice déjà polymérisé.
Interaction directe avec les extrémités microtubulaires
La stathmine pourrait ne pas se limiter à la séquestration des dimères, mais interagir avec des protofilaments exposés, en particulier dans des configurations riches en tubuline courbée, analogues à celles observées aux extrémités en cours de dépolymérisation (Mechanism for the catastrophe-promoting activity of the microtubule destabilizer Op18/stathmin 2013).
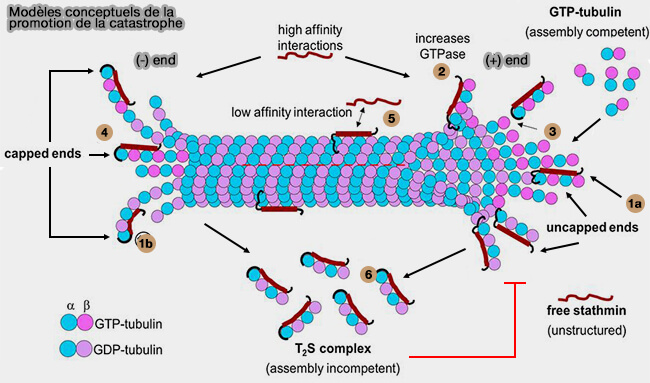
(Figure : vetopsy.fr d'après Gupta et coll)
1. La liaison de la stathmine sur les protofilaments pourrait :
- inhiber des interactions latérales entre protofilaments via un effet stérique (1a) ou en induisant une courbure accrue (1b), ce qui affaiblit l’extrémité,
- augmenter l’activité GTPase des sous-unités tubuline auxquelles la stathmine est liée (2), réduisant la taille de la coiffe GTP protectrice.
- bloquer l’ajout de nouveaux dimères aux extrémités, par liaison du peptide N-terminal de stathmine à la surface α-tubuline exposée.
2. Ce dernier point est important car il peut expliquer une préférence d’action aux extrémités (-), moins protégées par une coiffe de GTP, et place la stathmine au même plan que d’autres effecteurs de catastrophe qui reconnaissent des conformations tubulaires spécifiques.
Conclusion : les simulations couplées aux données expérimentales indiquent que les deux activités de la stathmine, séquestration des dimères α/β-tubuline et interaction directe avec les extrémités microtubulaires, contribuent de manière significative à la promotion de la catastrophe en conditions physiologiques.
L’importance relative de ces mécanismes dépend du contexte cellulaire, notamment de la concentration en tubuline libre, de l’environnement physico-chimique ou de l’état dynamique du réseau.
La stathmine/Op18 agit comme un modulateur global de la dynamique microtubulaire, combinant un contrôle du pool de tubuline disponible et, selon les conditions, une action directe favorisant les transitions en catastrophe, sans agir comme une dépolymérase dédiée des extrémités microtubulaires.
Enzymes de coupure AAA+ (katanine, spastine, fidgetine)
Les enzymes de coupure AAA+, i.e. katanine, spastine, fidgetine, fragmentent les microtubules en segments courts aptes à être réassemblés ou éliminés.
1. Elles contribuent aux remaniements rapides nécessaires aux transitions cellulaires.
- La coupure ATP-dépendante génère de nouvelles extrémités réactives, favorisant la repolyérisation ou la réorganisation locale.
- La production de fragments courts facilite ainsi les ajustements rapides de la géométrie du réseau.
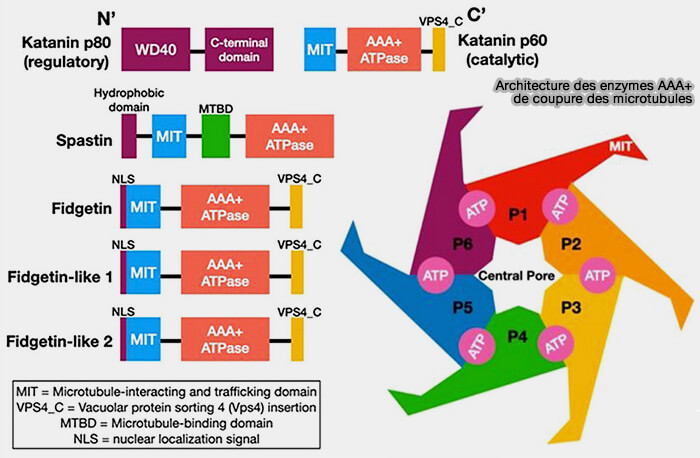
(Figure : vetopsy.fr d'après Smart et Sharp)
2. Ces ATPases AAA+ Ces ATPases AAA+ confèrent au cytosquelette une plasticité structurelle essentielle, complémentaire des mécanismes de stabilisation et de dépolymérisation contrôlée.
Autres MAP
Les autres classes de MAP sont :
- les MAP stabilisatrices,
- les MAP organisatrices,
- les MAP d'extrémité (+),
- les MAP d'extrémité (-).
Retour aux microtubules
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesTubulineDynamique des MicrotubulesNucléationFissionMAPCentrioleCentrosomeFuseau mitotiqueReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


