Ligases Cullin-RING (CRL)
Complexe SCF (Skp1/Culline/F-box)
Rôles dans le cycle cellulaire
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le SCF contrôle l’entrée en phase S en éliminant les inhibiteurs de CDK, en modulant les facteurs réplicatifs et en s’articulant avec APC/CCdc20 puis APC/CCdh1 pour ordonner la progression du cycle.
Rôle dans la régulation du cycle cellulaire
Le complexe SCF constitue l’un des principaux régulateurs de la transition G1 ➞ S et du maintien de l’ordre cyclique des événements pré-réplicatifs.
Son activité dépend étroitement de la phosphorylation préalable des substrats par les complexes cycline/CDK, ce qui couple directement l’ubiquitination à l’état cinétique du cycle.
Contrôle de la transition G1/S
1. En fin de G1, l’augmentation d’activité des complexes cycline E/CDK2 et cycline A/CDK2 génère les phospho-dégrons requis pour le recrutement des CKI par SCFSkp2.
Cette étape régule :
- la dégradation de p27Kip1 et p21Cip1,
- la levée du frein CKI,
- l’accélération de l’entrée en phase S.
2. La transition G1/S dépend aussi de l’état du complexe APC/CCdh1 qui reste actif en début de G1 et doit être inactivé pour permettre l’accumulation de Skp2.
La phosphorylation de Cdh1 par les CDK et l’apparition progressive de Skp2 créent un basculement irréversible vers la phase S.
Prévention du re-licensing des origines
Le complexe pré-réplicatif (pré-RC) correspond à l’assemblage formé en G1 sur chaque origine de réplication, où il prépare l’ADN à l’initiation en recrutant successivement ORC, CDC6, CDT1 et l’hélicase MCM2-7.
Une fois la réplication engagée en phase S, ces origines doivent rester inactives jusqu’au cycle suivant afin de garantir une duplication strictement mono-cyclique du génome.
Le re-licensing désigne la réactivation anormale d’une origine déjà utilisée, conduisant à la re-formation de pré-RC au sein de la même phase S.
Cette réouverture inappropriée des origines entraîne des répliques multiples d’un même segment d’ADN et constitue une source majeure d’instabilité génomique.
1. En phase S, le SCF contribue à maintenir l’unicité de la réplication en ciblant des composants du pré-RC :
- CDC6, dont la dégradation empêche la re-formation de pré-RC,
- coordination avec CRL4-DDB1 pour l’élimination de CDT1.
2. L’inactivation résiduelle d'APC/CCdh1 en S assure que les facteurs nécessaires à l’initiation ne soient pas éliminés prématurément, tandis que le SCF empêche qu’ils persistent au-delà de leur fenêtre d’utilisation.
Coordination avec les signaux mitogéniques
1. Des modules tels que SCFβ-TrCP intègrent les signaux provenant :
- des voies mitogéniques (PI3K/AKT, ERK),
- des voies inflammatoires (NF-κB),
- des signaux dépendant de GSK3β.
2. La dégradation d'IκBα, de β-caténine phosphorylée ou de régulateurs transcriptionnels permet d’ajuster la progression du cycle en fonction du contexte extracellulaire.
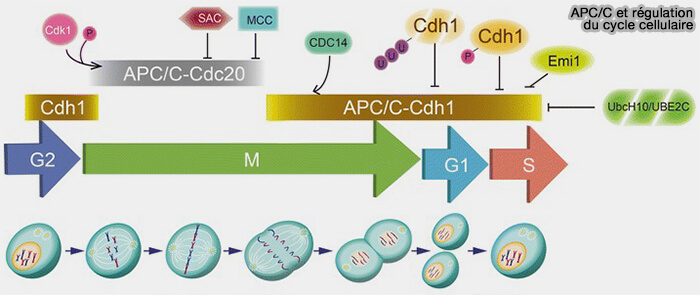
Articulation dynamique entre SCF, Cdc20 et Cdh1
1. La succession ordonnée des phases du cycle repose sur une alternance fonctionnelle entre les deux grandes ligases, SCF et APC/C, étroitement couplée à l’activité des complexes cycline/CDK.
a. En prophase, l’activité croissante de la cycline B/CDK1 domine l’entrée en mitose.
- APC/CCdh1 est inactivé par phosphorylation, tandis que APC/CCdc20 reste encore silencieux sous contrôle du SAC (Spindle Assembly Checkpoint).
- Le SCF demeure actif mais secondaire, assurant l’élimination résiduelle de régulateurs de G1/S.
b. En métaphase-anaphase, APC/CCdc20 devient la ligase dominante et déclenche la dégradation des cohésines et des cyclines B.
c. En sortie de mitose et G1 précoce, APC/CCdh1 prend le relais et élimine de nombreux facteurs pro-prolifératifs, dont Skp2,
- stabilisant le G1,
- empêchant un réengagement prématuré du cycle.
d. En fin de G1 puis en S, la répression progressive de Cdh1 par les CDK permet l’accumulation de Skp2 et l’activation pleine du SCF, qui devient alors la ligase dominante pour :
- la dégradation des CKI (inhibiteurs de CDK), ce qui lève définitivement le frein sur l’activité CDK (Cyclin-Dependent Kinase) et stabilise l’engagement en phase S,
- le contrôle du licensing réplicatif,
- la modulation de plusieurs régulateurs des phases S et G2, garantissant la progression continue du programme réplicatif et la préparation de l’entrée en mitose.
2. Cette alternance séquentielle, i.e. APC/CCdc20 ➞ APC/CCdh1 ➞ SCF, constitue la charpente ubiquitine-dépendante du cycle cellulaire et garantit la progression irréversible entre les phases.
(Figure : vetopsy.fr d'après Zhou et coll)
Rôle physiopathologique
1. La dérégulation du complexe SCF (Skp1-Culline-F-box) et de ses adaptateurs F-box entraîne de profondes altérations du cycle cellulaire et de l’homéostasie protéique.
Ces anomalies se traduisent par :
- l’accumulation d’inhibiteurs de CDK, i.e. p27Kip1 et p21Cip1 et un blocage du cycle cellulaire,
- une instabilité du génome par perte de contrôle de la dégradation des régulateurs mitotiques,
- une oncogenèse par surexpression ou hyperactivation de certaines F-box telles que Skp2 ou β-TrCP (The ubiquitin proteasome system — Implications for cell cycle control and the targeted treatment of cancer 2014 et Ubiquitin ligases in cancer: Functions and clinical potentials 2021),
- des pathologies neurodégénératives, notamment les formes familiales de sclérose latérale amyotrophique (SLA) liées aux mutations de la cycline F (F-Box Proteins and Cancer 2020).
2. Ces observations soulignent le rôle central du SCF dans la coordination entre ubiquitination, cycle cellulaire et stabilité protéique.
En orchestrant la dégradation des régulateurs du cycle, il constitue le pendant fonctionnel de l’APC/C, garantissant la succession ordonnée des phases G1, S et M.


