Ligases Cullin-RING (CRL)
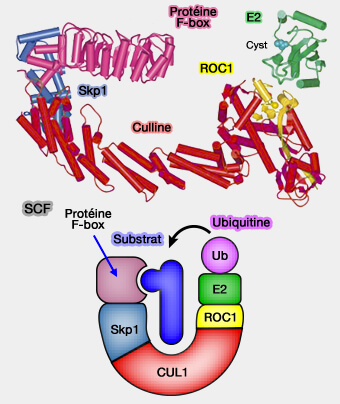
Complexe SCF (Skp1/Culline/F-box)
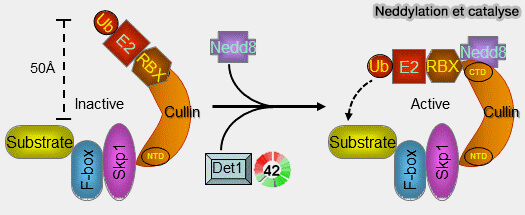
Cycle catalytique
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le cycle catalytique du complexe SCF repose sur l’alignement contrôlé du substrat phosphorylé, de la F-box et du module Cul1-Rbx1-E2~Ub, permettant une ubiquitination rapide et hautement spécifique.
Cycle catalytique du SCF
Le cycle catalytique du SCF repose sur l’alignement contrôlé :
- du substrat phosphorylé,
- de la protéine F-box adaptatrice,
- du module catalytique CUL1-Rbx1-E2~Ub.
La géométrie imposée par l’échafaudage de CUL1 conditionne l’efficacité du transfert d’ubiquitine et la formation de chaînes K48 dirigées vers le protéasome 26S.

(Figure : vetopsy.fr d'après Thomson et coll)
Recrutement du substrat phosphorylé
Le recrutement du substrat constitue l’étape initiale du cycle catalytique du SCF et repose sur la reconnaissance d’un motif phosphorylé, i.e. phospho-dégron, généré en amont par l’action coordonnée de kinases spécifiques.
1. La plupart des substrats du SCF ne sont reconnus qu’après l’action séquentielle ou hiérarchique de kinases :
- cyclines/CDK, comme la cycline E/CDK2 phosphorylant p27Kip1 avant sa dégradation par SCFSkp2,
- CK1, par exemple la phosphorylation initiale d’IκBα favorisant sa reconnaissance par β-TrCP,
- GSK3β, comme pour la phosphorylation secondaire de β-caténine, complétant le phospho-dégron DSGxxS,
- parfois MAPK, notamment ERK1/2 phosphorylant c-Myc, facilitant son ciblage par certaines FBXO.
(Figure : vetopsy.fr)
Le SCF est la CRL la plus étroitement dépendante d’un dégron phosphorylé pour engager son cycle catalytique par rapport aux autres CRL qui peuvent reconnaître des substrats acétylés, méthylées… (
2. Cette phosphorylation crée un motif conformationnel lisible par la région C-terminale de la F-box (LRR, WD, ou module spécifique des FBXO), qui agit comme un capteur moléculaire permettant d’intégrer des signaux qui dépendent directement du cycle cellulaire :
- fin de G1 et transition G1/S pour Skp2, par exemple l’élimination de p27Kip1,
- signalisation mitogénique ou inflammatoire pour β-TrCP, comme l’activation de NF-κB via la dégradation d’IκBα,
- stress nucléaire pour certaines FBXO, comme FBXO4 dégradant la cycline D1 après phosphorylation induite par stress oxydatif.

Le SCF est la seule CRL dont le recrutement est directement indexé sur les oscillations CDK et les signaux péri-G1/S.
Positionnement du substrat sur la plateforme Skp1-F-box >
Une fois recruté, le substrat phosphorylé doit être positionné avec une géométrie précise face au bras catalytique Rbx1/E2~Ub.
Cette étape conditionne directement l’efficacité du transfert d’ubiquitine et distingue profondément le SCF des autres complexes CRL.
1. Le couple Skp1-F-box constitue la plateforme de reconnaissance du substrat.
a. Skp1 stabilise l’orientation de la F-box sur CUL1.
b. La région C-terminale de la F-box :
- verrouille le phospho-dégron, ce qui stabilise l’interaction transitoire avec le complexe,
- impose un angle d’inclinaison spécifique,
- maintient le substrat à une distance adaptée, quelques nm du domaine RING de Rbx1,
- expose un ensemble de lysines accessibles à l’attaque de l’E2~Ub.
2. CUL1 impose une organisation quasi linéaire entre :
- l’adaptateur Skp1/F-box à son extrémité N-terminale,
- le module Rbx1/E2~Ub à son extrémité C-terminale.
a. Cette géométrie est essentielle pour :
- aligner le substrat avec le bras catalytique,
- maintenir une distance optimale pour la nucléophilie de la lysine cible,
- permettre la bascule du domaine RING lorsque CUL1 est neddylé.
b. Ce positionnement dépend du type de domaine F-box :
- Le domaine WD impose une interaction en " coupelle ", souvent plus compacte,
- LRR (Leucine-Rich Repeat) propose une interaction plus étendue, en fer à cheval.
3. La plateforme F-box impose une rigidité locale, mais conserve une flexibilité latérale qui permet au bras Rbx1 de :
- basculer,
- se rapprocher,
- puis transférer l’ubiquitine.
Recrutement de l’E2 chargé (E2~Ub)
1. Le domaine RING de Rbx1 interagit de manière spécifique avec l’E2~Ub, comme Ube2D ou Ube2R, interaction faible mais rapide, essentielle pour assurer un flux catalytique élevé, stabilisant :
- la position de l’ubiquitine activée,
- la conformation catalytique propre au complexe,
- l’orientation de la cystéine active de l’E2 au sein de son domaine UBC, précisément alignée pour attaquer la lysine cible du substrat (
domaine catalytique UBC des E2).
2. La neddylation du domaine WHB de CUL1 provoque :
- la bascule du RING vers la plateforme F-box,
- le rapprochement maximal du E2~Ub,
- une conformation resserrée idéale pour la mono-ubiquitination.
3. L’efficacité du SCF repose sur la géométrie allongée et quasi linéaire imposée par CUL1, qui rapproche efficacement l’E2~Ub du substrat et favorise un transfert rapide de l’ubiquitine.
Transfert de l’ubiquitine et formation de la chaîne
1. Le premier transfert résulte d’une attaque nucléophile d’une lysine du substrat sur l’ubiquitine liée à l’E2.
Cette étape est très rapide, ce qui confère au SCF une grande efficacité d’initiation.
2. Après la mono-ubiquitination, le même E2 ou un E2 secondaire génère des chaînes majoritairement K48, de longueur suffisante (4-6 ubiquitines) pour la reconnaissance par le protéasome 26S dont la sélectivité dépend de plusieurs facteurs.
a. La nature de l’E2 engagé conditionne directement la longueur et l’homogénéité de la chaîne poly-Ub.
- Ube2R favorise l’allongement ordonné de chaînes K48 longues.
- Ube2D produit au contraire des chaînes plus courtes et plus hétérogènes.
b. La F-box module également la croissance de la chaîne.
- Certaines comme Skp2 maintiennent le substrat dans une géométrie stable propice à l’allongement.
- D’autres comme β-TrCP favorisent une dissociation plus rapide, limitant la longueur des chaînes.
(Figure : vetopsy.fr d'après Malaria Parasite Metabolic Pathways)
c. Le niveau de neddylation de CUL1 influence la productivité catalytique.
- Une neddylation complète stabilise la conformation " fermée " du bras Rbx1 et augmente la capacité d’allongement.
- Une déneddylation partielle réduit la productivité catalytique.
Libération du substrat ubiquitiné
1. Lorsque la chaîne K48 atteint la longueur critique, généralement 4-6 ubiquitines, la topologie locale modifie l’interaction F-box-substrat.
- L’affinité diminue progressivement, car la chaîne poly-Ub induit une déstabilisation mécanique du contact initial : les interactions phospho-dépendantes deviennent transitoires, se relâchent puis se rompent.
- Le glissement du substrat s’accentue, la chaîne K48 adoptant une conformation compacte qui exerce une contrainte spatiale incompatible avec le maintien stable du phospho-dégron dans le sillon de la F-box.
- La chaîne poly-Ub elle-même agit comme levier, créant une force d’arrachement qui facilite la dissociation finale du substrat et son transfert vers le protéasome 26S.
2. Le SCF est optimisé pour un turnover élevé, représentant le complexe CRL dont la réinitialisation est la plus rapide.
a. Aucun remaniement interne n’est requis pour engager un nouveau cycle catalytique.
- Le bras catalytique Rbx1 retrouve immédiatement sa position active.
- La F-box devient instantanément disponible pour un nouveau substrat.
- CUL1 neddylé maintient le complexe dans une conformation catalytique verrouillée.
b. Cette cinétique élevée permet au SCF de traiter en série plusieurs substrats successifs appartenant à la même voie ou présentant le même état de phosphorylation.
3. Cette propriété est essentielle dans :
a. la transition G1/S, dans laquelle p27Kip1, phosphorylé par cycline E/CDK2, est rapidement dégradé par SCFSkp2, permettant l’activation complète de CDK2 et l’entrée en phase S.
b. l’élimination rapide d’inhibiteurs de CDK,
- p21Cip1, ciblé par SCFSkp2, est éliminé dès que les signaux mitogéniques déclenchent sa phosphorylation préalable.
- Wee1, kinase inhibitrice de CDK1, est dégradée via un phospho-dégron reconnu par β-TrCP, levant ainsi le frein sur CDK1.
c. la réponse immédiate aux signaux mitogéniques.
- IκBα, phosphorylé par IKK, est détruit par SCFβ-TrCP, libérant NF-κB et déclenchant une réponse inflammatoire rapide.
- La β-caténine, phosphorylée par CK1 puis GSK3β, est dégradée via β-TrCP, modulant en quelques minutes l'activité de la voie Wnt/β-caténine.


