Ligases Cullin-RING (CRL)
Complexe SCF (Skp1/Culline/F-box)
Régulation
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La régulation du complexe SCF repose sur l’alternance coordonnée entre déneddylation, intervention de CAND1 et re-neddylation de Cul1, assurant l’ajustement dynamique des F-box et de la spécificité du complexe.
Régulation du complexe SCF
La régulation du complexe SCF repose sur les principes généraux appliqués à toutes les CR par trois mécanismes complémentaires qui orchestrent l’état d’assemblage, la dynamique d’échange des récepteurs de substrats et la stimulation catalytique du complexe :
- la déneddylation par le complexe CSN,
- l’inhibition et le remodelage par CAND1,
- la réactivation par neddylation.
Elle présente des particularités fortes liées au cycle d'échange des protéines F-box, qui conditionne directement la nature des substrats ciblés (
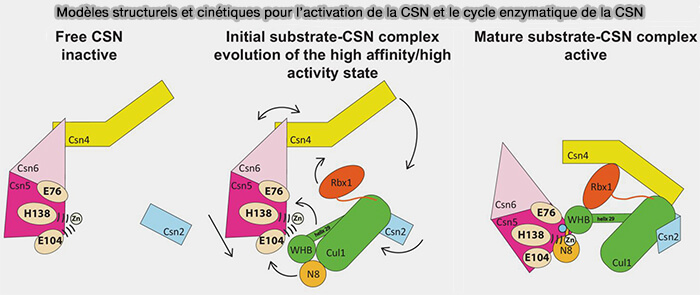
Déneddylation par le CSN
La déneddylation du SCF par le CSN (COP9 signalosome) est identique dans son principe à celle des autres CRL, mais elle déclenche immédiatement le cycle d'échange des protéines F-box, un processus beaucoup plus dynamique que dans les autres CRL.
(Figure : vetopsy.fr d'après Mosadeghi et coll)
1. Contrairement aux CUL2/3/4, où les récepteurs de substrats sont relativement stables, la déneddylation de CUL1 :
- ouvre un état de réorganisation dans lequel les F-box deviennent échangeables,
- permet l’accès immédiat de CAND1,
- prépare le remplacement de la F-box engagée par une nouvelle F-box adaptée aux signaux,
- réoriente rapidement le spectre des substrats du SCF.
2. La déneddylation dans le SCF n’est pas seulement un frein catalytique, mais un commutateur qui pilote l’adaptation rapide des récepteurs de substrats.
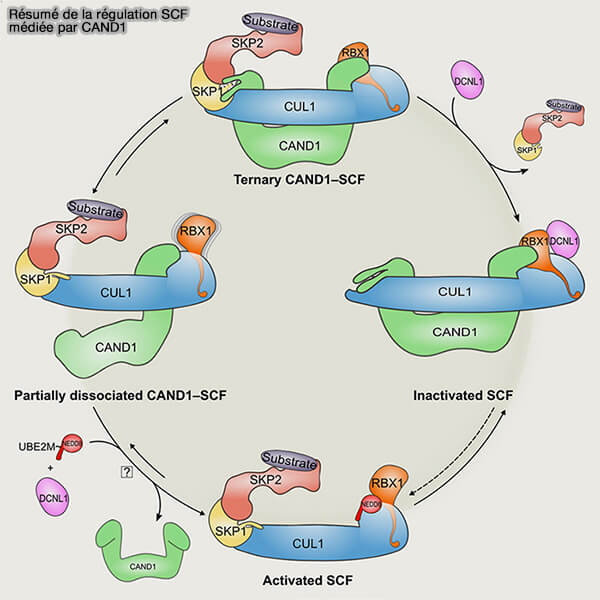
Inhibition et le remodelage par CAND1
Dans le cas du SCF, le rôle de CAND1 est particulièrement déterminant car il contrôle le cycle d'échange rapide des protéines F-box, bien plus dynamique que l’échange des récepteurs dans les autres CRL (
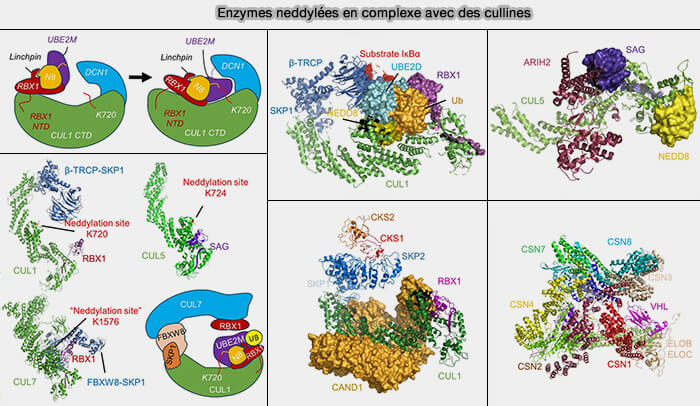
Dans la figure ci-dessous, DCNL1 (Defective in Cullin Neddylation 1 Domain-Containing 1) est une co-E3 de neddylation dans les CRL/SCF.
- Elle augmente la productivité de la neddylation, donc accélère l'action catalytique des complexes.
- Dans certains contextes, DCNL1 est sur-exprimé dans des cancers, ce qui montre l’importance physiologique de la neddylation modulée (Protein neddylation and its role in health and diseases 2024).
(Figure : vetopsy.fr d'après Shaaban et coll)
1. Sur CUL1 déneddylée, CAND1 ne se contente pas d’inhiber le complexe (Structural and mechanistic insights into the CAND1-mediated SCF substrate receptor exchange 2023).
- Il favorise le détachement de la F-box en place.
- Il autorise l’association d’une nouvelle F-box en fonction des signaux cellulaires.
- Il reprogramme le spectre des substrats du SCF en temps réel.
- Il impose une alternance stricte entre :
- un état catalytique actif, dans lequel CUL1 est neddylé et la F-box engagée,
- un état d’échange, où CUL1 déneddylé peut s’associer à CAND1, ouvrant la voie au remplacement de la F-box.
2. Cette organisation confère au SCF une logique binaire, actif ou réorganisé, beaucoup plus marquée que dans les autres CRL, qui conservent souvent des états intermédiaires stables.
Cette dynamique rend le SCF particulièrement dépendant de CAND1 pour adapter rapidement son répertoire de substrats aux signaux du cycle cellulaire.
(Figure : vetopsy.fr d'après Zhang et coll)
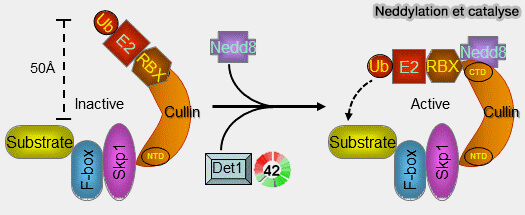
Réactivation par neddylation
La re-neddylation de CUL1 du SCF ne se limite pas à réactiver le module catalytique, mais elle referme immédiatement le cycle dynamique CAND1 ➞ F-box ➞ substrat, ce qui confère au SCF une réactivité exceptionnelle face aux variations des signaux cellulaires.
(Figure : vetopsy.fr d'après Malaria Parasite Metabolic Pathways)
1. La conjugaison de NEDD8 sur CUL1, localisée sur la lysine conservée de son domaine WHB, :
- met fin à l’état d’échange, en expulsant CAND1,
- stabilise instantanément la F-box engagée,
- reconstitue la plateforme Skp1-F-box dans une géométrie productive,
- permet un raccourcissement immédiat de la distance Rbx1/substrat,
- positionne l’E2~Ub avec une précision suffisante pour initier une chaîne K48.
2. Chez le SCF, la neddylation n’est pas seulement une activation mécanique, mais constitue un déclencheur fonctionnel qui verrouille le complexe dans un mode catalytique et aligne immédiatement la F-box, le substrat et Rbx1.
Conséquence : cycle d'échange des F-Box
Contrairement aux autres CRL, où la neddylation prépare un état catalytique qui reste parfois modulable, CUL1-NEDD8 engage le SCF dans un état pleinement actif, directement couplé :
- aux oscillations cycline/CDK,
- aux signaux mitogéniques,
- aux réponses rapides au stress nucléaire.
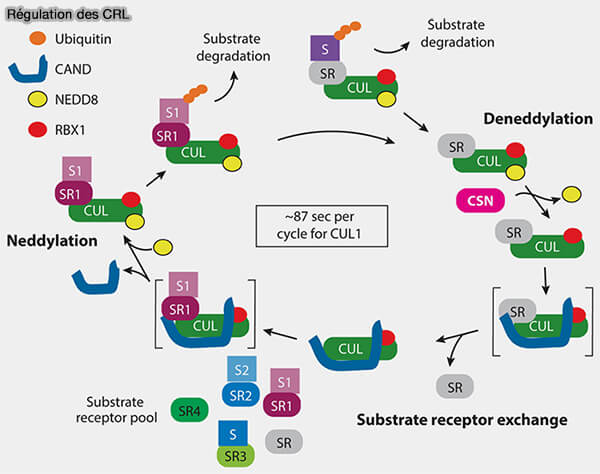
(Figure : vetopsy.fr d'après Shaaban et coll)
1. En effet, le SCF est la seule ligase CRL dotée d’un répertoire massif de récepteurs de substrats, avec plus de 90 protéines F-box chez l’Homme.

Un même SCF ne peut pas traiter simultanément tous ces programmes et il doit remplacer rapidement la F-box engagée par celle qui reconnaît le phospho-dégron correspondant au signal prioritaire.
2. Ce renouvellement repose sur l’alternance cyclique propre aux CRL mais particulièrement marquée dans le SCF.
- CSN déneddyle CUL1, le complexe se déverrouille,
- CAND1 se lie à CUL1, la F-box en place est relâchée,
- une nouvelle F-box s’associe, la signature de substrats change,
- NEDD8 revient, le SCF est réactivé sous une nouvelle forme.
3. Ce cycle rapide explique la polyvalence du SCF, étroitement couplé aux signaux cellulaires.


