Domaines protéiques
Répétition riche en leucine (LRR)

Une répétition riche en leucine (LRR ou leucine-rich repeat) est un motif structurel présent dans certaines protéines où elle forme un repliement en forme de fer à cheval.
Structure des LRR
1. Chaque unité LRR, en forme de banane, est composée :
- d'un brin β (β strand) de 20 à 30 résidus bordant la face concave,
- d'une courte hélice α reliée par des boucles flanquant la circonférence extérieure.
(Figure : vetopsy.fr d'après Peng sous licence CC)
2. Le noyau hydrophobe du domaine LRR, étroitement compacté par de nombreux résidus de leucine, a une forme de fer à cheval et pointe vers l'intérieur.
a. Ce noyau est formé par les brins β parallèles et protégés par les coiffes LRRCT et LRRNT aux extrémités N- et C-terminales.
b. LRRNT et LRRCT contiennent deux paires de résidus de cystéine entièrement conservées qui forment potentiellement au total quatre ponts disulfure dans l'environnement extracellulaire oxydant favorable.

Les LRR forment un domaine protéique solénoïde.
Rôles des LRR
1. Les LRR interviennent dans des interactions protéine/protéine par la surface concave qui est exposée au solvant, les feuillets β servant d'échafaudage.
2. Des résidus disposés dans une orientation appropriée à la surface des LRR sont impliqués dans une fonction particulière.
- L’inhibiteur de la ribonucléase interagit avec ses cibles via la surface interne concave du croissant.
- Le site de liaison de Ran, dans Rna1p de S. pombe est situé sur la face latérale du croissant dans les régions de boucle reliant les brins β et les hélices α.
3. On retrouve ces domaines dans de nombreuses protéines :
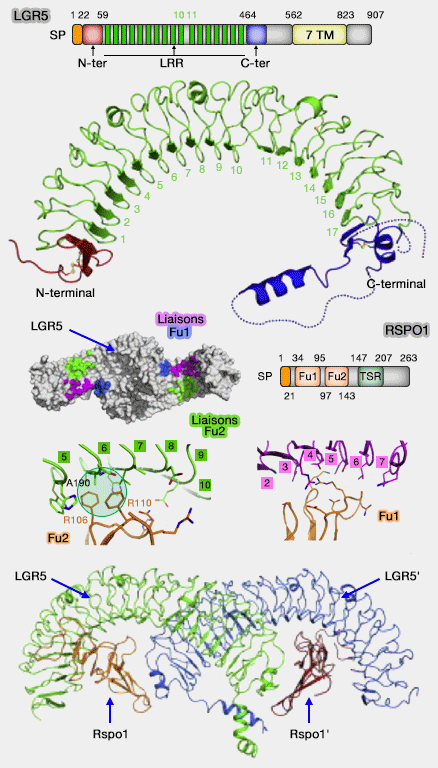
- les récepteurs LGR4/5/6 (Leucine-rich repeat-containing G-protein coupled receptor 4/5/6), qui comprennent 17 répétitions riches en leucine,
- la tropomoduline, protéine de coiffe des filaments d'actine,
- les sous-unités γ des canaux potassiques sensibles au calcium (BK) qui contiennent des domaines LRRD,
- l'erbine regulatrice de la voie de signalisation TGF-β,
- Waif1 (Wnt-activated inhibitory factor 1, antagoniste de la voie de signalisation Wnt/β-caténine…
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


