Lipides
Acide gras
Synthèse des acides gras
cytoplasmiques
Sources des molécules
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- acides gras (FA)
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques (LD)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La synthèse des acides gras (FA) cytoplasmiques nécessite de l'acétyl-CoA, du malony-CoA et du NADPH dont les sources sont diverses.
Sources des molécules des réactions
Acétyl-CoA
La glycolyse produit la majeure partie de l’acétyl-CoA par la formation de pyruvate i.e. 10ème étape de la glycolyse.

L'acétyl-CoA est étudiée dans un chapitre spécial.
1. Or l'acétyl-CoA ne peut traverser les membranes et doit passer par le pyruvate.
2. Le pyruvate pénètre dans les mitochondries et doit être transformé en citrate pour retraverser les deux membranes et former l'acétyl-CoA avec CoA et l'ATP (
$\ce{Citrate + CoA + ATP}$ $\leftrightharpoons$ $\ce{oxaloacétate + Acétyl-CoA + ADP + Pi}$
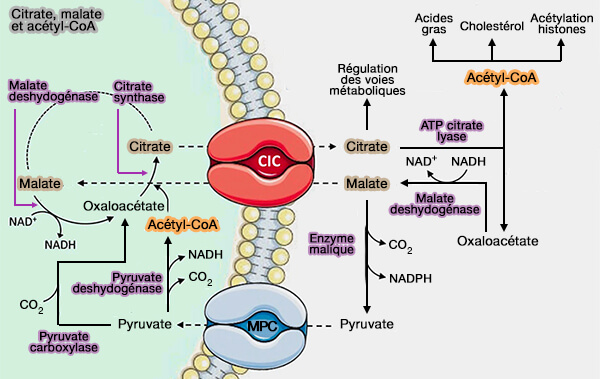
(Figure : vetopsy.fr d'après Zara et coll)
Malonyl-CoA
L'acétyl-CoA est aussi un substrat de l'acétyl-CoA carboxylase (ACC) qui permet la formation du malonyl-CoA par un processus irréversible en plusieurs étapes.
- La formation de malonyl-CoA est concomitante avec celle de la synthèse des acides gras car c'est son principal rôle métabolique.
- Le malonyl-CoA agit également comme inhibiteur de la carnitine carnnitine palmitoyl transférase 1 (CPT1), présente à la surface des mitochondries pour la β-oxydation.

Vous pouvez lire : Acetyl-CoA Carboxylases and Diseases (2022).
Acétyl-CoA carboxylase (ACC)
L'ACC humaine est formée par deux gènes différents.
- ACC1 cytosolique, produit ACACA, est impliqué dans la biogenèse des acides gras et est surtout retrouvée dans les tissus lipogéniques.
- ACC2 sur la membrane mitochondriale externe (OMM), produit par ACACB, est plutôt utilisé par la β-oxydation en influençant de manière allostérique l'activité de la carnitine palmitoyltransférase 1 (CPT1) bien qu'elle puisse aussi produire du malonyl-CoA. Elle est surtout retrouvée dans les muscles et le foie.
Structure de l'ACC

L'acétyl-CoA carboxylase (ACC), i.e. EC 6.4.1.2, est une enzyme à domaine prosthétique constitué de biotine qui est attaché par une liaison amide ($\ce{-C(=O)N-}$) à un résidu lysine dans le domaine de transport (Crystal structure of the 500 kD yeast acetyl-CoA carboxylase holoenzyme dimer 2015).
1. L'ACC comprend trois domaines fonctionnels chez les mammifères.
- un domaine biotine carboxylase (BC),
- un domaine protéique de transport de biotine carboxylée (BCCP, biotin carboxyl carrier) qui lie les deux autres domaines,
- un domaine carboxyltransférase (CT).
Remarque : ces domaines sont retrouvés dans la pyruvate carboxylase (PC), qui transforme le pyruvate en oxaloacétate dans la matrice mitochondriale.
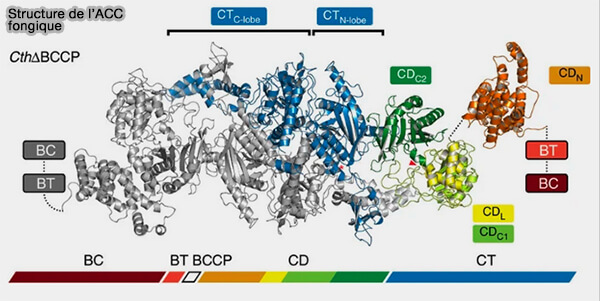
(Figure : vetopsy.fr d'après Hunkeler et coll)
2. L'ACC comprend aussi deux régions non catalytiques.
a. Le grand domaine central (CD) forme un tiers de la protéine et constitue une caractéristique unique des ACC eucaryotes sans homologues dans d’autres protéines.
La phosphorylation de plusieurs de ses résidus sérine régule l'activité de l'ACC.
b. Le domaine d'interaction BC–CT (BT) est mal caractérisé.

La réaction catalysée est similaire à d'autres enzymes à biotine comme la pyruvate carboxylase (PC) étudiée dans un chapitre spécial ou la proprionyl-CoA carboxylase.
Remarque : les trois domaines de l'ACC des procaryotes sont sur des protéines différentes. Les plantes possèdent les deux formes.
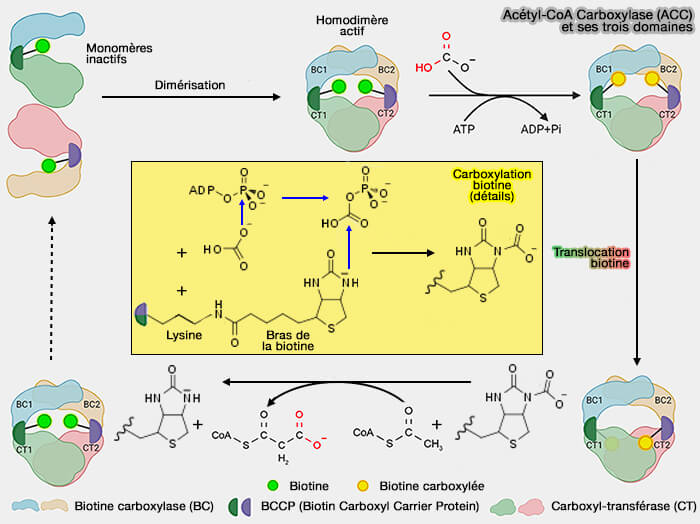
(Figure : vetopsy.fr d'après Wang et coll)
Réactions catalysées par l'ACC
Les réactions sont les suivantes.
1. Le bicarbonate ($\ce{HCO3-}$) est activé par l'ATP pour former un carbamoyl-phosphate ($\ce{HO-C(O)-OPO3^{2-}}$) qui sert de source de $\ce{CO2}$ pour être transféré sur la biotine sur le domaine BC.
$\ce{HCO3- + biotine + ATP}$ $\leftrightharpoons$ $\ce{Biotine-COO- + ADP + Pi}$
2.. Le groupe arboxylique ($\ce{-C(=O)O-}$ est alors transporté par BCCP sur le domaine CT pour être transféré à l'acétyl-CoA.
$\ce{Biotine-COO- + acétyl-CoA}$ $\leftrightharpoons$ $\ce{Biotine + malonyl-Coa}$
Régulation de l'ACC
ACC est la première enzyme limitante dans la synthèse des acides gras et sa régulation par deux mécanismes différents est essentielle dans ce processus.
Différentes formes d'ACC
1. L'ACC se présente sous deux formes et les changements conformationnels sont essentiels pour sa dimérisation (How Does Polymerization Regulate Human Acetyl-CoA Carboxylase 1? 2018) :
- une forme monomérique phosphorylée, i.e. dimère inactif, non filamenteux,
- une forme dimérique déphosphorylée, formant des mutimères filamenteux (Structures, functions, and mechanisms of filament forming enzymes: a renaissance of enzyme filamentation 2019).
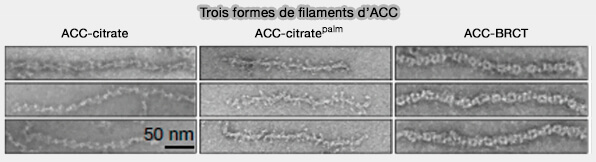
(Figure : vetopsy.fr d'après Park et Horton )
2. Il existe plusieurs sortes de filaments d'ACC1 chez l'homme (Structural basis for regulation of human acetyl-CoA carboxylase 2018).
a. Le filament actif (ACC-citrate) se forme en présence de citrate, et uniquement avec une forme d'ACC1 déphosphorylée.
- Il est composé d'un polymère linéaire de dimères ACC1 qui semblent s'ajouter individuellement à chaque extrémité.
- Les domaines BC sont dimérisés, ainsi que les BCCP dans une position dans laquelle ils peuvent pivoter pour transporter la biotine du domaine BC au domaine CT (carboxyl transférase).
b. L'ACC-citratepalm est formé par l'ajout d'un excès de palmitoyl-CoA, principal produit de la synthèse des acides gras, à la forme filamenteuse d'ACC1 induite par le citrate.
Cette forme, ACC-citratepalm, est vraisemblablement inactive car les domaines BC ne sont plus dimérisés et le palmitoyl-CoA joue un rôle de feed-back négatif sur l'ACC.
Remarque : l'ACC-BRC, troisième type de filament, résulte de la liaison des domaines BRCT de BRCA1 (Breast cancer type 1) à une forme phosphorylée sur Ser1263 de ACC1, i.e. (Structural evidence for direct interactions between the BRCT domains of human BRCA1 and a phospho-peptide from human ACC1 2008).
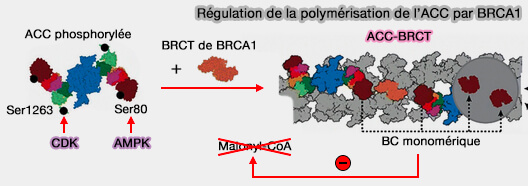
(Figure : vetopsy.fr d'après Park et Horton )
- Cette liaison sur Ser1263 phosphorylé, un résidu phosphorylé de manière dépendante du cycle cellulaire, inhibe la déphosphorylation de Ser80 de ACC1.
- Les mutations dans les domaines BRCT éliminant la liaison de BRCA1 à l'ACC entraînent une lipogenèse élevée, condition préalable à la croissance des cellules cancéreuses (Cell cycle regulation of the BRCA1/acetyl-CoA-carboxylase complex 2009).
Phosphorylation et métabolites locaux
La polymérisation de l'ACC est dépendante des signaux régulateurs.
1. La phosphorylation, sur au moins trois résidus sérine, dépend de plusieurs facteurs.
a. En réponse à l'état énergétique cellulaire, le glucagon, l'adrénaline (épinéphrine) ou l'AMP active des kinases dépendantes qui rend l'ACC inopérante (Crystal structure of the 500 kD yeast acetyl-CoA carboxylase holoenzyme dimer 2015).
AMPK phosphoryle en particulier Ser80 de l'ACC1 et Ser222 de l'ACC2 (Phosphorylation of Acetyl-CoA Carboxylase by AMPK Reduces Renal Fibrosis and Is Essential for the Anti-Fibrotic Effect of Metformin 2018).
b. CDK, active dans la progression du cycle cellulaire, provoque la phosphorylation de Ser1263.
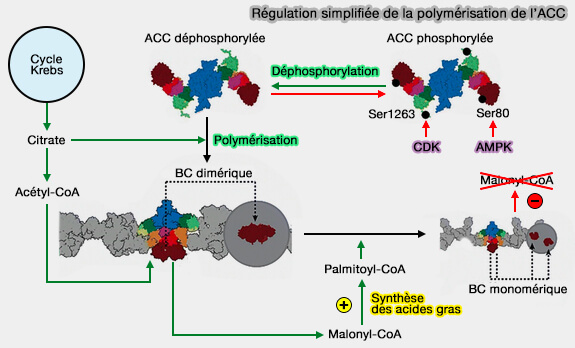
(Figure : vetopsy.fr d'après Park et Horton )
2. Les métabolites locaux contrôlent aussi allostériquement l'ACC.
a. En présence de citrate, l'ACC avec Ser80 non phosphorylé forme des filaments actifs (ACC-citrate) activés avec des domaines BC dimères et l'ACC produit du malonyl-CoA pour la biosynthèse des acides gras.
- Lorsque de l'élévation les concentrations de l'acétyl-CoA mitochondrial et de l'ATP, le citrate est transporté hors des mitochondries et devient à la fois le précurseur de l'acétyl-CoA cytosolique et un signal allostérique pour l'activation de l'acétyl-CoA carboxylase.
- En même temps, il inhibe l'activité de la phosphofructokinase-1, réduisant ainsi la glycolyse.
b. Le palmitoyl-CoA, principal produit de la synthèse, provoque un feed-back négatif sur l'ACC en modifie les filaments ACC–citrate, en perturbant la dimérisation du domaine BC.

En résumé, dans des conditions physiologiques, la régulation de l'ACC dépend donc de l'état nutritionnel du sujet.
a. Lors des repas, la synthèse des FA est élevée en raison du niveau élevé de glucose et d'acétyl-CoA qui est également soutenue par l'insuline qui active l'ACC en la déphosphorylant.
Lorsque l'ACC est actif, les niveaux de malonyl-CoA sont élevés, l'entrée des acides gras dans les mitochondries via CPT1 est faible et la majeure partie du malonyl CoA est détournée vers la synthèse des acides gras.
b. En cas de jeûne, la glycémie est basse, ce qui active la PKA qui inhibe l'ACC par phosphorylation qui à son tour réduit la synthèse des acides gras.
Lorsque l’activité de l’ACC est faible, une entrée accrue d’acides gras dans les mitochondries est associée à une augmentation de la β-oxydation.
Remarque : l'acétyl-CoA et la malonyl-CoA sont respectivement les cofacteurs de l'acétylation et de la malonylation des protéines.
- Les fonctions non métaboliques émergentes de l'ACC1 dans les maladies élargissent davantage les rôles de l'ACC1.
- ACC1 est donc considéré comme une cible thérapeutique prometteuse pour traiter des maladies telles que le cancer et les maladies métaboliques.
NADPH et ATP
1. Le NADPH est produit par deux voies.
a. L'oxaloacétate est réduit en malate par la malate déshydrogénase qui est alors décarboxylé par l'enzyme malique à NADP cytosolique, ce qui permet de créer des NADPH, ici pour le bilan de la réaction globale, 8 NADPH.
$\ce{(S)-malate + NADP+}$ $\leftrightharpoons$ $\ce{pyruvate + CO2 + NADPH}$
b. Les tissus à lipogenèse marquée sont des tissus qui oxydent rapidement le glucose par la première étape de la voie des pentoses produisent les 6 NADPH restants.
$\ce{Glucose-6-phosphate + NADP+}$ $\longrightarrow$ $\ce{6-phosphoglucono-δ-lactone + NADPH + H+}$
Remarque : le NADPH n'est pas impliqué dans la principale voie catabolique des acides gras, i.e. la β-oxydation.
2. L'ATP est fourni par la glycolyse ou la glycogénolyse des hépatocytes sous l'action de l'insuline, en épargnant le glycogène des adipocytes.
Retour à la synthèse des acides gras
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasSynthèse des acides grasβ-oxydationCorps cétoniquesOxylipinesLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


