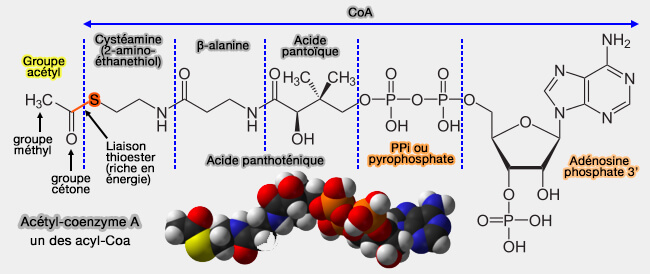
Cofacteurs
Coenzymes de transfert
Acétyl-CoA : biosynthèse
Autres voies que celle du pyruvate
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'acétyl-CoA est synthétisée par d'autres voies que celle du pyruvate, comme par la β-oxydation, mais aussi à partir du citrate, de l'acétate, des acides aminés et de l'éthanol.
(Figure : vetopsy.fr)
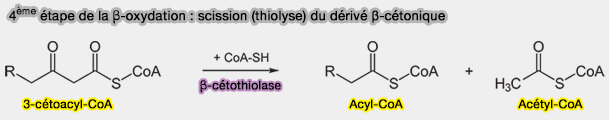
Biosynthèse de l'acétyl-CoA par la β-oxydation
Lors de la β-oxydation, la quatrième étape, i.e. la scission (thiolyse) du dérivé β-cétonique, libère, à chaque cycle, une molécule d’acétyl-CoA à partir du 3-cétoacyl-CoA, tout en générant un acyl-CoA raccourci de deux carbones.
(Figure : vetopsy.fr)

La β-oxydation est étudiée dans un chapitre spécifique.
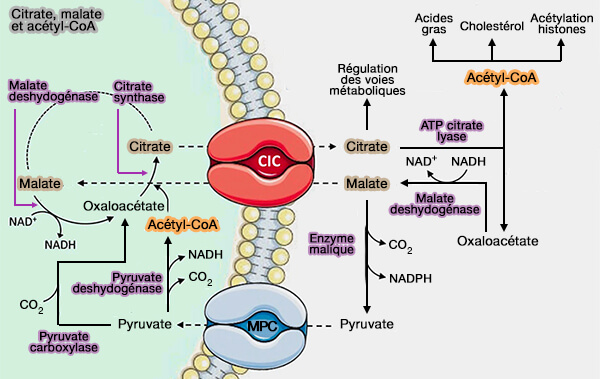
Biosynthèse de l'acétyl-CoA à partir du citrate
La navette citrate-malate est une série de réactions biochimiques qui permettent le transport indirect de l’acétyl-CoA depuis la matrice mitochondriale vers le cytosol, où se déroule la synthèse des acides gras, qui est essentiellement cytoplasmique.
1. Lorsque les taux de glucose sont élevés, la glycolyse s'intensifie et produit du pyruvate, i.e. 10ème étape de la glycolyse.
a. Le pyruvate pénètre dans les mitochondries et traverse les deux membranes (
- La membrane mitochondriale externe (OMM) est traversée par diffusion facilitée, sans consommation énergétique, via VDAC (Voltage-Dependent Anion Channel), porine des eucaryotes.
- La membrane mitochondriale interne (IMM) est franchie par le transporteur mitochondrial du pyruvate, i.e. MPT ou MPC, Mitochondrial Pyruvate Carrier.
(Figure : vetopsy.fr d'après Zara et coll)
b. Il subit une décarboxylation oxydative irréversible grâce au complexe pyruvate déshydrogénase ou PDH (
$\ce{Pyruvate + CoA-SH + NAD+$ $\longrightarrow$ $\ce{NADH+ H+ + CO2 + Acétyl-CoA}$
2. Le citrate est formé dans la matrice mitochondriale par la condensation de l'acétyl-CoA avec l'oxaloacétate par i.e. la citrate synthase (CS), EC 2.3.3.1, par la première étape du cycle de Krebs.
$\ce{Acétyl-CoA + oxaloacétate}$ $\longrightarrow$ $\ce{Citrate + CoA-SH}$
a. L'excès de citrate est exporté de la mitochondrie vers le cytosol par le transporteur de citrate, i.e. CIC (CItrate CArrier), appelé aussi Tricarboxylate transport protein, tricarboxylate carrier protein ou Citrate Transport Protein (CTP), i.e. SLC25A1 (Multiple roles played by the mitochondrial citrate carrier in cellular metabolism and physiology 2022).
b. Il est clivé par l'ATP citrate lyase (ACL), EC 2.3.3.8, pour régénèrer l'acétyl-CoA et l'oxaloacétate., réaction exergonique grâce à l'hydrolyse de l'ATP.
$\ce{Citrate + CoA-SH + ATP}$ $\longrightarrow$ $\ce{Oxaloacétate + acétyl-CoA + ADP + Pi}$
Remarque : cette réaction est aussi rendue irréversible par l'hydrolyse de l'ATP.
3. L'oxaloacétate est réduit en malate par la malate déshydrogénase cytosolique (MDH1)
$\ce{(Oxaloacétate + NADH + H+}$ $\leftrightharpoons$ $\ce{Malate + NADPH}$
La production de NADPH dans le cytosol est cruciale pour les voies anaboliques telles que la synthèse des acides gras et du cholestérol.
4. Le malate est alors décarboxylé par l'enzyme malique à NADP cytosolique (NADP-malic enzyme - NADP-ME - ou malate dehydrogenase (oxaloacetate-decarboxylating) (NADP+) ou pyruvic-malic carboxylase), EC 1.1.1.40 :
$\ce{(S)-malate + NADP+}$ $\leftrightharpoons$ $\ce{pyruvate + CO2 + NADPH}$
5. Le pyruvate ainsi formé peut ensuite être transporté de nouveau dans la matrice mitochondriale par le mitochondrial pyruvate carrier (MPC), complétant ainsi la navette citrate-malate.
Biosynthèse de l'acétyl-CoA à partir de l'acétate
La coenzyme A (CoA) peut être directement acétylée selon la réaction :
$\ce{Acétate + CoA + ATP}$ $\leftrightharpoons$ $\ce{Acétyl-CoA + AMP + PPi}$
Cette réaction est catalysée par l'acétyl-CoA synthétase Short Chain (ACSS), une des variantes de l'acétyl-CoA synthétase ou acétate-CoA ligase, EC 6.2.1.1, qui portent toutes le même EC et qui ciblent :
- les courtes chaînes (C2-C4), i.e. ACSS1, 2 et 3,
- les chaînes moyennes (C5-C12), ACSM1, 2…
- les chaînes longues (C13-C20), ACS1, 4…
- les chaînes très longues (>C20), ACSVL ou SLC27A1–6, aussi appelées FATP.
Dans la matrice mitochondriale
Cette réaction est réalisée dans la matrice mitochondriale par ACSS1.
Cette voie peut constituer une alternative à la classique décarboxylation oxydative du pyruvate par le complexe pyruvate déhydrogénase (PDH) pour fournir de l’acétyl-CoA au cycle de Krebs.
Dans le noyau
Cette réaction peut aussi avoir lieu dans le noyau par ACSS2, majoritairement localisée dans le cytosol au repos.
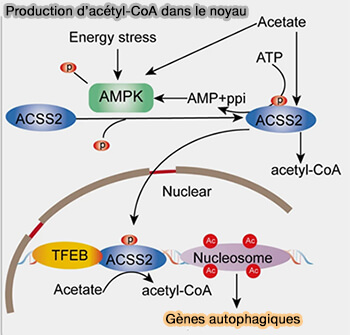
(Figure : vetopsy.fr d'après Ling et coll)
1. ACSS2 est transloquée vers le noyau par l'exposition du signal de localisation nucléaire (NLS, Nuclear Localization Signal), i.e. R664/665, par phosphorylation essentiellement sur Ser659 (Nucleus-translocated ACSS2 promotes the gene transcription for lysosomal biogenesis and autophagy 2017).
Une fois que le NLS est accessible, il est reconnu par l'importine α5 (transporteur nucléaire) qui la fait traverser le pore nucléaire.
2. Une fois dans le noyau,, ACSS2 peut alors exercer sa fonction en produisant de l’acétyl-CoA localement, suite à sa phosphorylation en réponse à certains stimuli.

Vous pouvez lire : Acetyl-CoA synthetase 2(ACSS2): a review with a focus on metabolism and tumor development (2022).
| État cellulaire | Effet sur ACL/ACSS2 nucléaire | Conséquences |
|---|---|---|
| Croissance rapide | ➚ Expression et activité, pour soutenir la synthèse de lipides et la régulation épigénétique | Augmentation de l'acétylation des histones ➞ activation de gènes pro-croissance |
| Différenciation | Modulation spécifique (peut augmenter ou diminuer selon le type cellulaire) | Reprogrammation épigénétique nécessaire au changement de phénotype |
| Stress métabolique | ➚ ACSS2 nucléaire (par exemple en hypoxie, jeûne) |
Maintien de l'acétylation histone malgré faibles ressources |
| Signalisation hormonale | Phosphorylation ou déphosphorylation d'ACL/ACSS2 modifie leur activité | Adaptation rapide aux besoins métaboliques |
3. ACSS2 a aussi un rôle dans les fonctions cognitives comme la mémoire à long terme (ACSS2-related autophagy has a dual impact on memory 2019).
a. D'une part, l’autophagie est une voie dégénérative intracellulaire responsable de la survie neuronale et qui peut entraîner un dysfonctionnement de la consolidation de la mémoire par ASCC2 qui interagit avec le TFEB, ce qui entraîne une expression régulée à la hausse des gènes lysosomaux et autophagosomaux.
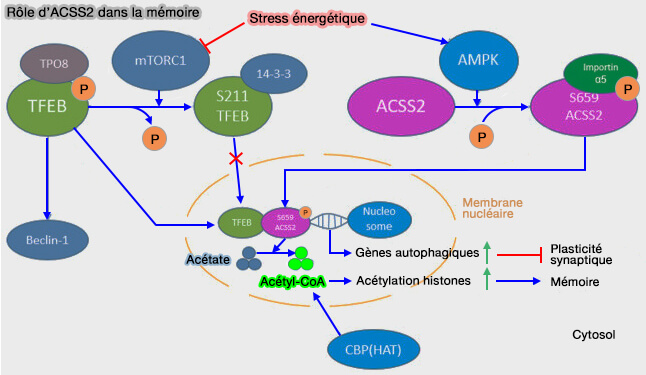
(Figure : vetopsy.fr d'après Zhang et coll)
b. D’autre part, ACSS2 peut recruter CBP [CREB (CAMP-Response-Element-Binding protein)-Binding Protein]/P300, EC 2.3.1.48, coactivateur transcriptionnel, et activer son activité HAT (histone acétyltransférase) dans le noyau.
CBP utilise l’acétyl-CoA produit localement par ACSS2 pour transférer un groupe acétyle sur les lysines des histones (surtout H3 et H4), ce qui modifie la structure de la chromatine, la rendant plus ouverte (euchromatine) et facilitant ainsi la transcription des gènes ciblés.
$\ce{Acétyl-CoA + histone-lysine(-NH2)}$ $\leftrightharpoons$ $\ce{CoA + histone-lysine-acétylée(−NH−COCH3) }$
c. ACSS2 joue également un rôle crucial dans le maintien des niveaux locaux d’acétylation des histones en recyclant l’acétate libéré lors de la désacétylation des histones.
- En recapturant cet acétate, ACSS2 le convertit de nouveau en acétyl-CoA, fournissant ainsi un substrat renouvelé pour l’activité HAT de CBP.
- Cette régénération locale d’acétyl-CoA permet de soutenir l’acétylation continue des histones, ce qui conduit à une augmentation de la transcription précoce immédiate de gènes clés tels que Egr2, Fos, Nr2f2, Sgk1 et Arc.
- Ces gènes sont impliqués dans la plasticité neuronale et la consolidation de la mémoire, soulignant ainsi l’importance d’ACSS2 dans les fonctions cognitives.
Biosynthèse de l'acétyl-CoA à partir de certains acides aminés
La dégradation des acides aminés à chaîne ramifiée (valine, leucine et isoleucine) conduit à des acides α-cétoniques par transamination.
Par exemple, la dégradation de la leucine aboutit à l'α-cétoisocaproate qui se transforme en isovaléryl-CoA, par l'intermédiaire du Complexe Branched-chain α-cétoacide déshydrogénase (BCKDC) ou complexe 3-méthyl-2-oxobutanoate déshydrogénase, composé de trois enzymes.
Ce complexe situé dans la membrane interne mitochondriale fonctionne comme le complexe pyruvate déshydrogénase (PDU) ou celui du complexe α-cétoglutarate déshydrogénase (OGDC) du cycle de Krebs.
L'α-cétoisocaproate subit trois réactions via le complexe 3-méthyl-2-oxobutanoate déshydrogénase (EC 1.2.4.4), comportant trois grandes étapes.
1. L’α-cétoisocaproate est décarboxylé et acylé par le complexe, avec transfert du groupe lipoyle à un cofacteur catalytique, le lipoamide, qui est lié de manière covalente à la sous-unité dihydrolipoyl S-acétyltransférase (E2).
La réaction est catalysée par la 3-méthyl-2-oxobutanoate déshydrogénase (E1), EC 1.2.4.4, dont le cofacteur est la thiamine pyrophosphate (TPP).
2. Le groupe acétyle (ou plus précisément un fragment acyle) est transféré par la dihydrolipoyl transacylase (E2), EC 2.3.1.168 sur la coenzyme A (CoA-SH) pour former l’isovaléryl-CoA.
Les cofacteurs sont :
- la thiamine pyrophosphate (TPP), déjà liée à E1,
- le lipoamide,
- la coenzyme A (CoA-SH).
3. La sous-unité dihydrolipoyl déshydrogénase (E3), ou lipoamide déshydrogénase (DLD), réoxyde le lipoamide réduit, en utilisant le cofacteur FAD, pour régénérer la forme active du complexe.
L'isovaléryl-CoA se transforme en un autre intermédiaire dérivé de CoA, le β-méthylcrotonyl-CoA par l'isovaléryl coenzyme A dehydrogenase (1.3.8.4) pour aboutir à l'acétoacétyl-CoA avant d'être clivé en acétyl-CoA et en acétoacétate ($\ce{CH3COCH2COOH}$).
Biosynthèse de l'acétyl-CoA à partir de l'éthanol
L'éthanol peut être aussi utilisé pour la formation d'acétyl-Co en deux étapes.
1. L’alcool déshydrogénase (ADH), EC 1.1.1.1 hépatique chez l'homme, catalyse l’oxydation de l’éthanol en acétaldéhyde.
$\ce{Éthanol + NAD+}$ $\leftrightharpoons$ $\ce{Acétaldéhyde + NADH + H+}$
2. L'acétaldéhyde déshydrogénase (ALDH), EC 1.2.1.10, oxyde l’acétaldéhyde en acétate, puis ce dernier est converti en acétyl-CoA par une acétyl-CoA synthétase (ACSS).
$\ce{Acétaldéhyde + NAD+ + CoA}$ $\leftrightharpoons$ $\ce{Acétyl−CoA + NADH + H+}$
Cette voie permet donc à l’éthanol d’être une source d’acétyl-CoA, notamment dans le foie, où elle peut entrer dans le cycle de Krebs, ou servir à la lipogenèse si l’énergie est en excès.
Remarque : les mêmes enzymes sont retrouvées dans la fermentation alcoolique de la levure dans laquelle le pyruvate est converti en éthanol, et non l’inverse.
Retour à l'acétyl-CoA
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesGlucidesLipidesEnzymesCofacteursCofacteurs d'oxydoréductionCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


