Bioénergétique
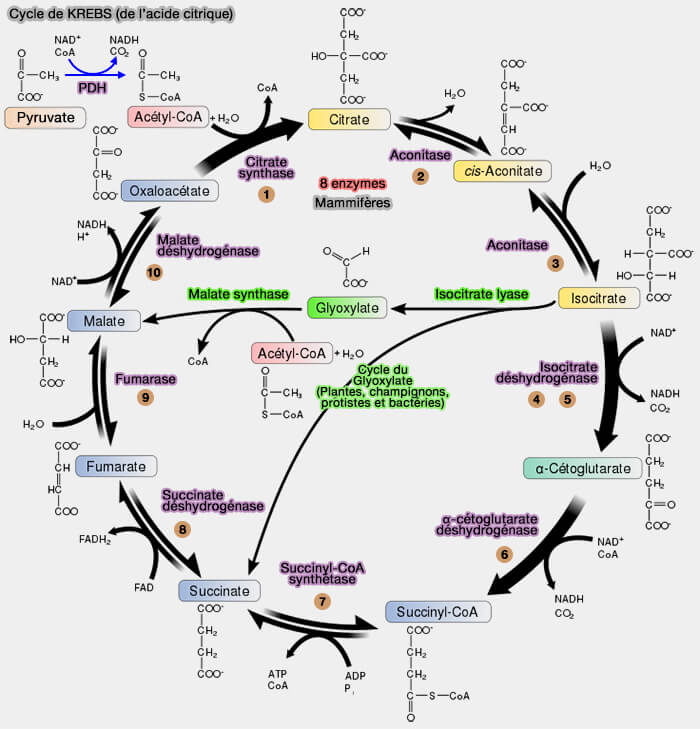
Cycle de Krebs (cycle de l'acide citrique)
Les 10 étapes
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le cycle de Krebs ou cycle de l'acide citrique mitochondrial comprend dix étapes enzymatiques pour permettre l'oxydation complète des groupes acétyles (R-C(=O)-) en CO2, avec production de coenzymes réduits et d’énergie utilisable par la cellule.
(Figure : vetopsy.fr d'après Agrotman)
Étapes 1 à 7 : oxydation et production d’énergie
Les sept premières étapes transforment l’acétyl-CoA (2 carbones) en composés successifs tout en réalisant des oxydations, des décarboxylations et des transferts d’électrons qui permettent de :
- libérer 2 atomes de carbone sous forme de $\ce{CO2}$,
- produire les équivalents réduits NADH et FADH2,
- former une molécule à 4 carbones, le succinyl-CoA, puis le succinate.
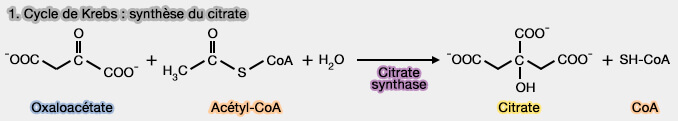
1. Condensation de l'oxaloacétate et du reste acétique en citrate
1. Le citrate est formé par la condensation du carbone du groupe méthyle ($\ce{-CH3}$) du groupe acétyle ($\ce{-C(=O)-CH3}$) de l'acétyl-CoA, avec le groupe carbonyle ($\ce{-C=O}$) ($\ce{C=O}$) de l'oxaloacétate, avec libération de la coenzyme A (CoA).
- La réaction est catalysée par la citrate synthase (CS), EC 2.3.3.1.
- Elle passe par la formation intermédiaire d’un composé instable, le citryl-CoA, qui est ensuite hydrolysé pour donner le citrate final, par la même enzyme.
$\ce{Acétyl-CoA + oxaloacétate + H2O}$ $\longrightarrow$ $\ce{Citrate + CoA+ H+}$
Remarque : la citryl-CoA lyase ( EC 4.1.3.34) n'intervient pas dans le cycle de Krebs des eucaryotes.
2. Cette réaction est pratiquement irréversible ($\Delta G_0'$ =-7 700 cal.mole-1), l'énergie étant apportée par le clivage de la liaison thioester de l'acétyl-CoA.
Elle correspond à l’addition d’un groupement acétyle (2 carbones) à l’oxaloacétate (4 carbones), formant ainsi le citrate, un composé à 6 carbones.
(Figure : vetopsy.fr)
Remarques : l'acétyl-CoA peut être renouvelé dans le cytosol par la navette citrate-malate, i.e. le citrate sortant par le transporteur de citrate (CIC), puis est clivé par l'ATP citrate lyase pour régénérer l'acétyl-CoA et l'oxaloacétate.
Dans la β-oxydation, la même voie permet la sortie de l'acétyl-CoA de la mitochondrie, l'autre voie de sortie des acyl-CoA à longue chaîne étant la navette carnitine.
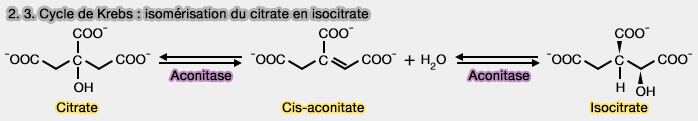
2. et 3. Isomérisation du citrate en isocitrate
1. L'isocitrate est l'isomère du citrate et cette transformation réversible met en jeu deux réactions.
- Le citrate est d'abord déshydraté en cis-aconitate, composé insaturé.
- Le cis-aconitate est ensuite réhydraté en isocitrate, i.e. l’hydroxyle déplacé du carbone C3 au C2, ce qui rend la molécule plus oxydable pour l’étape suivante.
2. Les deux réactions sont catalysées par l'aconitase (EC 4.2.1.3), une lyase qui utilise un cluster métallique fer-soufre [4Fe-4S] chélatant le citrate et facilitant sa transformation.
(Figure : vetopsy.fr)
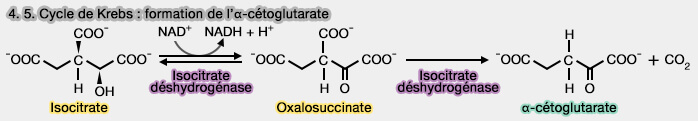
4. et 5. Formation de l'α-cétoglutarate
1. L'α-cétoglutarate est obtenu par décarboxylation oxydative de l'isocitrate qui met en jeu deux réactions catalysées par l'isocitrate déshydrogénase (IDH), i.e. EC 1.1.1.41 à coenzyme nicotinique, i.e. NAD+ ou NADP+ selon l’isoforme.
- L'isocitrate subit une déshydrogénation réversible de la fonction alcool secondaire ($\ce{RR'CHOH}$) en fonction cétone ($\ce{-C=O}$), conduisant à la formation transitoire de l'oxalosuccinate.
- L'oxalosuccinate, restant combiné à l'enzyme, subit ensuite une décarboxylation irréversible en position β du $\ce{CO}$, ce qui provoque la libération de l’α-cétoglutarate.
(Figure : vetopsy.fr)
2. Cette étape limitante et irréversible conduit à un composé à 5 carbones, accompagnée de la libération du premier $\ce{CO2}$ du cycle et de la production du premier NADH.
3. De nombreux tissus eucaryotes possèdent deux isocitrate déshydrogénases.
- L'une à NAD, mitochondriale, oligomérique, est soumise à une régulation allostérique, i.e. activée par l'ADP et inhibée par l'ATP et NADH.
- L'autre à NADP (EC 1.1.1.42) se trouve à la fois dans le cytosol et dans la mitochondrie.
Remarque : l’α-cétoglutarate joue un rôle central dans le métabolisme azoté en participant aux réactions de désamination, notamment via l’enzyme glutamate déshydrogénase qui catalyse la conversion réversible entre glutamate et α-cétoglutarate avec libération ou fixation d’ammoniac (NH3).
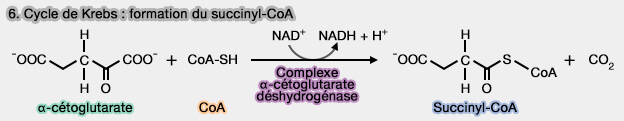
6. Formation du succinyl-CoA
1. L'α-cétoglutarate se transforme en succinyl-CoA par décarboxylation oxydative irréversible, catalysée par le complexe α-cétoglutarate déshydrogénase (α-KGDH).
| Enzyme | Abrev. | Cofacteurs |
|---|---|---|
| α-cétoglutarate déshydrogénase (OGDH ou KGDH) (EC 1.2.4.2 : décarboxylase) |
E1 | Thiamine pyrophosphate (TPP) |
| Dihydrolipoyl/dihyrolipoamide S-succinyltransférase (DLST) (EC 2.3.1.61 : acyltransférase) |
E2 |
|
| Dihydrolipoyl/dihydrolipoamide déshydrogénase (DLD) (EC 1.8.1.4 : oxydo-réductase) |
E3 |
Ce complexe est comparable au complexe pyruvate déshydrogénase (PDH), qui comporte aussi trois enzymes, i.e. (
- E1 ou pyruvate déshydrogénase,
- E2 ou dihydrolipoyl/dihydrolipoamide acétyltransférase, qui transporte un acétyle au lieu d'un succinyle,
- E3 ou dihydrolipoyl/dihydrolipoamide déshydrogénase, i.e. la même enzyme,
Remarque : les 5 cofacteurs sont identiques.

Les réactions de la PDH sont étudiées dans un chapitre spécial.
(Figure : vetopsy.fr)
2. À ce niveau du cycle, on arrive au stade des composés à 4 carbones.
Remarque : le succinyl-CoA peut être aussi produit par la β-oxydation des acides gras impairs par l'intermédiaire du propionyl-CoA.
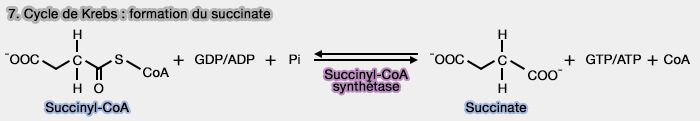
7. Formation du succinate
1. La formation du succinate à partir du succinyl-CoA, réaction réversible, est catalysée par la succinyl-CoA synthétase (SCS), ligase (SUCL) ou succinate thiokinase avec phosphorylation concomitante :
- d'une molécule de GDP en GTP par une GDP-forming succinate-CoA ligase (G-SUCL ou EC 6.2.1.4),
$\ce{Succinyl-CoA + GDP + Pi}$ $\leftrightharpoons$ $\ce{Succinate + CoA + GTP}$
- d'une molécule d'ADP en ATP par une ADP-forming succinate-CoA ligase (A-SUCL ou EC 6.2.1.5).
$\ce{Succinyl-CoA + ADP + Pi}$ $\leftrightharpoons$ $\ce{Succinate + CoA + ATP}$
a. Les deux isoformes possèdent une sous-unité α (commune aux deux formes), mais une sous-unité β spécifique à la forme GDP ou ADP qui détermine le NTP (nucléotide triphosphate) utilisé.
b. La cellule adapte son métabolisme selon ses besoins énergétiques et fonctionnels des tissus (Expression of Two Succinyl-CoA Synthetases with Different Nucleotide Specificities in Mammalian Tissues 2004).
- Le GDP est utilisé dans le foie et les reins, où il est plus utile pour certaines réactions métaboliques spécifiques, comme la gluconéogenèse hépatique.
- L'ATP est le NTP exprimé dans les muscles squelettiques et le coeur, l’ATP produit pouvant être immédiatement disponible pour les besoins énergétiques de la contraction musculaire.
2. la SCC pourrait contribuer au maintien d’un faible niveau d’ATP même en absence temporaire d’activité de la chaîne respiratoire, par exemple en hypoxie.
Cela souligne l’importance de la phosphorylation au niveau du substrat comme source d’ATP indépendante de l’oxygène.
Remarque : le malonate, analogue structural du succinate, peut inhiber la SCS de façon compétitive, possiblement en agissant sur le site de fixation du succinyl-CoA ou du succinate.
- Il interfère aussi avec la succinate déshydrogénase du complexe II de la chaîne respiratoire.
- Le malonate est également un précurseur dans la synthèse des acides gras mitochondriaux.
La malonate est également un précurseur dans la synthèse des acides gras mitochondriaux.
(Figure : vetopsy.fr)
2. La formation de GTP (ou ATP) par la succinyl-CoA synthétase implique une phosphorylation transitoire de l’enzyme sur un résidu histidine du site actif.
Il s’agit d’une phosphorylation liée au substrat, c’est-à-dire indépendante de la chaîne respiratoire.
3. À ce stade du cycle,
- deux atomes de carbone ont été oxydés en $\ce{CO2}$, issus du groupement acétyl initial,
- le métabolisme entre dans la phase des acides dicarboxyliques à 4 carbones (C4).
4. Le reste du cycle a pour but de régénérer l'oxaloacétate, en trois étapes.
Remarque : le succinate peut également intervenir en dehors du cycle de Krebs, notamment comme partie de l'adénylosuccinate, un intermédiaire de la synthèse de l'AMP à partir de l'IMP.
Étapes 8 à 10 : régénération de l’oxaloacétate
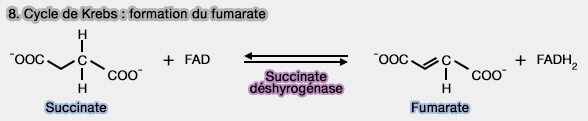
8. Formation du fumarate
1. La formation du fumarate est obtenue par la déshydrogénation du succinate, réaction catalysée par la succinate déshydrogénase (SDH), EC 1.3.5.1., i.e. déshydrogénation stéréospécifique conduisant exclusivement à l'isomère trans, i.e. fumarate, et non à l’isomère cis, i.e. maléate.
Cette réaction correspond à une oxydation : le succinate (forme réduite) est converti en fumarate (forme oxydée).
2. La SDH, appelée aussi complexe respiratoire II ou succinate-coenzyme Q réductase (SQR), a deux particularités.
a. Contrairement aux autres enzymes du cycle de Krebs qui sont solubles dans la matrice mitochondriale, la SDH est intégrée à la membrane mitochondriale interne (IMM) des eucaryotes.

La SDH est la seule enzyme qui participe à la fois au cycle de Krebs et à la chaîne de transport des électrons, i.e. chaîne respiratoire.
2. C'est la seule enzyme membranaire du cycle de Krebs qui utilise FAD (flavine adénine dinucléotide) comme cofacteur oxydant, plutôt que le NAD+.
- Cela s’explique par le fait que cette réaction n’est pas suffisamment exergonique pour permettre la réduction du NAD+ en NADH, qui nécessite un potentiel d’oxydoréduction plus élevé.
- Le FAD, fixé de manière covalente à l’enzyme, peut accepter des électrons dans des conditions énergétiquement moins favorables, ce qui permet sa réduction en FADH2.
(Figure : vetopsy.fr)
2. La SDH, à structure complexe, comprend quatre sous-unités.

Le complexe II est étudié dans un chapitre spécial.
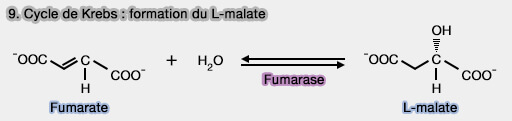
9. Formation du L-malate
La formation du L-malate est obtenue par l'hydratation réversible du fumarate, addition stéréospécifique d’une molécule d’eau sur la double liaison trans du fumarate, réaction catalysée par la fumarase ou fumarate hydratase (EC 4.2.1.2).
(Figure : vetopsy.fr)
Remarque : le malate a aussi un rôle important dans :
- la navette citrate-malate, i.e. série de réactions chimiques qui transporte indirectement l’acétyl-CoA depuis la mitochondrie vers le cytosol, où se déroule la synthèse des acides gras,
- la navette malate-aspartate qui assure le transfert d'électrons des électrons du NADH cytosolique produit par la glycolyse vers la chaîne respiratoire mitochondriale, i.e. du cytosol vers la mitochondrie.
10. Reformation de l'oxaloacétate
1. Le L-malate est déshydrogéné pour reformer l'oxaloacétate, qui entre dans l'étape 1 du cycle de Krebs, par la malate déshydrogénase (MDH), i.e. EC 1.1.1.37.
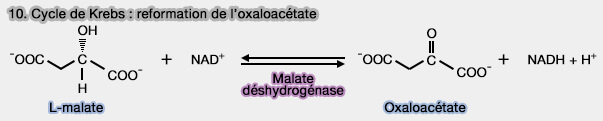
(Figure : vetopsy.fr)

L'oxaloacétate est étudié dans un chapitre spécial.
2. Le cycle recommence parce que l'oxaloacétate est continuellement utilisé.
Bilan et régulations du cycle de Krebs
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


