Bioénergétique
Réactions d'oxydoréduction
Vue d'ensemble
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Une réaction d'oxydoréduction ou réaction rédox est une réaction chimique au cours de laquelle se produit un transfert d'électrons, i.e. une réaction d'oxydation, i.e. perte d'électrons, est couplée à une réaction de réduction, i.e. gain d'électrons.
Vue d'ensemble
1. Les combustions de la chimie minérale, i.e. oxydoréductions, ne sont pas possibles dans le monde vivant car l'élévation de température serait trop nocive.
- Les métabolites cellulaires ne sont pas directement oxydables par $\ce{O2}$.
- Par exemple, la formation de $\ce{H2O}$, par la réaction $\ce{H2 + 1/2O2}$ $\longrightarrow$ $\ce{H2O}$, qui correspond à un passage du E'o de - 0,42 V à + 0,81 V, libérerait une énergie élevéelibère une énergie de 56 580 calories par mol-g.

Dans l'organisme, les processus biologiques doivent s'effectuer à température constante.
2. Les oxydations ou les réductions doivent donc passer par des étapes dans lesquelles l'énergie libérée est conservée partiellement sous forme d'énergie chimique (
- soit exergoniques, i.e. avec libération d'énergie, réactions spontanées commes la plupart des réactions de dégradation des métabolites,
- soit endergoniques, i.e. avec absorption d'énergie, et qui nécessitent alors un apport énergétique par une réaction exergonique, comme la pluspart des réactions de synthèse des métabolites
3. L'oxydation est une perte d'électrons, la réduction est un gain d'électrons, i.e.les électrons sont étudiés dans un chapitre spécial.
a. L'hydrogène étant très fortement nucléophile (électropositif), il passe plus de temps dans le voisinage des autres atomes de la molécule à laquelle appartient l'hydrogène.
- Son électron peut être facilement cédé avec lui.
- La molécule qui perd des électrons est appelé donneur d'électrons ou réducteur et, après cette réaction, il se retrouvera oxydé.
$\ce{H2 - 2e-}$ $\longrightarrow$ $\ce{2H+}$
b. A l'opposé, l'oxygène est très électrophile (électronégatif), de sorte que lorsque l'oxygène se lie à d'autres atomes, les électrons partagés passent la majeure partie du temps dans le voisinage de l'oxygène.
La molécule qui gagne les électrons transférés est appelé accepteur d'électrons ou oxydant et, après cette réaction, il se retrouvera réduit.
$\ce{1/2O2 + 2e-}$ $\longrightarrow$ $\ce{O2-}$
c. L'oxydation de $\ce{H2}$ par l'oxygène moléculaire $\ce{O2}$ se représente alors ainsi :
$\ce{H2 + 1/2O2}$ $\longrightarrow$ $\ce{H2O}$

On emploie le terme de système d'oxydoréduction car un corps ne peut s'oxyder qu'aux dépens d'un autre qui se réduit, et inversement.
Remarque : un moyen mnémotechnique utilise les voyelles et les consonnes : réducteur = donneur, oxydant = accepteur.
Système redox
Généralités
Comme l'$\ce{O2}$ a été le premier étudié, l'oxydation était considérée comme un gain d'oxygène, la réduction comme l'extraction d'$\ce{O2}$ du métabolite.
1. Cependant, d'autres atomes peuvent remplacer l'$\ce{O2}$ comme accepteur d'électron, comme par exemple :
- le chlore (Cl), $\ce{2Cl3Fe + Cl2Sn}$ $\longrightarrow$ $\ce{2Cl2Fe + Cl4Sn}$, i.e. $\ce{Fe+++}$ $\longrightarrow$ $\ce{Fe++}$,
- l'ode (I), $\ce{I2 + SH2}$ $\longrightarrow$ $\ce{2IH + S}$, i.e. $\ce{I}$ $\longrightarrow$ $\ce{I-}$,
- le cuivre (Cu), $\ce{CuO + H2}$ $\longrightarrow$ $\ce{Cu + H2O}$, i.e. $\ce{Cu++}$ $\longrightarrow$ $\ce{Cu}$,
- …
2. De même, d'autres atomes peuvent remplacer l'$\ce{H2}$ comme donneur d'électron comme par exemple :
- le chlore (Cl), $\ce{2Cl2Fe + Cl}$ $\longrightarrow$ $\ce{2Cl3Fe}$, i.e. $\ce{Fe++}$ $\longrightarrow$ $\ce{Fe+++}$,
- $\ce{R1-CH2-CH2-R2}$ $\longrightarrow$ $\ce{R1-CH=CH-R2 = 2e-}$, cas spécial par la création d'une double liaison,
- …
3. Ainsi de manière générale, on peut écrire, Réd étant le réducteur et Ox l'oxydant :
$\ce{Réd}$ $\leftrightharpoons$ $\ce{Ox + ne-}$
Conséquences
1. Daprès les exemples ci-dessus, on voit que le caractère oxydant ou réducteur est relatif dans le cadre d'une réaction chimique.
Un élément réducteur dans une réaction peut être oxydant dans une autre, i.e. comme le chlore (Cl) par exemple.
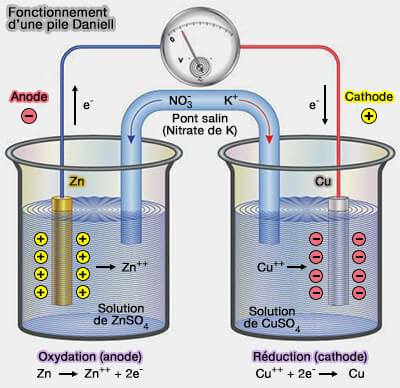
(Figure : vetopsy.fr)
2. Le déplacement de l'équilibre d'un tel système dépend de la concentration en électrons, i.e. un apport d'électrons provoquera le déplacement de l'équilibre vers la réduction du système et inversement.
- Par exemple, le pH pourra intervenir dans ce contexte par la libération des $\ce{H+}$.
- Mais aussi, le contexte physique peut influencer le processus comme dans le cas de l'étape dépendante de la lumière de la photosynthèse :
$\ce{2H2O + NADP+ + 3ADP + 3Pi + photons}$ $\longrightarrow$ $\ce{2NADPH + 2H+ +3ATP + O2}$
3. En présence de 2 systèmes d'oxydoréduction, celui qui sera le plus riche en électrons provoquera la réduction de l'autre, en même temps qu'il se trouvera lui-même oxydé.
a. Le système réduit gagne de l'énergie par le transfert des électrons riches en énergie du système oxydé, i.e. il subit une augmentation de son énergie libre (de Gibbs).
b. Le système oxydé perd de l'énergie, i.e. i.e. il subit une diminution de son énergie libre.
c. Les potentiels redox expriment donc des niveaux d'énergie et peuvent renseigner sur les variations d'énergie libre au cours des transformations.
$\Delta G_0 = -nF\Delta E_0$ dans laquelle :
- n est le nombre des électrons qui interviennent dans la réaction d'oxydo-réduction,
- F la constante de Faraday.

Lorsque les combustibles alimentaires sont oxydés (dégradés), l'énergie qu'ils perdent est transférée à une molécule qui va la transmettre à une autre, d'où le nom de chaîne respiratoire, pour, qu'à la fin, cette énergie soit transférée à l'ADP pour former des molécules d'ATP riches en énergie (
Potentiel rédox
Le potentiel d'oxydoréduction (ou potentiel redox) d'un système d'oxydoréduction est la différence de potentiel E qui s'établit entre une électrode plongeant dans ce système et une électrode standard de référence dite à hydrogène.

Le potentiel redox est étudié dans un chapitre spécial.
Enzymes et coenzymes
1. Les réactions d'oxydoréduction sont catalysées par des enzymes qui sont appelées oydoréductases, EC 1.x.x.x réparties en 21 sous-classes :
- Les déhydrogénases retirent l'hydrogène.
- Les oxygénases transfèrent l'oxygène, i.e. EC 1.13.x.x ou 1.14..x.x.
2. La plupart de ces enzymes requièrent l'aide d'une coenzyme spécifique, typiquement dérivée d'une vitamine du groupe B.
Les enzymes et les coenzymes sont retrouvées intactes à la fin de la réaction et peuvent donc participer à de nouvelles réactions.
a. Les déshydrogénases ne sont pas des accepteurs d'hydrogène, ce qui n'est pas le cas de leurs coenzymes.
Les coenzymes peuvent capter temporairement les atomes d'hydrogène libérés et sont donc réduites et le substrat est oxydé.
b. Deux coenzymes très importantes des voies oxydatives sont :
- NAD (nicotinamide adénine dinucléotide), dérivé de la niacine (PP-nicotinamide), NADH étant la forme réduite de NAD+, forme oxydée.
- FAD (flavine adénine dinucléotide), dérivée de la riboflavine (vitamine B2).

La respiration cellulaire et la chaîne respiratoire sont étudiées dans des chapitres spéciaux.
Retour à la bioénergétique
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


