Bioénergétique : composés " riches en énergie "
Composés à liaison phosphate
ATP : phosphorylation oxydative
ATP synthase : vue d'ensemble
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'ATP synthase ou F1FO-ATPase est une protéine transmembranaire dont le rôle principal est de synthétiser l'adénosine triphosphate (ATP) à partir du gradient électrochimique de protons entretenu par la chaîne respiratoire.
L'ATP synthase est considérée quelquefois comme le complexe V de la chaîne respiratoire.
(Figure : vetopsy.fr)
Chez les eucaryotes, ce processus est localisé en totalité dans les mitochondries, au niveau de la membrane interne (IMM).
Vue d'ensemble
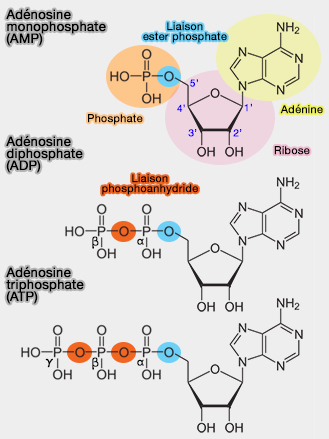
L'ATP (adénosine triphosphate) est un nucléoside triphosphate composé par :
- 1. une base azotée, ici une base purique, l'adénine,
- 2. un pentose, sucre à 5 carbones, le ribose,
- 3. trois groupes phosphate.

L'ATP, appartenant aux composés " riches en énergie " par sa liaison phosphoanhydride (ou pyrophosphate), est la principale source d'énergie de la cellule.
1. On distingue deux sortes de phosphorylations de l'ADP en ATP :
- la phosphorylation oxydative,
- la phosphorylation au niveau du substrat, qui ne fait pas intervenir l'ATP synthase.
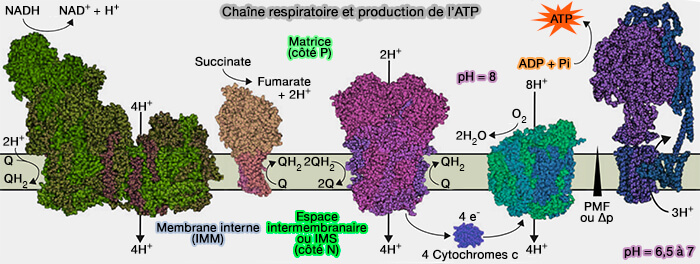
2. Dans des conditions aérobies, le gradient électrochimique (driving force) des protons $\ce{H+}$, généré au travers la membrane mitochondriale interne (IMM) par la chaîne respiratoire, fournit l'énergie nécessaire à l'ATP synthase, i.e. EC 7.1.2.2, pour phosphoryler l'ADP en ATP (Mitochondrial F1FO ATP synthase determines the local proton motive force at cristae rims 2021).
$\ce{ADP + Pi + 2H+_{\;out} -> ATP + H2O + 2H+_{\;in}}$
(Figure : vetopsy.fr)
3. Chez les eucaryotes, les ATP synthases constituent environ 15 % des protéines de la membrane mitochondriale interne (IMM).
Les ATP synthases font partie des F-ATPases, appelées aussi F1FO-ATPases.
a. Chez les procaryotes, l’ATP synthase est localisée à la membrane plasmique.
- De nombreuses bactéries utilisent les ATP synthases en sens inverse, i.e. ATP ➞ ADP, en anaérobie, et utilisent l'énergie libérée pour transférer les protons hors du cytoplasme bactérien.
- Elle produit ainsi une force motrice des protons (PMF ou Δp) qui génère ensuite d'autres fonctions cellulaires essentielles, i.e. chimiotactisme, transport membranaire…
- Elle joue ainsi le rôle de la V-ATPase qui présente une structure similaire.
En revanche, les activités hydrolytiques de l'ATP des ATP synthases des mitochondries, des chloroplastes et de certaines bactéries ne peuvent synthétiser que l'ATP bien que leurs activités d'hydrolase puissent être activées artificiellement in vitro.
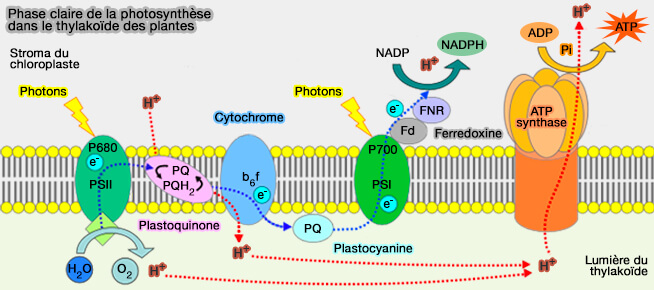
b. Les organismes capables de photosynthèse ont également de l’ATP synthase à travers la membrane thylakoïde, qui chez les plantes est située dans les chloroplastes et chez les cyanobactéries dans le cytoplasme (
(Figure : vetopsy.fr d'après Somepics)
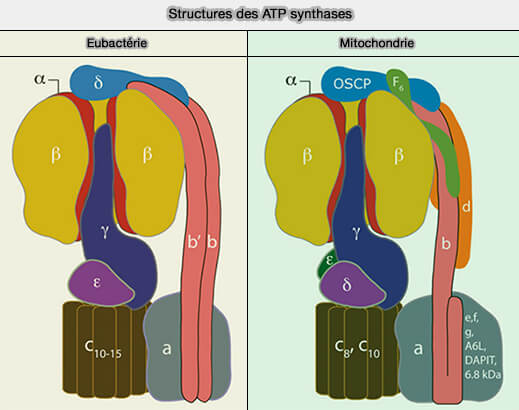
Structure générale de l'ATP synthase
(Figure : vetopsy.fr d'après Walker)

Vous pouvez lire : Structure of the human ATP synthase (2023).
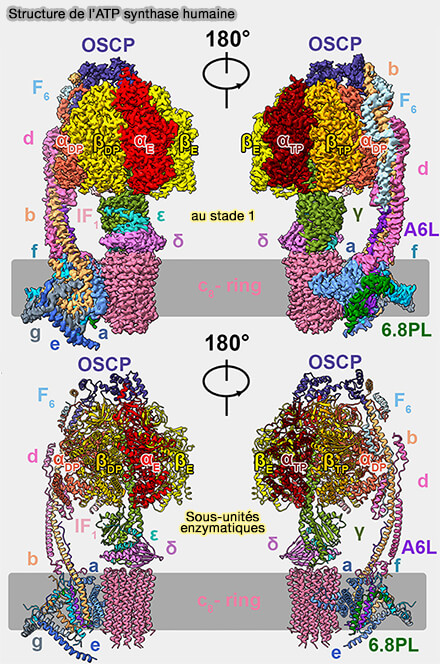
(Figure : vetopsy.fr d'après Lai et coll)
Les ATP synthases sont des machines macromoléculaires, constituées de deux moteurs, qui sont formées de deux régions principales.
- F1, la partie catalytique, est responsable de la synthèse de l'ATP à partir de l'ADP et de Pi baignant dans la matrice mitochondriale, qui provoque des rotations.
- FO, partie incorporée dans la membrane mitochondriale interne (IMM), est un moteur alimenté par la force motrice des protons (PMF ou Δp) qui génère également une rotation.
F1 et FO sont liées par :
- une tige centrale qui s'oppose à l'action l'un de l'autre,
- une tige périphérique qui les rend relativement immobiles l'un par rapport à l'autre.
Un monomère d’ATP synthase humaine se compose de 29 chaînes polypeptidiques de 18 sous-unités différentes, y compris une protéine régulatrice IF1, avec une masse moléculaire combinée de 592 kDa (Assembly of the membrane domain of ATP synthase in human mitochondria 2018).
Chez les mammifères, les monomères ATPase s’associent en dimères, formant de longues rangées, influençant la formation de crêtes caractéristiques mitochondriales qui changent constamment de forme (Structure of the dimeric ATP synthase from bovine mitochondria 2020).
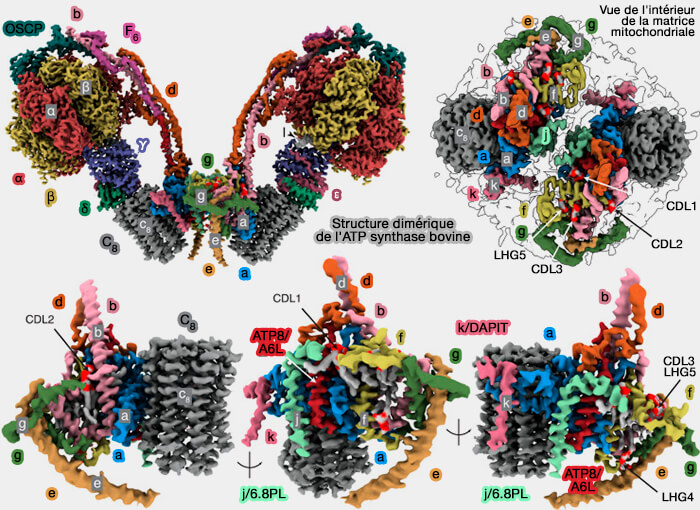
(Figure : vetopsy.fr d'après Spikes et coll)
Structure de la région F1 de l'ATP synthase
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


