Bioénergétique
Chaîne respiratoire : chaîne de transfert d'électrons
Vue d'ensemble
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Une chaîne de transport d'électrons est une série de complexes protéiques et d'autres molécules qui transfèrent des électrons des donneurs d'électrons aux accepteurs d'électrons via des réactions d'oxydoréduction (redox) et couplent ce transfert d'électrons avec le transfert de protons (H+) à travers une membrane.
Vue d'ensemble

Lorsque la variation d'énergie libre d'un système, i.e. $\Delta G_0'$, est élevée, la réaction brutale et irréversible est incompatible avec la vie cellulaire à cause des variations brutales de température.
1. Or, dans l'organisme, les processus biologiques doivent s'effectuer à température constante.
L'organisme a donc recours non pas à des réactions brutales d'oxydation ou de réduction, mais à des réactions d'oxydoréduction (redox) qui vont permettre un transfert progressif de l'énergie dans des systèmes réversibles dont les E'o sont intermédiaires et voisins les uns des autres (
1. Ainsi, les glucides ou des lipides, les deux nutriments énergétiques, doivent subir plusieurs réactions chimiques dans le cytosol et dans la matrice mitochondriale pour créer du NADH et du FADH2.
a. La première est la coupure des molécules plus ou moins complexes par étapes pour produire des composés bicarbonés, en particulier le groupe acétyl $\ce{CH3-C(=O)-}$) sous forme d'acétyl-CoA en provenance :
- soit du glucose dans le cytosol, par l'intermédiaire du pyruvate (
glycolyse et biosynthèse de l'acétyl-CoA par le complexe PDH),
- soit des acides gras à la suite de la β-oxydation.
b. La deuxième est la dégradation de cet acétyl-CoA par étapes comme dans le cycle de Krebs qui permet :
- la formation de $\ce{CO2}$, i.e. carbone oxydé.
- l'élimination de l'hydrogène des substrats par les déshydrogénases, $\ce{H+}$ représentant la forme oxydée, est pris en charge par des coenzymes d'oxydo-réduction.
$\ce{Acétyl-CoA + 2H2O + 3NAD+ + FAD + GDP + Pi}$
$\longrightarrow$ $\ce{2CO2 + 3(NADH + H+) + FADH_2 + GTP + CoA}$
c. L’énergie des réactions d’oxydoréduction crée un gradient électrochimique de protons qui entraîne la synthèse de l’ATP (adénosine triphosphate).
- Dans la respiration aérobie, les électrons, transportés à leur tour jusqu'à l'oxygène, l'activent de façon à ce qu'il se combine aux protons $\ce{H+}$ pour former de l'eau $\ce{H2O}$, produit d'oxydation terminal de l'hydrogène.
- Dans la respiration anaérobie, d’autres accepteurs d’électrons sont utilisés comme le sulfate.

Le flux d’électrons à travers la chaîne de transport d’électrons est un processus exergonique qui a lieu dans la membrane mitochondriale interne (IMM).
Remarque : NADH doit passer dans la matrice mitochondriale grâce à deux navettes différentes selon les organes :
- la navette malate-aspartate dans le foie, les reins et le muscle cardiaque,
- la navette glycérol phosphate, dans les muscles ou le cerveau.
Transporteurs de la chaîne respiratoire
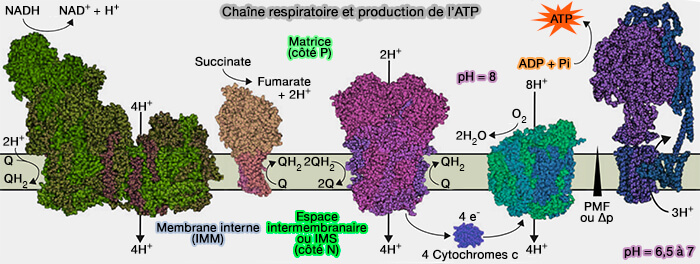
(Figure : vetopsy.fr)
Principe
1. Les transporteurs forment une chaîne de réactions.
- RH2, le donneur d'électron initial, cède son hydrogène H+ à un premier transporteur, qui passe sous forme réduite.
- Ce transporteur sert de donneur d'hydrogène vis-à-vis d'un deuxième transporteur, qui le cédera ensuite à un troisième transporteur…
a. Ces centres redox sont formés de groupes prosthétiques comme les hèmes, les centres Fe-S, les flavines (FMN, FAD), les cytochromes et l'ubiquinone ou coenzyme Q, qui ont des affinités différentes pour les électrons en fonction de leur configuration.
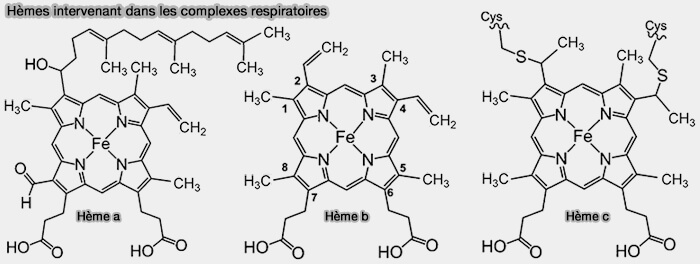
(Figure : vetopsy.fr)
b. Ce transfert s'effectue d'un centre redox supérieur de faible activité vers un centre redox inférieur de forte activité.
La distance entre les différents centres est telle que le saut d'électrons ne peut se faire que sur le centre inférieur.

À chaque saut d'électron, une petite quantité d'énergie est libérée pour permettre le pompage des protons.
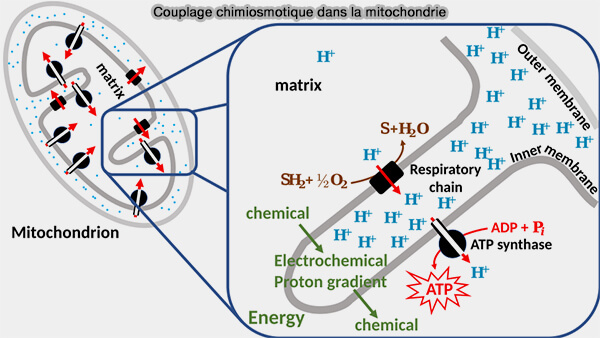
(Figure : vetopsy.fr d'après Chiswick Chap)
2. Le transfert d'électrons entre un donneur et un accepteur plus électronégatif libère de l'énergie, utilisée pour pomper des protons de la matrice mitochondriale, ou côté N pour négatif, dans l'espace intermembranaire (IMS), ou côté P pour positif, ce qui génère un gradient électrochimique à travers la membrane mitochondriale interne (IMM) qui correspond à la force proton-motrice (driving force) de la phosphorylation oxydative.
- Ce gradient électrochimique est ensuite utilisé par l'ATP synthase pour produire de l'ATP.
- La chaîne respiratoire et la phosphorylation de l'ADP en ATP par l'ATP synthase sont couplées par chimiosmose au moyen d'un gradient de concentration d'ions H+ à travers la membrane interne de la mitochondrie.

La chimiosmose et la phosphorylation oxydative, ainsi que l'ATP synthase sont étudiées dans des chapitres spécifiques.
3. Le transfert progressif de l'énergie s'effectue dans des systèmes réversibles situés dans l'IMM, les complexes I à IV, qui sont volumineux et immobiles, ainsi que deux transporteurs d'électrons mobiles, i.e. l'ubiquinone ou coenzyme Q (Q10 chez l'homme) et le cytochrome c.
a. Ces complexes sont situés dans la membrane mitochondriale interne (IMM).
b. Leurs E'o sont intermédiaires et voisins les uns des autres, valeurs décroissantes de E'o pour les réductions et croissantes pour les oxydations.
- Les complexes I, III et IV pompent directement les protons de la matrice mitochondriale dans l'IMS.
- Le complexe II ne fait que transporter les électrons et aide les complexes III et IV à pomper les protons.
Remarque : l'ATP synthase est souvent qualifiée de complexe V.

Les potentiels standard peuvent légèrement varier selon les publications, mais l'ordre de la chaîne respiratoire reste identique.
| Complexe | Enzyme respiratoire | Couple rédox | Potentiel standard (E'0) |
|---|---|---|---|
| Référence | 2H+ / H2 | - 0,42 V | |
| I | NADH déshydrogénase | − 0,32 V | |
| Milieu anaérobie | - 0,20 V | ||
| II | Succinate déshydrogénase | − 0,20 V | |
| Milieu aérobie | - 0,05 V | ||
| III | Cytochrome c réductase | Coenzyme Qox /QH2 | + 0,06 V |
| Cytochrome box /Cytochrome bred | + 0,12 V | ||
| IV | Cytochrome c oxydase | Cytochrome cox /Cytochrome cred | + 0,22 V |
| Cytochrome aox /Cytochrome ared | + 0,29 V | ||
| O2 / OH- | + 0,82 V | ||
| Conditions : pH = 7 | |||
4. Des différences caractérisent l'équilibre dynamique stationnaire de l'ensemble de la chaîne.
- Le système FAD/FADH2 se trouve sensiblement au niveau de son potentiel de demi-réduction, i.e. les formes Ox et Réd seront en égales quantités.
- Le système NAD+/NADH a en permanence un excès de forme réduite, i.e. NADH.
- Pour les autres systèmes, un excès des formes oxydées est d'autant plus marqué que le E'o sera plus élevé.
5. Les complexes sont formés de nombreuses protéines qui sont codées par l'ADN nucléaire, mais aussi par l'ADN mitochondrial (ADNmt) qui ne code que pour 13 protéines, toutes impliquées dans la phosphorylation oxydative :
- sept dans le complexe I (NADH déshydrogénase),
- une dans le complexe III (cytochrome c réductase ou complexe bc1),
- trois dans le complexe IV (CcO),
- deux dans l'ATP-synthase.
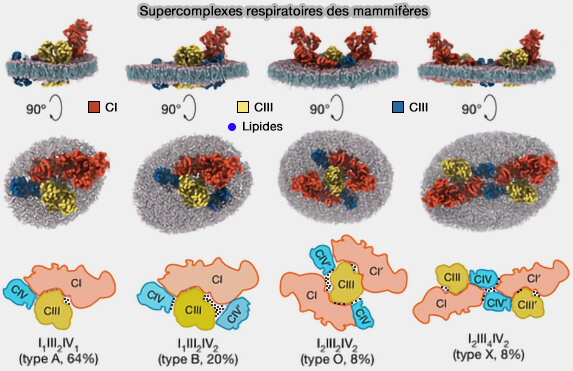
(Figure : vetopsy.fr d'après Zheng et coll)
6. De plus, la formation de supercomplexes avec d’autres complexes de phosphorylation oxydative s’est avérée être largement variable, comme, par exemple, I–II–III2-IV1, I–II–III2-IV2, I2–II–III2-IV2 et I2–II–III4-IV2 (High-resolution in situ structures of mammalian respiratory supercomplexes 2024).
(Vidéo : Harward Online)
Complexe I de la chaîne respiratoire
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


