Bioénergétique
Chaîne respiratoire : chaîne de transfert d'électrons
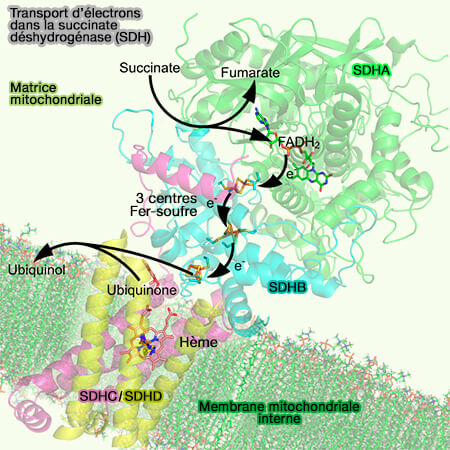
Complexe II, succinate déshydrogénase (SDH) ou succinate-coenzyme Q réductase (SQR)
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le complexe II de la chaîne respiratoire, succinate déshydrogénase (SDH) ou succinate-coenzyme Q réductase (SQR), est une oxydoréductase membranaire qui permet le transfert de 2 électrons à l'ubiquinone (Q) ou coenzyme Q.
(Vidéo : Harward Online)
Vue d'ensemble du complexe II de la chaîne respiratoire

Vous pouvez lire plusieurs articles dans : An evolving view of complex II-noncanonical complexes, megacomplexes, respiration, signaling, and beyond (2023).
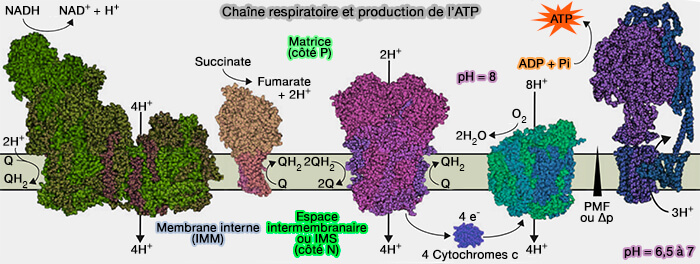
(Figure : vetopsy.fr)
Le complexe II constitue le deuxième point d'entrée des électrons à haut potentiel de transfert dans la respiration cellulaire, le premier étant le complexe I,
1. Le complexe II, succinate déshydrogénase (SDH) ou succinate-coenzyme Q réductase (SQR), i.e. EC 1.3.5.1, est une oxydoréductase membranaire de la chaîne respiratoire qui catalyse la réaction :
$\ce{Succinate + coenzyme Q_10}$ $\leftrightharpoons$ $\ce{Fumarate + coenzyme Q_10H_2}$
Le complexe humain II est un complexe protéique clé qui relie deux processus électrogènes essentiels (The assembly of succinate dehydrogenase: a key enzyme in bioenergetics 2019) :
- le cycle de Krebs, lors de la réaction 8 (
formation du fumarate),
- la phosphorylation oxydative.
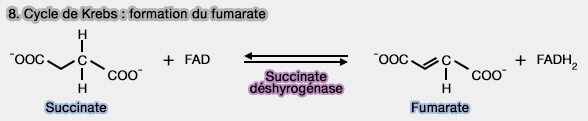
(Figure : vetopsy.fr)
2. FADH2, la forme réduite de FAD (Flavine Adénine Dinucléotide), apporte 2 électrons à haute énergie au complexe II qui les transporte de la matrice mitochondriale dans l'espace intermembranaire (IMS), via 3 centres redox, contre 8 pour le complexe I.
Le cycle isoalloxazine, l'accepteur d'électron, est le même que celui de la FMN (Flavine MonoNucléotide).
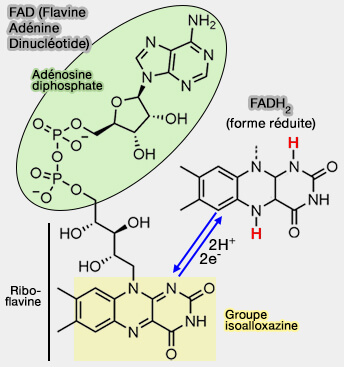
(Figure : vetopsy.fr)
3. Le dernier complexe redox, i.e. cluster [3Fe-4S], donne deux électrons à l'ubiquinone (Q) ou coenzyme Q dissoute dans la bicouche lipidique pour la réduire en QH2 (ubiquinol).

$\Delta G_0'$ est faible et ne permet pas le pompage de protons de la matrice vers l'espace intermembranaire.
Structure du complexe II

Vous pouvez lire : Structure of the human respiratory complex II (2023).
La plupart des complexes II mitochondriaux (SDH) et bactériens sont composés de quatre sous-unités structurellement différentes.
1. Les deux sous-unités hydrophiles, dans lesquelles se déroule l’activité enzymatique du complexe, sont formées de deux sous-unités.
a. SDHA, une flavoprotéine, contient un FAD attaché de manière covalente et le site de liaison du succinate.
- Le site actif pour l'interconversion succinate-fumarate est situé à l'interface entre le domaine de liaison FAD et le domaine de coiffe.
- Les mitochondries humaines contiennent deux isoformes distinctes de SDHA (sous-unités Fp de type I et de type II).
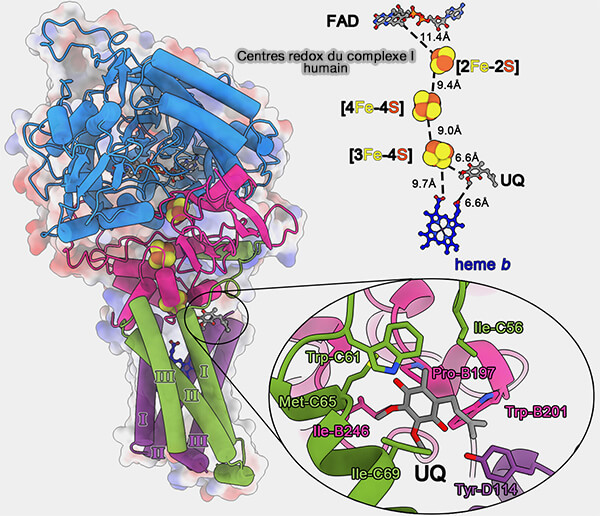
b. SDHB est une petite protéine qui contient trois clusters fer-soufre : [2Fe-2S], [4Fe-4S] et [3Fe-4S], organisée en deux domaines qui forment les ailes d'un papillon.
- Le cluster [2Fe-2S] est coordonné par une boucle située dans le domaine N-terminal.
- Les clusters [4Fe-4S] et [3Fe-4S] sont assemblés sur le domaine C-terminal.
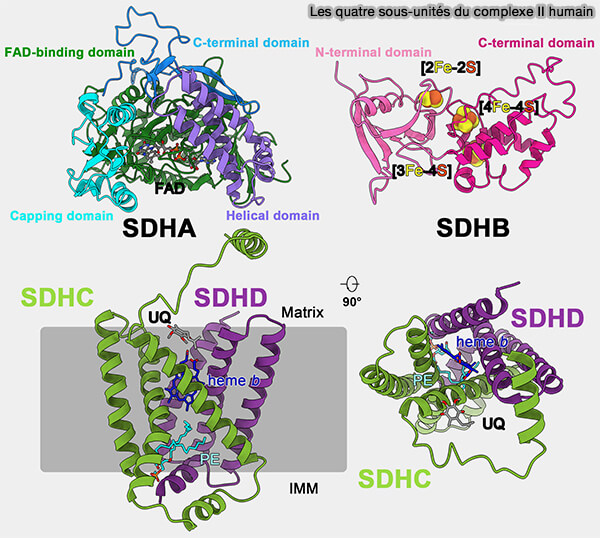
(Figure : vetopsy.fr d'après Du et coll)
2. Les deux sous-unités hydrophobes (SDHC et SDHD) ancrent le complexe à la membrane, chacune avec trois hélices transmembranaires à pli similaire.
a. SDHC et SDHD forment un complexe membranaire contenant un hème b et un site de liaison à l’ubiquinone.
b. Une phosphatidyléthanolamine (PE) est localisée du côté de la membrane interne mitochondriale (IMM), entre les sous-unités SDHC et SDHD pour occuper l’espace hydrophobe sous l’hème b et permettre la stabilité conformationnelle du CII humain au niveau moléculaire.
Chez E. coli, on trouve une cardiolipine à cette même position.
(Figure : vetopsy.fr d'après Zéphyris)
c. En outre, le cofacteur hème est également crucial pour que la protéine hème atteigne son pli approprié et devienne ainsi une structure fonctionnelle stable (Computationally Guided Redesign of a Heme-Free Cytochrome with Native-like Structure and Stability 2022).
Mécanisme du complexe II
Le mécanisme du complexe II est comparable à celui du complexe I.
1. Le transport se fait comme suit :
FADH2 ➞ [2Fe-2S] ➞ [4Fe-4S] ➞ 3[Fe-4S] ➞ hème b
La distance bord à bord entre ces centres redox est inférieure à 14 Å, i.e. distance qui peut soutenir efficacement le saut d'électron.
2. L'ubiquinone (Q) ou coenzyme Q est liée à l'entrée de la poche formée par l'hélice transmembranaire I de la SDHC, l'hélice transmembranaire II de la SDHD, et le segment C-terminal du SDHB.
3. Le mécanisme est encore obscur car l'hème b n'est ni une exigence structurelle, ni une condition essentielle pour la réduction de la quinone, et en plus, une fois l'hème b réduit, il peut aussi à son tour réduire l'ubiquinone en ubiquinol.
L'hème b est donc proposé pour servir d'intermédiaire dans la voie de transfert d'électrons (Structural and Computational Analysis of the Quinone-binding Site of Complex II (Succinate-Ubiquinone Oxidoreductase 2006).
- La quinone recevrait probablement le premier électron du cluster [3Fe-4S] pour former la semiquinone.
- Le radical semiquinone serait stabilisé par une équilibration électronique rapide entre l'hème b et l'ubiquinone (The Quinone Binding Site in Escherichia coli Succinate Dehydrogenase Is Required for Electron Transfer to the Heme b 2006).
- La semiquinone accepterait un deuxième électron pour compléter la réduction complète, qui est transportée soit de l'hème b, soit du cluster [3Fe-4S].
(Figure : vetopsy.fr d'après Du et coll)

Le complexe II transporte 2 électrons au complexe III sans pompage de protons.
Remarque : les mutations du complexe respiratoire humain II provoquent (Complex II Biology in Aging, Health, and Disease 2023) :
- plusieurs types de cancers (Functional succinate dehydrogenase deficiency is a common adverse feature of clear cell renal cancer 2021 et Tumour risks and genotype–phenotype correlations associated with germline variants in succinate dehydrogenase subunit genes SDHB, SDHC and SDHD 2018),
- de troubles neurodégénératifs (Succinate dehydrogenase: Prospect for neurodegenerative diseases 2018).
Complexe III de la chaîne respiratoire
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


