Lipides
Acide gras
Synthèse des acides gras
: vue d'ensemble
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- acides gras (FA)
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques (LD)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La synthèse des acides gras (FA) est la formation d'acides gras (FA) à partir de l'acétyl-CoA et du NADPH, grâce à l'action d'enzymes appelées acides gras synthases (FAS).
Les acides gras (FA) peuvent provenir de plusieurs sources.
a. Ils peuvent être synthétisés de novo, et c'est le but des chapitres suivants,
b. Ils peuvent provenir de plusieurs autres voies :
- la voie alimentaire après digestion (
digestion des lipides).
- la lypolyse intracellulaire dans les gouttelettes lipidiques (Lipid Droplet ou LD),
- la lipolyse dans les lipoprotéines sanguines (
voies des lipoprotéines).
Vue d'ensemble de la synthèse des acides gras
De nombreux tissus peuvent synthétiser les acides gras, mais le tissu adipeux, le foie et l'intestin sont parmi les plus actifs.
Les glucides sont très aisément convertibles en lipides grâce à la glycolyse qui produit la majeure partie de l’acétyl-CoA nécessaire (

L’acétyl-CoA et le malonyl-CoA, sont les deux substrats de l'acide gras synthase (FAS).
Remarque : pour le cas des acides gras à nombre impair de carbone, c'est le propionyl-CoA qui remplace l'acétyl-CoA (
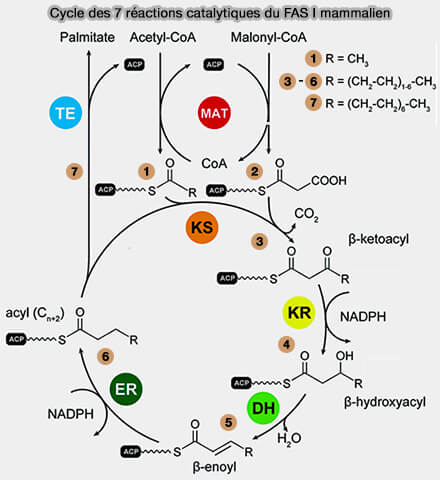
1. La biosynthèse des acides gras nécessite l'intervention de plusieurs activités enzymatiques.
a. Les premières étapes sont catalysées par des enzymes appelées acide gras synthase (FAS ou Fatty Acid Synthase) qui peut se présenter sous deux formes :
- Type I cytoplasmique (FAS I), polypeptide unique chez les mammifères, mais dipeptide chez les levures, pour arriver à l'acide palmitique (C16:0).
- Type II mitochondrial (FAS II), constitués de plusieurs enzymes différentes synthétisant divers acides gras.
b. Les acides gras ainsi formés peuvent être ensuite utilisé tels quels ou allongés dans deux organites (
- la partie microsomale du réticulum endoplasmique (RE), par les élongases, quelquefois appelées FAS III,
- les mitochondries, système mineur, implique paradoxalement certaines enzymes de la bêta-oxydation.
c. Les acides gras peuvent aussi être désaturés par la création de doubles liaisons (
Remarque : certains acides gras peuvent subir des ramifications comme chez les actimomycetales (
2. Par rapport aux glucides et aux protides, les différences entre la biosynthèse des acides gras et leur dégradation, i.e. la β-oxydation, est frappante.
a. Leurs voies sont catalysées par différents ensembles d'enzymes et, chez les eucaryotes, se produisent dans différents compartiments cellulaires.
La dégradation des acides gras se produit dans les mitochondries, tandis que la biosynthèse se produit essentiellement dans le cytosol.
b. En outre, la biosynthèse nécessite le plus souvent la participation de malonyl-CoA, qui n'apparaît pas dans leur dégradation.
Structure générale des FAS I cytoplasmiques

Vous pouvez lire : The architectures of iterative type I PKS and FAS (2018).
La FAS de type I se retrouve chez les mammifères et chez les champignons.
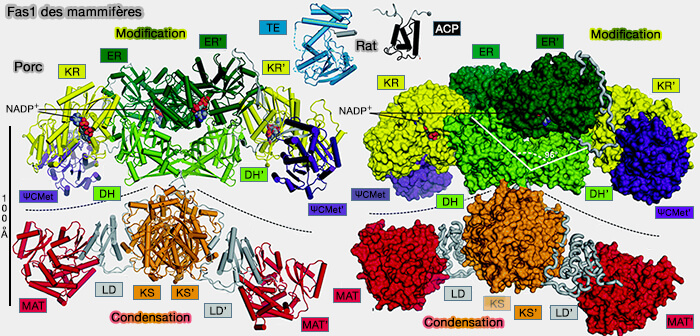
(Figure : vetopsy.fr d'après Herbst et coll)
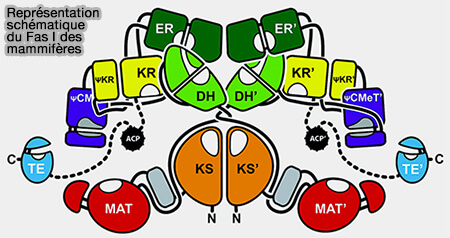
1. FAS I des mammifères est un long polypeptide, i.e. 2 511 résidus chez l’homme, agissant sous forme homodimérique :
- codé par un gène unique,
- contenant à elle seule les sept activités catalytiques nécessaires à la synthèse du palmitate, i. e. acide palmitique, acide gras saturé droit en C16.
Remarque : l'homodimère semble sous forme tête-tête, mais certains auteurs pensent qu'il peut être aussi tête-bêche (L’acide gras synthase, une enzyme « multi-FASette » 2023).
2. FAS I des levures et autres champignons, sous forme docécamérique, est composée de deux polypeptides multifonctionnels, i.e. codés par deux gènes différents, à architecture distincte de celle des vertébrés est composé d'une sous-unité α et d'une sous-unité β (Analysis of the co-translational assembly of the fungal fatty acid synthase (FAS) 2020).
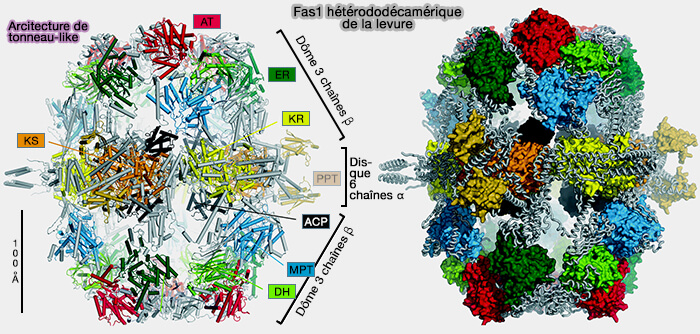
(Figure : vetopsy.fr d'après Herbst et coll)
Domaines de FAS I
La description est celle de la FAS I des mammifères qui est formée de sept domaines fonctionnels (Structural enzymologie of polyketide synthases 2009).
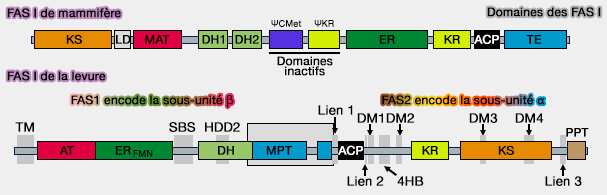
(Figure : vetopsy.fr)
1. La partie N-terminale contient trois domaines :
- le domaine KS, i.e. Kéto-acylSynthase avec un groupe thiol, i.e. $\ce{R-S-H}$ dit souvent périphérique,
- le domaine MAT, i.e. Malonyl/AcétyTransférase avec 2 enzymes différentes,
- le domaine DH, i.e. DésHydratase.
(Figure : vetopsy.fr d'après Herbst et coll)
2. Un interdomaine de 650 résidus environ, sans activité enzymatique, relie la partie N-terminale à la partie C-terminale et pourrait intervenir dans la dimérisation.
3. La partie C-terminale contient quatre domaines :
- le domaine ER, i.e. Enoyl Réductase,
- le domaine KR, i.e. Keto-acylRéductase,
- l'ACP (Acyl Carrier Protein) qui présente l’acide gras en cours d’élongation aux différentes activités catalytiques, avec un groupe thiol, i.e. $\ce{R-S-H}$ dit souvent central,
- le domaine TE (ThioEstérase).
Remarque : le FAS I de la levure comprend certains domaines différents, mais à fonctions souvent semblables.
- La sous-unité α contient un domaine PPT (PhosphoPantéthéine Transférase), i.e. transfère le groupe phosphopantéthéine prosthétique d'un substrat CoA à un sérine conservée de l'apo-ACP, activant ainsi automatiquement le complexe FAS (The Phosphopantetheinyl Transferases: Catalysis of a Posttranslational Modification Crucial for Life 2014),
- La sous-unité β comporte un domaine AT (Acétyl transferase (AT) correspondant à MAT et un domaine MPT (Malonyl-Palmitoyl-Transférase), correspondant à TE.
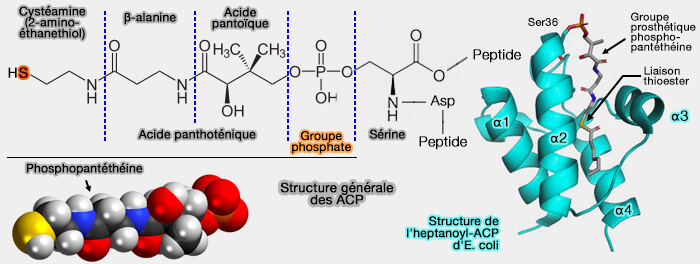
ACP (Acyl Carrier Protein)
Tous les intermédiaires acylés de la biosynthèse des acides gras sont fixés à une protéine particulière, l'ACP (Acyl Carrier Protein), comme tous les intermédiaires de la β-oxydation des acides gras sont activés par liaison à la coenzyme A (CoA).
1. Les ACP comprennent généralement de 70 à 100 résidus, parfois plus, et sont classées en 16 familles (ACP1-16) de structure tertiaire similaire (Acyl carrier protein structural classification and normal mode analysis 2012).
- L'ACP des mammifères est une chaîne polypeptidique unique de 77 résidus.
- L'ACP est une protéine acide avec des valeurs de pH comprises entre 3,9 et 4,3, pH dû à un nombre important de résidus d'aspartate (D) et de glutamate (E) chargés négativement, qui représentent près de 25 % du total des acides aminés.
(Figure : vetopsy.fr)
2. L'ACP possède un groupe prosthétique correspondant à la 4'-phosphopantéthéine (4'PP), i.e. groupe prosthétique qui diffère de CoA qui contient un pyrophosphate (
a. Le groupe phosphate de 4'PP est lié par une liaison phosphodiester sur la chaîne latérale d’un résidu sérine, contenu dans le motif Asp-Ser-Leu hautement conservé au début de l'hélice II, i.e. motif exact (L/F)-x-(D/E)-L-G-L-D-S-L (dit PP-binding, Pfam).
(Figure : vetopsy.fr)
b. La partie active de la molécule est représentée par le groupe thiol, i.e. $\ce{R-S-H}$ terminal, dit souvent central, qui forme une liaison " riche en énergie ", la liaison thioester avec les groupes acylés des acides gras, intermédiaires de la biosynthèse.
L'abréviation de l'ACP comme celle du CoA fait ressortir cette partie active et est notée S-ACP.
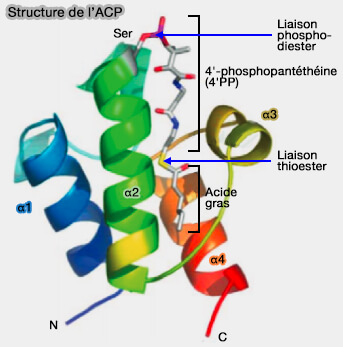
3. L'ACP possède trois longues hélices alpha (α1, α2 et α4) et une hélice courte (α3) conférant une flexibilité structurelle :
- pour se lier à une variété d'intermédiaires acyles,
- pour amener ceux-ci au niveau des différentes enzymes participant aux réactions de biosynthèse.
a. L'hélice II de l'ACP est également appelée hélice de reconnaissance universelle à résidus hautement conservée.
Elle contient le motif Asp-Ser-Leu nécessaire à la fixation du 4′-PP et constitue le site de contact de l'ACP et des enzymes apparentées au cours de la synthèse.
b. Le faisceau de quatre hélices forme une cavité hydrophobe qui protège la chaîne acyle et le fragment β-mercaptoéthylamine du groupe 4′-PP de l'exposition aux solvants (Structural Studies of Fatty Acyl-(Acyl Carrier Protein) Thioesters Reveal a Hydrophobic Binding Cavity that Can Expand to Fit Longer Substrates 2006).
(Figure : vetopsy.fr d'après Herbst et coll)
c. Les hélices II et III agissent comme un point d'entrée pour la chaîne acyle dans la cavité et la partie distale de la chaîne acyle s’oriente vers la poche formée par les hélices II et IV.
d. Le groupe 4′-PP forme la moitié du bras oscillant de l’holo-ACP et sa réorientation dans la solution donne naissance aux deux états conformationnels de l'holo-ACP qui déterminent si le groupe acyle peut entrer dans la cavité hydrophobe (conformeur mineur) ou s'il est empêché d'y entrer (conformeur majeur).
3. Le groupe prosthétique est transféré de la CoA à l'apo-ACP par l'ACP synthase ou holo-[acyl-carrier-protein] synthase, i.e. EC 2.7.8.7 qui fait partie des transférases (Current understanding of fatty acid biosynthesis and the acyl carrier protein 2010).
$\ce{apo-ACP + CoA}$
$\leftrightharpoons$
$\ce{holo-ACP + H+ }$
$\ce{+ adénosine 3',5'-bisphosphate}$
a. La CoA ne participe qu'aux réactions initiale et terminale de cette biosynthèse.
b. In vivo, l'ACP se présente principalement sous forme holo, i.e. l'ajout du groupe prothétique n'est pas une réaction limitante contrôlant indirectement la biosynthèse des acides gras.

Malheureusement, comme d'habitude, les enzymes ont plusieurs noms et on s'y perd facilement, et en plus, ils diffèrent selon les espèces et leur localisation, par exemple mitochondriale.
Étapes de la voie cytoplasmique (voie de Wakil)
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesacides gras (FA)Synthèse des acides grasβ-oxydationOxylipinesLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


