Neurophysiologie : synapse
Vésicules synaptiques : cycle vésiculaire
5. Fusion membranaire et libération du neurotransmetteur
Mécanisme moléculaire
- Neurophysiologie
- Cellules gliales et névroglie
- Neurones
- Potentiels membranaires
- Circuits neuronaux
- Neurotransmetteurs
- Récepteurs membranaires
- Synapses

Le mécanisme moléculaire de l'ouverture des pores de fusion fait intervenir l'afflux de calcium qui déclenche une machinerie complexe composée de nombreuses protéines.
Mécanisme moléculaire de la fusion
La mécanique moléculaire de l'ouverture des pores de fusion a été à de nombreuses reprises modifiée (The Synaptic Vesicle Cycle Revisited: New Insights into the Modes and Mechanisms 2019 et The fusion pore, 60 years after the first cartoon 2018).
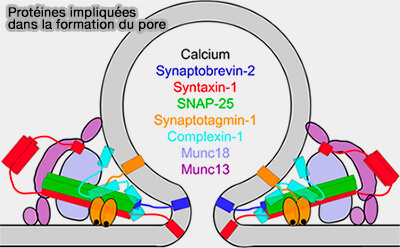
(Figure : vetopsy.fr d'après Sharma et coll)

Le mécanisme général de la fusion est étudié dans plusieurs chapitres spéciaux, ainsi que les principales protéines impliquées dans la figure ci-contre.
1. Le détail du mécanisme de fusion, encore en voie de résolution, permet d'aborder :
- le rapprochement membranaire,
- la formation et l'élargissement de la tige de fusion,
- la formation du pore de fusion,
- l'évolution des pores de fusion.
2. Dans ce chapitre, nous envisageons la machinerie de la dynamique des pores de fusion, dynamique examinée dans une autre page.
Mécanismes de la dynamique des pores
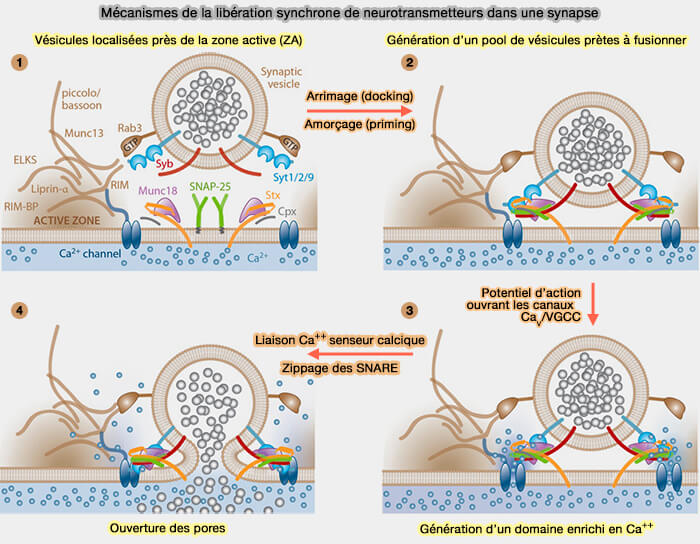
(Figure : vetopsy.fr d'après Kaeser et Regehr)
Ouverture et expansion des pores
1. La liaison au calcium avec la synaptotagmine, par deux boucles de chaque domaine C2, induit les protéines SNARE à servir de médiateur dans les cellules excitables (Molecular mechanisms of fast neurotransmitter release 2018).
La conductance de pore et les mesures actuelles dans les cellules sécrétrices et les nanodisques suggèrent que la machinerie de fusion, y compris les protéines SNARE, est essentiel dans l'ouverture et l'expansion des pores de fusion (Hemifusion in Synaptic Vesicle Cycle 2017 et Dilation of fusion pores by crowding of SNARE proteins 2017).
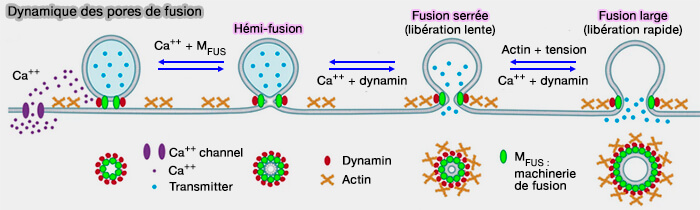
(Figure : vetopsy.fr d'après Wu et Chan)
2. L'imagerie STED a montré que la tension membranaire supportée par l'actine-F corticale peut étendre les pores de fusion jusqu'à des centaines de nanomètres (Visualization of Membrane Pore in Live Cells Reveals a Dynamic-Pore Theory Governing Fusion and Endocytosis 2018 et Actin dynamics provides membrane tension to merge fusing vesicles into the plasma membrane 2016).
a. L'assemblage dynamique de l'actine-F fournirait une tension membranaire suffisante pour faciliter le rétrécissement du profil Ω et ainsi fusionner le profil Ω avec la membrane présynaptique.
Ce processus inclurait les protéines partenaires, i.e. N-WASP, la formine et l'ATP peuvent participer à la fusion du profil Ω.

L'actine cytosquelettique très abondante et sa voie d'assemblage, la molécule essentielle fournissant de l'énergie, l'ATP, et la tension de la membrane cellulaire contrôlée par de nombreux facteurs peuvent ainsi réguler l'exo- et l'endocytose dans des conditions physiologiques et pathologiques en contrôlant la fusion des profils Ω.
b. Le modèle par compression impliqué dans l'endocytose ultrarapide (UFE) pourrait être une alternative ou un complément à ce modèle qui ne nécessite alors aucune dynamique de l'actine pour stabiliser la surface de la membrane.
3. La dynamine interviendrait, par sa déphosphorylation par la calcineurine, dans le contrôle de l'expansion des pores de fusion (Activity-Dependent Fusion Pore Expansion Regulated by a Calcineurin-Dependent Dynamin-Syndapin Pathway in Mouse Adrenal Chromaffin Cells 2016).
4. L'α-synucléine augmenterait considérablement la probabilité ainsi que la durée de vie des grands pores (
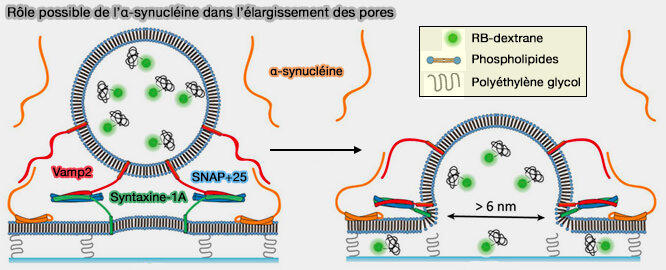
(Figure : vetopsy.fr d'après Khoulo et coll)
Constriction et fermeture des pores
La dynamine est impliquée dans l'expansion ou la stabilisation des pores de fusion.

La dynamine est étudiée dans un chapitre spécial.
1. L'inhibition de la dynamine augmente la libération des quanta, l'impliquant dans le contrôle du pore de fusion (Dynamin 1 Restrains Vesicular Release to a Subquantal Mode In Mammalian Adrenal Chromaffin Cells 2019).
a. L'imagerie STED a montré que (Molecular mechanics underlying flat-to-round membrane budding in live secretory cells 2022) :
- la dynamine est localisée sur les sites de fusion avant la fusion,
- l'inhibition de la dynamine bloque la constriction/fermeture des pores de fusion,
- les filaments d'actine et la dynamine génèrent une force de traction transformant la membrane plate en forme de Λ.
Les hélices de dynamine entourent et resserrent la base du profil Λ, transformant Λ en profil Ω, puis resserrent les pores du profil Ω, convertissant les profils Ω en vésicules (
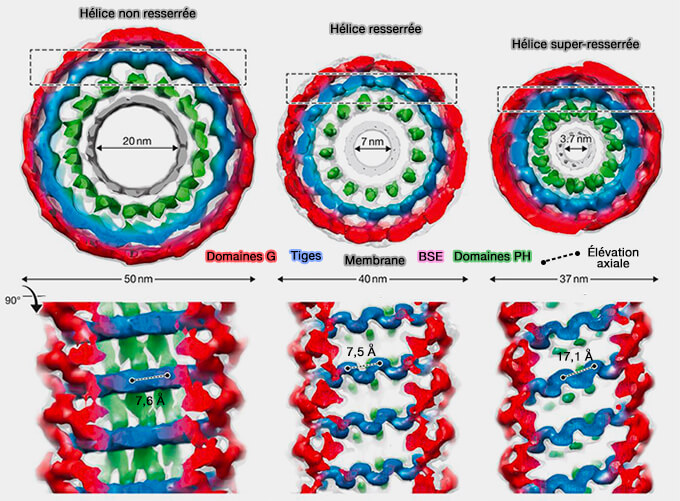
Figure : vetopsy.fr d'après Antonny et coll)
b. Ces mécanismes contrôlent la vitesse de bourgeonnement, la taille et le nombre de vésicules, générant divers modes endocytaires différant par ces paramètres.
2. L'influx d'ions calcium déclenche la constriction/fermeture de fusion en activant la dynamine (Hemi-fused structure mediates and controls fusion and fission in live cells 2016 et Post-fusion structural changes and their roles in exocytosis and endocytosis of dense-core vesicles 2014).
Étant donné que la calcineurine, i.e. protéine de liaison au calcium, et la protéine kinase C peuvent servir de médiateurs de l'endocytose déclenchée par le calcium, elles pourraient activer la dynamine par déphosphorylation et/ou phosphorylation de la dynamine (Calcineurin Is Universally Involved in Vesicle Endocytosis at Neuronal and Nonneuronal Secretory Cells 2014).
Fusion versus fission
1. Si l'influx d'ions calcium peut activer la dynamine pour permettre la constriction et la fermeture des pores, son blocage ou celui de la dynamine inhibe la constriction/fermeture des pores de fusion et augmente ainsi la taille initiale des pores.
Ces effets sont antagonisés en bloquant les mécanismes d'expansion des pores de fusion médiés par l'actine et la tension membranaire (
2. Le blocage de l'influx calcique ou de la dynamine facilite le passage de l'hémifusion à la fusion complète, suggérant que la dynamine agit au stade de l'hémifusion avant l'ouverture des pores pour concurrencer les mécanismes d'ouverture/expansion des pores dépendants de SNARE et de l'actine-F (Hemi-fused structure mediates and controls fusion and fission in live cells 2016).

La constriction dynamine-dépendante du pore et l'expansion des pores SNARE/F-actine-dépendante entrent en compétition pour décider de la dynamique de la fusion, y compris le passage de l'hémifusion à la fusion complète, l'ouverture, l'expansion, la constriction et la fermeture des pores
Cette compétition peut être élevée en principe général régissant la dynamique des pores de fusion, mais peut être complétée par d'autres mécanismes.
Et les grandes vésicules (LSV) ?
Les cellules chromaffines neuroendocrines contiennent des vésicules de plus de 300 nm qui libèrent leur contenu en quelques millisecondes à plusieurs secondes (Dynamically Primed Synaptic Vesicle States: Key to Understand Synaptic Short-Term Plasticity 2018).
1. Une des différences majeures avec les vésicules synaptiques (VS) est que les cellules chromaffines n'ont pas de limite supérieure du nombre de granules prêts à la libération.
- Ce qui semble être le pool rapidement libérable (RRP) de granules chromaffines, i.e. nombre total de granules qui fusionnent par un flash de Ca++, correspond à la somme des vésicules LS et TS et dépend de la concentration en Ca++ avant le stimulus.
- L'absence de preuves d'une limite supérieure par rapport aux tailles des pools LS et TS peut indiquer que des structures typiques de type ZA, qui n'ont pas été documentées pour les cellules de chromaffine, ne sont pas nécessaires pour l'amarrage et l'amorçage des granules denses.

La transformation de la membrane des LSV et les mécanismes sous-jacents ont été observés dans les glandes salivaires larvaires de la drosophile, qui libèrent des glycoprotéines mucineuses adhésives surnommées " glue " pour faciliter la métamorphose (Fusion pore dynamics of large secretory vesicles define a distinct mechanism of exocytosis 2023)..
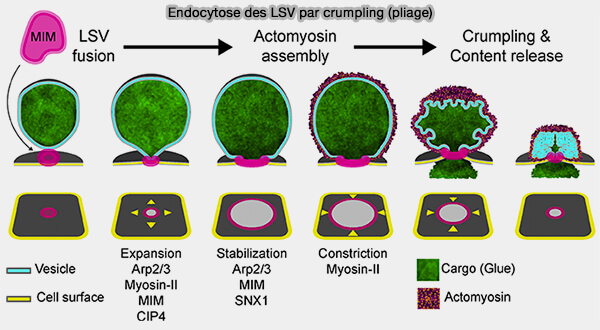
(Figure : vetopsy.fr d'après Biton et coll)
2. Le mode de fusion est appelé membrane crumpling, i.e. froissage ou pliage membranaire, i.e. la contraction générée par l'actomyosine rétrécit partiellement le profil Ω généré par la fusion, plie le profil Ω et expulse le contenu.
a. Les auteurs ont rapporté trois modes de fusion supplémentaires.
- Un mode ressemblant à l'effondrement complet, i.e. full-collapse-like, impliquant un rétrécissement du profil Ω jusqu'à ce que sa largeur soit inférieure à celle du pore, après quoi le profil Ω est converti en un profil en forme de Λ puis en une membrane plate.
- Un kiss-and-run implique la fermeture des pores du profil Ω.
- Un stalling, i.e. décrochage ou blocage, implique un profil Ω inchangé.
b. La distinction des deux derniers modes semble difficile, car il n'a pas été possible de déterminer de manière univoque si la vésicule était observée avant ou après la fusion ou avec un pore ouvert ou fermé.
2. Cette endocytose nécessite :
- l'actine, Arp2/3, CIP4 (Cdc42-interacting protein 4), un paralogue des protéines F-Bar, et MIM pour l'expansion des pores,
- Arp3, MIM ou d'autres protéines à domaine BAR pour la stabilisation des pores,
- l'actine et la myosine II qui compriment en quelques minutes les grandes vésicules par l'augmentation de la pression osmotique (
interactions actine/myosine).

L'actomyosine et les protéines à domaine BAR coopèrent pour dilater le pore initialement, puis le stabiliser et le resserrer.
Cette endocytose diffère de l'endocytose des vésicules synaptiques (How micron-sized exocrine vesicles release content: A comparison with sub-micron endocrine vesicles 2023).
3. D'autres différences majeures concernent les différences entre (
- les courbures membranaires, considérées comme presque plates pour les grandes vésicules,
- les zones de contacts qui sont beaucoup plus importantes.
Retour à la fusion des VS
NeurophysiologeCellules gliales et névroglieNeuronesPotentiels membranairesCircuits neuronauxNeurotransmetteursRécepteurs membranairesSynapsesStructure synaptiqueNeurotransmissionVésicules synaptiques (VS)Pools synaptiquesRôles du calcium dans l'électrosécrétionCycle synaptiqueTranslocation et attache (tethering)Amarrage (docking) et amorçage (priming)Fusion et exocytoseRecyclage des VSDifférents types d'endocytoseAcidification et remplissage des VSRegroupement des VSPlasticité et régulation synaptique


