Neurophysiologie : synapse
Terminaisons présynaptiques
Synucléines : structure
- Neurophysiologie
- Cellules gliales et névroglie
- Neurones
- Potentiels membranaires
- Circuits neuronaux
- Neurotransmetteurs
- Récepteurs membranaires
- Synapses

Les synucléines sont une famille de protéines solubles des vertébrés, principalement exprimées au niveau des terminaisons présynaptiques.
Leur nom est un mélange des mots synapse et noyau, i.e. nucleus, comme il a d'abord été trouvé dans les synapses de la torpille ou raie électrique (Electric Organs and Their Control 2005).
Famille des synucléines
La famille de la synucléine comprend trois protéines qui ont en commun une hélice amphipathique (AH) qui interagit avec les membranes (
α-synucléine
L'α-synucléine est une protéine neuronale qui régule le trafic de vésicules synaptiques et la libération ultérieure des neurotransmetteurs.
1. L'α-synucléine est très abondante au niveau cérébral, principalement au niveau des terminaisons présynaptiques, dans lesquelles elle interagit avec les phospholipides et les protéines (
Elle se trouve aussi en petite quantité dans le cœur, les muscles et les autres tissus.
2. On la trouve, outre les terminaisons présynaptiques, dans :
- le noyau principalement,
- dans les mitochondries (
maladie (ou démence) à corps de Lewy).

(Figure : vetopsy.fr d'après Serpell et coll)
Remarque : son repliement aberrant, formant des fibrilles amyloïdes préformées (PFF preformed αSyn amyloid fibrils) est un constituant majeur des corps de Lewy et des neurites de Lewy (Addition of exogenous α-Synuclein Pre-formed fibrils to Primary Neuronal Cultures to seed recruitment of endogenous α-Synuclein to Lewy body and Lewy Neurite-like aggregates 2015).
Ce processus est caractéristique de la maladie de Parkinson (PD) et d'autres maladies appelées α-synucléinopathies, le plus souvent dues à un dysfonctionnement mitochondrial.
β-synucléine et γ-synucléine
1. La β-synucléine ne se trouve pas dans les corps de Lewy, mais est associée à une pathologie hippocampique dans la PD et le DLB. [8]
- La bêta-synucléine pourrait inhiber l'agrégation d'α-synucléine dans les maladies neurodégénératives.
- Elle pourrait fournir un nouveau traitement des troubles neurodégénératifs. [9] [10] (Axon degeneration and PGC-1α-mediated protection in a zebrafish model of α-synuclein toxicity 2012).
2. La γ-synucléine est impliquée dans divers processus liés à l'activité et à la modulation synaptiques, suggérant son rôle potentiel dans le contrôle des processus de membrane synaptique et de la biogenèse.
Elle a aussi la particularité d'être retrouvée dans de nombreuses tumeurs, en particulier dans le cancer du sein, dans lequel elle est un marqueur de la progression tumorale.
- Un changement dans l'expression de la gamma-synucléine a été observé dans la rétine de patients atteints de la maladie d'Alzheimer.
Structure des synucléines
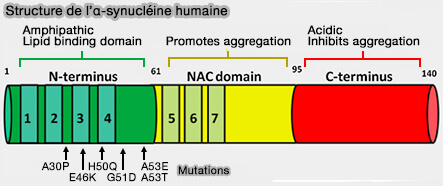
L'α-synucléine est une protéine de 140 acides aminés qui régule le trafic de vésicules synaptiques et la libération ultérieure des neurotransmetteurs.
(Figure : vetopsy.fr d'après Marvin 101)
1. La région N-terminale, i. e. résidus 1-60, est constituée de quatre répétitions imparfaites, incluant une séquence consensuelle KTKEGV (Stabilization of α-Synuclein Secondary Structure upon Binding to Synthetic Membranes 1998).
a. Cette hélice amphipathique (AH) interagit avec les membranes (
- Cette AH, caractérisée par la présence de résidus basiques à l'interface polaire-non polaire de ses deux faces, est bien adaptée à l'interaction avec les membranes, en y enfonçant un " coin " (wedging mechanism).
- Cette AH présente une forte similitude avec celle de l'apolipoprotéine A2 (apoA-2).
b. Cette région peut être acétylée et préserve les monomères désordonnés contre l'oligomérisation dans les cellules non neuronales et neuronales dans des conditions physiologiques.
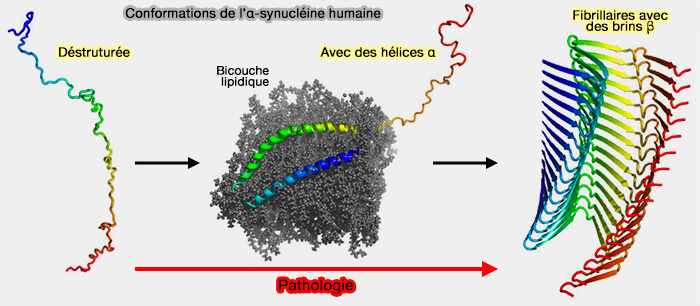
- Les monomères, liés à la membrane, subissent un changement conformationnel pour former des intermédiaires riches en β (protofibrilles) lors de l'accumulation, puis s'auto-associent à des oligomères en anneaux ou aux fibrilles amyloïdes sur la membrane (α-Synuclein Multimers Cluster Synaptic Vesicles and Attenuate Recycling 2016).
- Les oligomères annulaires liés au cytosol et à la membrane peuvent former des pores transmembranaires qui perturbent l'intégrité de la membrane, de l'homéostasie du calcium intracellulaire et de la signalisation (The many faces of α‑synuclein: from structure and toxicity to therapeutic target 2013).
(Figure : vetopsy.fr d'après CNRS)
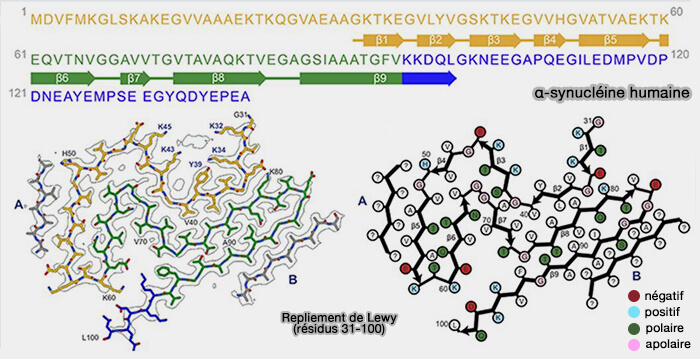
2. Le composant non-β-amyloïde (NAC), i.e. résidus 61-95, qui comprend en outre trois répétitions imparfaites, est une région hydrophobe impliquée dans l'agrégation, nécessaire à l'assemblage de la α-synucléine recombinante en filaments (Molecular cloning of cDNA encoding an unrecognized component of amyloid in Alzheimer disease 1993).
- Ce domaine est spécifique à α-synucléine (Propagation of alpha-synuclein pathology: hypotheses, discoveries, and yet unresolved questions from experimental and human brain studies 2016).
- Lors de l'assemblage, l'α-synucléine recombinante subit des changements conformationnels et prend une structure croisée β qui est caractéristique de l'amyloïde (Fiber diffraction of synthetic α-synuclein filaments shows amyloid-like cross-β conformation 2000).
- Le noyau des filaments de synucléine bêta assemblés à partir de la protéine recombinante in vitro s'étend à partir d'environ les résidus 30-100 (Biochemical Characterization of the Core Structure of α-Synuclein Filaments 2002).
(Figure : vetopsy.fr d'après le CNRS).
3. La région C-terminale, i.e. résidus 96-140, est une région très acide et riche en proline (domaine PRD) qui est intrinsèquement désordonnée (IDR) et joue un rôle important dans la fonction, la solubilité et l'interaction de l'alpha-synucléine avec d'autres protéines.
- Sa troncature entraîne une augmentation de la formation de filaments (Carboxy-terminal truncations of mouse alpha-synuclein alter aggregation and prion-like seeding 2020).
- Or, l'α-synucléine pourrait subir une autoprotéolyse qui génère des fragments plus petits, i.e. 14–133, 40–140, 72 –140, ce dernier, qui contient la majorité de la région du NAC, a agrégé bien plus rapidement que l'alpha-synucléine pleine longueur et pourrait jouer un rôle d'intermédiaires ou de cofacteurs dans son agrégation in vivo (Autoproteolytic Fragments are Intermediates in the Oligomerization- Aggregation of Parkinson’s Disease Protein Alpha-Synuclein as Revealed by Ion Mobility Mass Spectrometry 2012).
β-synucléine et γ-synucléine
Ces deux synucléines, à structure très similaire à celle de l'α-synucléine, ne contiennent pas de domaine (NAC).
La γ-synucléine se caractérise par une partie C-terminale différente des autres synucléines.
Interactions et fonctions des synucléines
NeurophysiologeCellules gliales et névroglieNeuronesPotentiels membranairesCircuits neuronauxNeurotransmetteursRécepteurs membranairesSynapsesStructure synaptiqueNeurotransmissionVésicules synaptiques (VS)Pools synaptiquesRôles du calcium dans l'électrosécrétionCycle synaptiqueTranslocation et attache (tethering)Amarrage (docking) et amorçage (priming)Fusion et exocytoseRecyclage des VSDifférents types d'endocytoseAcidification et remplissage des VSRegroupement des VSPlasticité et régulation synaptique


